
Importância da avaliação hemodinâmica invasiva no diagnóstico de um caso pericardite constritiva
Anabela Raimundo, Manuel Sousa,
Manuela Coelho, Vitor Garcia Nunes, Fernando Lacerda Nobre
Unidade de Cuidados Intensivos Polivalente
Hospital de Santa Marta, Lisboa, PORTUGAL
Resumo
Apresenta-se um caso de pericardite
constritiva tuberculosa, cujo diagnóstico foi dificultado pelos vários achados
ecocardiográficos.
Doente de 42 anos, raça negra, com hábitos
etanólicos, internado por derrame pleural a esclarecer. Teve alta com o
diagnóstico de provável tuberculose pulmonar e pleural. No ecocardiograma não
apresentava constrição pericárdica. Reinternado 5 dias depois por agravamento
clínico. Segundo ecocardiograma: não conclusivo. Alta. Reinternado 48h depois
por novo agravamento sintomático. Terceiro ecocardiograma: Constrição
pericárdica. Transferido para o serviço de cirurgia cardio-torácica. No
pós-operatório de drenagem pleural e biópsia pericárdica: edema pulmonar agudo
e choque com necessidade de ventilação
e uso de aminas vasoactivas. Ecocardiograma de urgência sem alterações
significativas. A monitorização hemodinâmica revelou tratar-se de choque
cardiogénico, secundário a constrição. Foi realizada pericardiotomia subtotal
ante-frénica.
Apesar do número cada vez mais reduzido de
indicações para a monitorização hemodinâmica, neste caso, esta forneceu dados sobre a função cardíaca
que confirmaram a suspeita diagnóstica e consequente terapêutica.
Palavras
chave:
Pericardite tuberculosa constritiva; Monitorização hemodinâmica invasiva;
Corticoterapia; Pericardiotomia.
Introdução
A pericardite constritiva é uma entidade
nosológica rara, cuja etiologia se tem vindo a alterar ao longo do tempo. Até
aos anos 70 a etiologia infecciosa com particular ênfase na tuberculose era a
causa mais frequente a seguir às idiopáticas. Com a era da terapêutica
anti-bacilar e consequente diminuição da incidência da doença, tornou-se cada
vez mais raro o seu aparecimento em Portugal. No entanto o surgimento da
síndrome de imunodeficiência adquirida e as infecções a este associadas, nas
quais se incluem a tuberculose, levaram ao reaparecimento dos seus diferentes
quadros clínicos (6). É importante referir que nas séries americanas a
etiologia mais frequente são as pericardites pós cirúrgicas e as pós
radioterapia o que mostra a evolução da medicina nas últimas décadas (1-3).
A história natural da pericardite tuberculosa
caracteriza-se por um quadro inicial de derrame pericárdico que vai sendo
progressivamente absorvido, com subsequente espessamento do pericárdio,
proliferação de granulomas e deposição de uma espessa camada de fibrina no
pericárdio parietal, podendo ou não existir o aparecimento de caseum que
penetra o miocárdio. No estádio final da doença os granulomas são substituídos
por tecido fibroso e colagéneo. Estas alterações são seguidas da deposição de
cristais de colesterol e calcificação. A instituição de terapêutica com
anti-bacilares consegue interromper esta evolução em cerca de 50% dos casos (4)
, sendo a corticoterapia adjuvante em geral aconselhada, apesar de existirem
algumas dúvidas quanto à sua eficácia (6,7). Um estudo realizado na África do
Sul onde a incidência de pericardite tuberculosa é significativa descreveu o
benefício desta terapêutica na pericardite constritiva (5), não havendo no
entanto nenhum estudo sobre a sua eficácia no estádio inicial. Assim alguns
autores defendem o seu uso apenas nos doentes gravemente doentes com derrames
recorrentes que não respondem à terapêutica anti-bacilar. Quanto à
pericardiotomia a grande maioria dos autores defendem a sua precocidade em
doentes com grandes derrames, quadros clínicos compatíveis com compressão
cardíaca por tamponamento-constrição ou constrição precoce (6). A suportar esta
recomendação existem vários estudos que referem um melhor prognóstico com a
recuperação de todos os sintomas quando a cirurgia não é protelada (9).
Uma síndrome de baixo débito cardíaco pode
persistir após a pericardiotomia num número considerável de doentes, tendo sido
apontado como causa para este fenómeno um envolvimento do miocárdio com fibrose
epicárdica penetrando profundamente ou alterações atróficas do miocárdio por
constrição prolongada (4). Assim a permanência de sintomas é mais frequente
quando já existe calcificação do pericárdio ou o processo tem uma maior
duração.
O diagnóstico desta doença foi sempre alvo de
interesse em face da dificuldade que apresenta (10). Actualmente com os meios
diagnósticos ao nosso dispor a
determinação da etiologia e da existência de constrição está mais facilitado. O
tamponamento cardíaco e a cardiomiopatia restritiva são entidades cujo
diagnóstico diferencial deve ser considerado fundamental. Este torna-se ainda
mais complicada visto estas poderem estar associadas (8). O aparecimento das
técnicas de imagem tais como a TAC e a ressonância magnética e o
importantíssimo papel do ecocardiograma especialmente do doppler cardíaco, com
a descrição das diferentes características
de cada uma destas entidades nosológicas (11-14), vieram facilitar
grandemente o diagnóstico destas patologias e retirar ao cateterismo cardíaco e
à monitorização invasiva o seu papel neste contexto, nos doentes estáveis do
ponto de vista hemodinâmico e ventilatório (11-13). Ainda mais quando a
monitorização cardíaca invasiva apresenta indicações cada vez mais restritas e
precisas. No entanto nas situações agudas com necessidade de internamento em
unidades de cuidados intensivos em que os doentes necessitam de suporte
ventilatório o papel do ecocardiograma transtorácico está francamente
prejudicado, em face das limitações que apresenta neste contexto - limitações à
mobilização do doente e à qualidade das imagens durante a ventilação mecânica
ou no pós-operatório (15).
Caso
clínico
Doente de 42 anos, raça negra, com hábitos
etanólicos acentuados, internado por derrame pleural a esclarecer. Foi
efectuada drenagem de líquido e biópsia pleural. O líquido apresentava características
de exsudado e o resultado histológico da biópsia foi “...marcado infiltrado
inflamatório crónico com presença de ocasionais granulomas epitelióides com
necrose caseosa e células gigantes tipo Langhans. Compatível com Pleurite granulomatosa, consistente com
etiologia específica.". Realizou TAC torácica (Fig. 1) que mostrou
derrame pericárdico com aparente espessamento dos folhetos pericárdicos, a
valorizar por ecocardiograma. Condensação da lingula, com broncograma aéreo
associando-se a derrame pleural homolateral. Registam-se adenomegalias em
topografia pre-vascular, latero-traqueais, pre-carinais e sub-carinais, nestas
últimas observam-se calcificações.
Fig. 1: Tomografia axial computorizada torácica
mostrando derrame pericárdico (seta).
b
Os aspectos descritos podem corresponder a
processo pneumónico específico, a valorizar com os dados
clínicos/laboratoriais.” Efectuou ecocardiograma (Fig. 2 e 3) para
esclarecimento da situação cujo resultado foi: “Ventrículo esquerdo não
dilatado/razoável função sistólica global. Sem evidência de valvulopatia
estrutural. Insuficiência mitral ligeira, aurícula esquerda não dilatada,
derrame pericárdico volumoso, conteúdo muito ecogénico (fibrina? empiema?). Sem
sinais de aumento da pressão intra-pericárdica. Derrame pleural esquerdo
volumoso”.

Fig. 2: Ecocardiograma em via apical 4 câmaras mostrando derrame pericárdico com conteúdo sugestivo de fibrina.

Fig. 3: Primeiro eco Doppler do fluxo das veias supra hepáticas.
Teve alta com o diagnóstico de provável
tuberculose pulmonar e pleural, baseado no resultado da biópsia efectuada, sem
isolamento de agente. Tendo iniciado anti-bacilares (Isoniazida, Rinfapicina,
Etambutol e Pirazinamida) e Prednisona. Foi reinternado 5 dias depois por
dispneia para pequenos esforços e volumoso derrame pleural esquerdo. Este foi
novamente drenado, tendo surgido pequeno pneumotórax iatrogénico que resolveu
espontaneamente. O aparecimento de edema
dos membros inferiores e agravamento da dispneia justificou novo ecocardiograma
(Fig. 4): “…diminuição do derrame pericárdico, a análise do fluxo das
supra-hepáticas não esclareceu sobre a existência de constrição pericárdica”.

Fig. 4: Segundo Eco
Doppler do fluxo das veias supra hepáticas.
O agravamento da clínica condicionado pelo
refazer do derrame pleural motivou segunda drenagem com melhoria. O
aparecimento de condensação pneumónica justificou antibioterapia com
ceftriaxone e gentamicina. Tendo ainda sido introduzidos IECA e diuréticos com
melhoria do quadro, além da terapêutica com anti-bacilares e prednisona que
manteve sem interrupções. O doente teve alta, sendo reinternado 48h depois por
agravamento sintomático. Apresentava na altura derrame pleural esquerdo, ascite
com discreta dilatação das veias supra-hepáticas confirmadas por ecografia
abdominal (Fig.5 e 6) e edemas dos membros inferiores.

Fig. 5: Ecografia abdominal revela volumosa ascite.

Fig. 6: Ecografia
abdominal mostra dilatação das veias supra-hepáticas.
Realizou ecocardiograma (Fig. 7) que revelou
"…espessamento pericárdico de 10mm, derrame pericárdico, baixa mobilidade
do VE, sugerindo constrição pericárdica…".
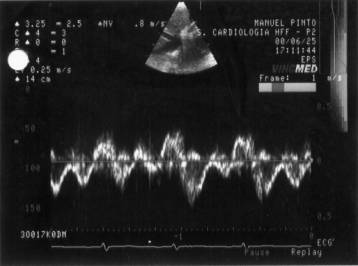
Fig. 7: Terceiro
Eco Doppler do fluxo das veias supra hepáticas com padrão sugestivo de constrição
pericárdica.
Foi transferido para o serviço de Cirurgia
Cardio-Torácica do Hospital de Santa Marta para resolução da situação. À
entrada apresentava valores tensionais
tendencialmente baixos, tons cardíacos apagados, auscultação pulmonar com murmúrio
vesicular diminuído nos dois terços inferiores do hemitórax esquerdo, ascite
franca, circulação colateral abdominal visível e edemas dos membros inferiores
até às articulações dos joelhos. Perante este quadro foi decidido efectuar
drenagem de derrame pleural, drenagem de derrame pericárdico e biópsia
pericárdica. A cirurgia decorreu normalmente com drenagem de cerca de 1000cc de
líquido pleural e uma quantidade insignificante de líquido pericárdico. No
pós-operatório imediato após extubação e recobro da anestesia desencadeia edema pulmonar agudo e choque (hipotensão e
anúria) com necessidade de ventilação mecânica e suporte de aminas vasoactivas em doses elevadas. Efectuou paracentese
evacuadora para alívio de ascite, seguida de ecocardiograma urgente na Unidade
de Cuidados Intensivos de Cirurgia Cardio-Torácica para esclarecimento da
etiologia do edema pulmonar, com o seguinte resultado: “Más imagens. Em
paraesternal consegue observar-se que o ventrículo esquerdo não está dilatado e
a função sistólica está globalmente conservada. Válvulas mitral e aórtica sem
alterações. Pericárdio parecendo espessado, sem derrame ou com derrame
pequeno.” . Transferido para a Unidade de Cuidados Intensivos Polivalente por
manutenção de choque refractário à terapêutica instituída. À entrada
apresentava ingurgitamento jugular, PVC elevada, débito urinário reduzido,
hipotensão grave, taquicardia, estase discreta na auscultação pulmonar da base
esquerda, edemas dos membros inferiores até à raiz dos membros, saturações de O2
de 95% e temperatura axilar de 38,5°C. Perante a
gravidade da situação e a resistência às medidas terapêuticas instituídas
(dopamina, dobutamina e noradrenalina em doses elevadas) foi decidida
introdução de catéter de Swan-ganz para monitorização hemodinâmica, o que foi
efectuado sem complicações. Os valores obtidos foram os seguintes: Débito
cardíaco-2.6 l; Índice cardíaco-1.4 l/m/m2; Resistências vasculares
sistémicas-2017 mmHg; Resistências vasculares pulmonares-163 mmHg; Índice de
trabalho do ventrículo esquerdo-9 g.m/m2; Índice de trabalho do ventrículo
direito-1 g.m/m2; Pressão venosa central-22 mmHg; Pressão capilar pulmonar-20
mmHg; Pressão aurícula direita-22 mmHg. Perante estes valores admitiu-se choque
cardiogénico por pericardite constritiva tendo sido efectuada pericardiotomia
subtotal ante-frénica e colocação de drenagem torácica à esquerda. O aspecto
macroscópico da peça operatória (Fig. 8) era de pericárdio parietal espessado e
camada de caseum entre os folhetos pericárdicos e o resultado anatomo-patológico
mostrou necrose caseosa e células gigantes tipo Langhans (Fig. 9).

Fig. 8: Aspecto macroscópico
da peça operatória mostrando pericárdio parietal espessado e camada de caseum
entre os folhetos pericárdicos.

Fig. 9: Imagem microscópica mostrando necrose caseosa e células gigantes tipo Langhans.
No pós operatório apresentou disfunção
ventricular com baixo débito com necessidade de suporte de aminas vasoactivas
prolongado e dificuldade no desmame do ventilador, interrompidos o primeiro ao
5º dia e o segundo ao 3º, assim como a monitorização hemodinâmica.
Foi efectuado ecocardiograma ao 6º dia de pós
operatório com o seguinte resultado: "Boa função sistólica global do
ventrículo esquerdo; relação E/A normal; Sem derrame pericárdico significativo
(posterior 5mm)".
O exame cultural da peça cirúrgica foi
positivo para BK ao 30º dia de incubação. Durante todo este processo manteve
terapêutica anti-bacilar tripla e corticoterapia, tendo sido transferido para o
hospital de origem melhorado.
Discussão
Nas descrições clássicas da pericardite
constritiva tuberculosa o diagnóstico era feito pelo aparecimento de
calcificações na radiografia de tórax, o que na realidade actual se torna cada vez
mais raro e dificulta o diagnóstico. Neste doente parece claro o
desenvolvimento de um folheto pericárdico fibro-elástico que condicionou o
quadro de constrição, sem calcificação.
Nos últimos anos têm surgido múltiplos
artigos sobre o diagnóstico da pericardite constritiva por ecocardiograma,
sendo as alterações evidenciadas no estudo doppler pulsado ao nível das veias
supra-hepáticas e da válvula mitral e a sua variação com a respiração assim
como as velocidades diastólicas do ventrículo esquerdo no eixo longitudinal
determinadas por doppler que têm despertado mais interesse (11-14). Além como é
óbvio da observação de espessamento pericárdico e/ou derrame pericárdico no
modo M e bidimensional. Neste doente os ecocardiogramas efectuados demonstraram
inicialmente uma pericardite, caracterizada por derrame pericárdico volumoso a
fase exsudativa aguda, mas que aparentemente não condicionava alterações da
função, tendo o segundo exame demonstrado melhoria deste, o que levaria a supor
uma resposta à terapêutica instituída. Assim as suspeitas de qual a etiologia
dos sintomas do doente recaíram sobre o derrame pleural recidivante. Só o
terceiro exame sugeriu constrição pericárdica, o que levou à transferência do
doente. No intra-operatório inicial a observação directa do coração não levou a
pensar numa constrição grave. E o facto de parecer não haver resposta à
terapêutica anti-bacilar levou a uma atitude conservadora inicial de confirmar
por biópsia pericárdica a existência de pericardite tuberculosa que até aí não
tinha sido conseguida. A entrada do doente em choque foi inesperada, visto este
encontrar-se estável do ponto de vista hemodinâmico e respiratório e a drenagem
do derrame pleural teoricamente levar a uma melhoria da ventilação. Assim e
perante a situação clínica grave que surgiu com resistência à terapêutica, o
facto da situação se apresentar num pós-operatório e a concomitância da febre
as hipóteses de choque cardiogénico versus hipovolémico versus séptico
perfilavam-se, nesta fase o ecocardiograma transtorácico não foi capaz de fazer
o diagóstico diferencial, lançando dúvidas sobre o diagnóstico de pericardite
constritiva ao referir duvidoso espessamento pericárdico e não atribuindo uma
causa cardíaca ao quadro de choque que o doente apresentava. É de notar que os
resultados do ecocardiograma em UCIs pode ser inadequado (15) na realização do
diagnóstico num número de doentes que pode ir até aos 64%. Nesta altura a
realização de ecocardiograma transesofágico poderia ter sido adequada (15), mas
não foi possível por condições logísticas. Assim ao ser transferido para a
Unidade de Cuidados Intensivos Polivalente, e perante as dúvidas quanto ao
diagnóstico, a monitorização hemodinâmica invasiva com a colocação de catéter
de Swan-Ganz foi o único método que nos permitiu estabelecer sem margem para
dúvidas a existência de um quadro de constrição, ao mostrar resistências
periféricas elevadas e índice de trabalho do ventrículo esquerdo baixo o que excluía o choque séptico e
hipovolémico e equalização das pressões nas aurículas (1,7) o que caracteriza a
pericardite constritiva, assim como a característica curva do ventrículo
direito com dip e plateau diastólico que este doente também apresentava, mas
que infelizmente não nos é possível apresentar, por avaria da registadora.
Apesar do número cada vez mais reduzido de
indicações para a monitorização hemodinâmica, esta fornece dados valiosos sobre a função cardíaca (16) e neste caso
permitiu confirmar uma suspeita diagnóstica e consequentemente uma terapêutica
adequada, que a ser protelada ou não executada levaria à morte do doente. Neste
caso era clara a indicação para a sua utilização pois esta inclui o choque
refractário à terapêutica com aminas em doses baixas e este doente foi
refractário a doses elevadas e o diagnóstico da causa do choque (16).
Aparentemente a recidiva do derrame pleural
pode ser atribuído não só à tuberculose mas principalmente à insuficiência
cardíaca provocada pela constrição. Este caso parece incluir-se nos 50%
daqueles em que a corticoterapia não foi eficaz na não progressão para a
constrição, o que nos parece ser uma chamada de atenção para a necessidade de
seguimento cuidadoso dos doentes que desenvolvem derrame pericárdico. Neste
caso a evolução rápida e a ineficácia da terapêutica parece apontar para um
diagnóstico já numa fase avançada da doença (4-6).
Conclusão
Em conclusão o diagnóstico da pericardite
constritiva tuberculosa continua a ser demorado e difícil apesar dos novos
meios complementares de diagnóstico surgidos nas duas últimas décadas. Esta
demora pode condicionar situações graves com risco para a vida dos doentes.
Assim e apesar da eficácia dos meios não invasivos quando persistem dúvidas
quanto ao diagnóstico devemos socorrer-nos de todos os meios ao nosso alcance o
que incluí a monitorização hemodinâmica invasiva. Pois apesar desta apresentar
riscos bem conhecidos por nós, quando executada criteriosamente e segundo as
indicações aprovadas internacionalmente pode fornecer dados valiosos no
tratamento dos doentes críticos.
NOTA: Durante a investigação para a
elaboração deste trabalho contactámos com o médico assistente do doente que nos
informou que foi diagnosticado um Linfoma não Hodgkin tipo B de baixo grau de
malignidade, para o qual o doente vai iniciar terapêutica brevemente. Não
podemos deixar de colocar a hipótese de o doente ter desenvolvido uma infecção
tuberculosa devido ao estado de imunodepressão que a patologia neoplásica
condiciona.
Agradecimentos:
Dr. Jorge Zamite - Assistente Graduado de
Medicina Interna. Instituto Português de Oncologia de Lisboa
Dr. José Rodriguez Santana - Interno do
Internato Complementar de Medicina Interna
Dra. Eugénia Pinto - Assistente Graduada de
Anatomia Patológica. Hosp. Sta. Marta
Dr. Vaz Velho - Chefe de Serviço de Cirurgia
Cardio-Torácica. Hosp. Sta. Marta
Dra. Alexandrina Quintino - Assistente
Graduada de Medicina Interna. Hosp. Sta. Marta
Bibliografia
1.
Schiavone
WA. The Changing Etiology of Constritive Pericarditis in a Large referral
Center. The Am Heart J.1986;58:373-375.
2.
Cameron
J, oesterle SN, Baldwin JC, Hancock EW. The Etiologic Spectrun of Constritive
Pericarditis. Am Heart
J.1987;113:354-359.
3.
Ling
LH, Oh JK, Schaff HV, Danielson GK, Mahoney DW, Seward JB, Tajik AJ.
Constritive Pericarditis in the Modern Era. Circulation.1999;100:1380-1386.
4.
Suwan
PK, Potjalongsilp S. Predictors of constritive pericarditis after tuberculous
pericrditis. B Heart J.1995; 73:187-189.
5.
Strang
JIG, Gibson DG, Mitchison DA, Girling DJ, Kakaza HHS, Allen BW, Evans DJ, Nunn AJ,
Fox W, Controlled Clinical Trial of Complete Open Surgical Drainage and of
Prednisolone in treatment of Tuberculous pericardial effusion in Transkei.
Lancet.1988; 2:759-763.
6. Fowler NO. Tuberculous Percarditis. JAMA.1991;266:99-103
7.
Hancock
EW. Subacute Effusive-Constritive Pericarditis. Circulation.1971; 43:183-192.
8.
Hancock
EW.On the elastic and rigid forms of constritive pericarditis. American Heart
Journal 1980;100:917-923.
9.
Senni
M, Redfield MM, Ling LH, Danielson GK, Tajik AJ, Oh JK. Left Ventricular
Systolic and Diastolic Functoin After Pericardiectomy in Patients With
Constritive Pericarditis. JACC.1999;33:1182-8.
10.
Sagristà-Sauleda
J,Permanyer-Miralda G, Soler-Soler J. Tuberculous Percarditis: Ten Year
Experience With a Prospective Protocol for Diagnosis and treament.
JACC.1988;11:724-728.
11.
Oh JK,
Hatle LK, Seward JB, Danielson GK, Schaff HV, Reeder GS, Tajik AJ. Diagnostic
Role of Doppler Echocardiogrphy in Constritive Pericarditis.
JACC.1994;23:154-162.
12.
Garcia
MJ, Rodriguez L, Ares M, Griffin BP,Thomas JD, Klein AL Differentiation of
constritive Pericarditis From Restritive Cardiomyopathy: Assessement of Left
Ventricular Diastolic Velocities in Longitudinal Axis by Doppler Tissue
Imaging. JACC.1996; 27:108-114.
13.
Hurrell
DG, Nishimura RA, Higano ST, Appleton CP, Danielson GK, Holmes DR, Tajik AJ.
Value of Dynamic Respiratory Changes in Left and Right Ventricular Pressures
for the Diagnosis of Constritive Pericarditis. Circulation.1996;93:2007-2013.
14. Akasada T, Yoshida K, Yamamuro A,
Hozumi T, Takagi T, Morioka S, Yoshikawa J.Phasi Coronary Flow Characteristics
in Patients With Constritive Pericarditis. Circulation.1997;96:1874-1881.
15. Thenzbraun A, Pinto FJ, Schnittger I. Transesophageal Echocardiography in the Intensive Care Unit: Impact on Diagnosis and Decision-Making. Clin Cardiol.1994;17:438-444.
16. Silva E. Como Coloco um Catéter da Artéria Pulmonar. Rev Port Med Int.2000;1:89-101.
Braunwald
E, ed. Heart Disease: A Textbook of Cardiovascular Medicine. Philadelphia: WB
Saunders. 5th ed 1997.
Topol EJ.
Cardiovascular Medicine.Lippincott-Raven 1998.
Rubenstein
et al. Scientifc American Medicine, Inc. 1997.
Hurst JW.
The Heart. McGraw-Hill, Inc. 9th edition
Shoemaker WC. Textbook of Critical Care. W.B.
Saunders. 3rd edition. 1995