
Pedro
Matos Moreira
Unidade
de Cuidados Intensivos – Hospital Garcia de Orta, Almada
Portugal
Ventilação
Mecânica no Traumatizado Torácico
Pretende-se
ao abordar a ventilação no traumatizado torácico rever os conceitos actuais de
ventilação no ALI/ARDS. Estas 2 entidades pela sua gravidade são uma das
principais causa de mortalidade do
grande traumatizado, e não exclusivas do traumatizado torácico
O
Síndroma de Dificuldade Respiratória do Adulto (ARDS) é um processo inflamatório
pulmonar agudo que atinge doentes médicos e cirúrgicos. Atinge especificamente a
barreira alveolar e a capacidade de troca gasosa do pulmão. Inicialmente
predomina a inundação dos espaços alveolares e posteriormente com a manutenção
do processo inflamatório predomina a proliferação celular com deposição de
colageneo e “remodelação” pulmonar.
A
sua mortalidade situa-se tradicionalmente acima de 50%.
Embora
reconhecido como síndroma desde 1967, só recentemente foram definidos critérios
clínicos (Conferência de Consensos Americana-Europeia de 1994); este grupo
definiu 2 entidades distintas mas complementares – Lesão Pulmonar Aguda (ALI) e
o ARDS (1).
Os
factores de risco para o desenvolvimento do ALI/ARDS incluem as Lesões
Pulmonares Directas, como a aspiração de conteúdo gástrico, pneumonia e a
contusão pulmonar, e as Lesões Pulmonares Indirectas, traduzindo uma
resposta inflamatória desadequada em entidades como a sepsis, pancreatite,
transfusão maciça ou embolia gorda.
 Publicado
recentemente um estudo de Hudson e al (2) avaliou prospectivamente os
doentes com factores de risco para a instalação de ALI/ARDS e verificou uma
incidência de 25% nos politraumatizados e de 40% nos sujeitos a transfusões
maciças (>15 u/24h)
Publicado
recentemente um estudo de Hudson e al (2) avaliou prospectivamente os
doentes com factores de risco para a instalação de ALI/ARDS e verificou uma
incidência de 25% nos politraumatizados e de 40% nos sujeitos a transfusões
maciças (>15 u/24h)
Dois
estudos interessantes de Gatinnoni e al (3) avaliam as diferentes
repercussões pulmonares do ALI/ARDS provocado pela lesão pulmonar directa/
indirecta, demonstrando diferenças clinicas, imagiológicas e funcionais entre os
2 grupos.
No
grupo do ALI/ARDS associado à lesão pulmonar directa haveria predomínio da
consolidação pulmonar em oposição ao edema intersticial e colapso alveolar na lesão indirecta;
as modificações induzidas na mecânica pulmonar e nomeadamente a resposta a
ventilação com PEEP seriam diferentes nos 2 grupos.
Apenas
uma pequena percentagem de doentes traumatizados apresentam critérios de
ALI/ARDS no período imediato após o trauma; nos 3 grandes grupos etiológicos do
ALI/ARDS (sepsis, trauma e outras causas), cerca de 50% desenvolveram quadro de
ARDS nas primeiras 24 h após a situação de risco, 85% às 72 h e os restantes nos
dias seguintes.
Estes
doentes apresentam lesão pulmonar tardia relacionada com inflamação sistémica,
ou são expostos a um 2º factor de risco neste período, ou ainda este atraso pode
traduzir o agravamento da lesão pulmonar inicial, associada à ventilação
mecânica (VILI – “ventilator induced lung injury”)

A
incidência de complicações pulmonares post-traumaticas varia consoante as
diferentes categorias de trauma, sendo importante definir grupos de risco em que
o suporte ventilatório precoce é particularmente benéfico.
Um
estudo recente de Hoyt et al avaliou precisamente a incidência de
complicações pulmonares e factores de risco na admissão. As complicações
pulmonares estavam presentes em cerca de 12% dos doentes, sendo que o
traumatismo craneo-encefalico e
torácico grave apresentava 75% das complicações mais graves.
Conclui
ainda que os doentes com traumatismo
fechado grave em choque e/ou em coma na admissão, aqueles que têm lesões
torácicas e cranianas necessitando de intervenção cirúrgica, apresentam risco
elevado de complicações pulmonares, nomeadamente ALI/ARDS, beneficiando com o
suporte ventilatório precoce.
Factores
de Risco para ALI/ARDS no politraumatizado:
1. Traumatismo
Torácico Fechado
2. Injury
Severity Score > 16
3. Score
de Glascow < 8
4. Necessidade
de intervenção neurocirurgica
SUPORTE
VENTILATÓRIO
Quando
ventilamos o doente traumatizado torácico ou o doente traumatizado em geral
temos como objectivo suportar a função respiratória alterada evitando ou
combatendo o ALI/ARDS.
No
entanto devemos ter também presente o conceito de Lesão Pulmonar induzida pela
Ventilação (VILI).
Estudos
realizados até agora mostram que há diferenças regionais significativas na
mecânica alveolar no ARDS. Trata-se de um atingimento alveolar heterogéneo com
colapso não recrutável, que coexiste com zonas de alvéolos relativamente
normais. Isto levou ao conceito de volutrauma em que os volumes correntes
tradicionalmente usados (10 a 15 ml/kg) resultavam em lesão pulmonar
iatrogénica.
Esta
alterações resultavam da hiperdistensão de alvéolos ditos normais originando
hiperventilação local com inibição e deplecção de surfactante. Isto ocorria
porque existiam zonas alveolares irreversivelmente colapsadas que podiam
representar até 80% do parênquima pulmonar. A utilização de volumes correntes
elevados no pulmão que na realidade podia ter perdido 75% ou mais da sua
capacidade funcional, equivalia a ventilar com cerca de 40 ml/kg as zonas não
lesadas. Como consequência eram geradas pressões transalveolares muito elevadas
que provocavam ruptura alveolar das zonas normais e consolidadas. Além disso a
abertura e encerramento repetidos de alvéolos não recrutáveis levava muitas
vezes à disjunção do epitélio alveolar. As autópsias realizadas nos doentes com
ARDS que eram ventilados com os volumes convencionais elevados revelavam
frequentemente dilatação bronquiolar, alterações quisticas e
microabcessos
Em
resumo os estudos referidos sugerem que a pressão transalveolar devem ser
mantidas abaixo dos 30 mm Hg de forma a minimizar a lesão pulmonar iatrogénica.
Este limite de pressão correlaciona-se com pressões de plateau de via aérea <
30 a 40 cm de agua, dependentes da compliance pulmonar e da parede
torácica.
.
Hipercapnia
Permissiva
Com
base no conceito do volutrauma como factor de agravamento da função pulmonar,
surgiram estratégias para reduzir a pressão estática das vias
aéreas.
A
hipercapnia permissiva (HP) implica hipoventilação intencional e provoca
hipercarbia e acidose respiratória e tem como objectivo de minimizar as pressões
transalveolares.
A
utilização desta estratégia permitem a elevação progressiva da PCO2
em cerca de 10 mm hg/h até um valor máximo de 80 a 100 mm hg, tolerando pH até 7.15 antes de qualquer
administração de bicarbonato e manutenção de SaO2 de
90%.
Em
geral torna-se necessária sedação e curarização eficazes para atingir estes
objectivos.
Como
efeitos adversos da hipercapnia temos as elevações agudas da pressão
intracraniana, hipertensão ligeira, aumento do débito cardíaco e das
resistências vasculares pulmonares; estes efeitos limitam a utilização desta
estratégia nos traumatismo craneo-encefálicos graves, na doença cerebrovascular
e nas lesões expansivas intracranianas, bem como na doença coronária grave e na
falência cardíaca congestiva
Foram
realizados 3 estudos avaliando o impacto da HP na mortalidade do ARDS. O estudo
de Hickling et al (4) de 1994 utilizou a ventilação com baixos volumes
correntes e apresentou uma mortalidade intra-hospitalar dos doentes com ARDS de
16% contra os 39% previstos com base no APACHE II; este estudo foi seguido de um
segundo de tipo prospectivo pelo mesmo grupo em que se registou uma mortalidade
de 26% contra os 53% de mortalidade prevista. O terceiro estudo realizado por
Gentillelo et al (5) em 1995 utilizou a mesma estratégia em doentes
traumatizados, e verificou uma mortalidade de 9% no grupo de HP contra 52% no
grupo de controle.
Ventilação com volumes correntes
baixos
A
ventilação convencional utilizada ventilados ciclados por volume e volumes
correntes de 10 a 15 ml/kg com o objectivo principal de normalizar a PaO2 e a
PaCO2. Na tentativa de minimizar a VILI no doente com ALI/ARDS foram
desenvolvidas novas estratégias de ventilação. Uma das abordagens que tem
merecido maior atenção é a ventilação na modalidade de pressão controlada tendo
como objectivo a limitação de pressão estática na via aérea a valores inferiores
a 40 cm de agua, resultando tipicamente em volumes correntes baixos (4 a 8
ml/kg), hipercapnia e acidose respiratória.
Esta
estratégia protege o pulmão lesado do ALI/ARDS das lesões iatrogénicas induzidas
pela ventilação e ao mesmo tempo pode resultar em aumento do numero de unidades
alveolares colapsadas recrutáveis.
Associada
a esta estratégia podemos utilizar a inversão da relação de tempo
inspiração/expiração, prolongando o tempo inspiratório; isto tem como resultado
o aumento do tempo disponível para trocas gasosas alveolares e diminui o tempo
de colapso expiratório dos alvéolos instáveis.
Como
manobra mais comum de recrutamento dos alvéolos colapsados, aumentando assim a
capacidade funcional respiratória utilizamos a Pressão Positiva no final da
Expiração (PEEP).
Os
níveis ideais de PEEP a usar nos doentes com ALI/ARDS são ainda motivo de
inúmeras discussões, no entanto os trabalhos mais recentes mostram que o
recrutamento alveolar ideal e a manutenção de volume pulmonar adequado ocorrem
quando são utilizados valores de PEEP iguais ou ligeiramente superiores ao valor
de inflexão inferior (Pflex) da curva inspiratória estática de
pressão-volume.
 Esta
curva apresenta 2 pontos de inflexão; o primeiro e menor corresponde à pressão
de abertura da maioria dos alvéolos recrutáveis, e a segunda e superior
corresponde ao limite de pressão em que se regista a perda de propriedades
elásticas do tecido pulmonar resultante de hiperdistensão alveolar. O registo
desta curva pode ser feito sem recurso a equipamento sofisticado pelo método
descrito por
Benitez
em “Asa
presión-volumen en ventilación mecanica : obtencion, interpretacion, y
utilidad”
publicado na edição do CIMC de 1999
(spci.org/cimc99.html).
Esta
curva apresenta 2 pontos de inflexão; o primeiro e menor corresponde à pressão
de abertura da maioria dos alvéolos recrutáveis, e a segunda e superior
corresponde ao limite de pressão em que se regista a perda de propriedades
elásticas do tecido pulmonar resultante de hiperdistensão alveolar. O registo
desta curva pode ser feito sem recurso a equipamento sofisticado pelo método
descrito por
Benitez
em “Asa
presión-volumen en ventilación mecanica : obtencion, interpretacion, y
utilidad”
publicado na edição do CIMC de 1999
(spci.org/cimc99.html).
Estratégia de “Open
Lung”
A
combinação do uso de PEEP, recrutamento e manutenção de abertura de alvéolos
colapsados, e da ventilação com limite de pressão foi definida por Amato et
al. e consistia no uso de valores de PEEP acima da Pflex inferior
da curva de pressão-volume, uso de volumes correntes inferiores 6 ml/kg e de
pressões de plateau na via aérea inferiores a < 40 cm de agua e hipercapnia
permissiva.
Um
numero importante de estudos comparou esta estratégia com as modalidades
ventilatórias convencionais, nomeadamente o estudo do próprio Amato de 1995 e de 1998; (6,7) nestes foi
verificado a melhoria funcional respiratória e desmame mais rápido dos doentes
com ARDS ventilados 2º a estratégia descrita, bem como diminuição de lesão
iatrogénica pulmonar e melhoria da mortalidade aos 28
dias.
No
entanto dois estudos prospectivos randomizados recentes de Brochard (8) e
de Stewart (9) não revelaram diferenças na mortalidade nos doentes
ventilados convencionalmente e segundo a estratégia de
“open-lung”.
Por
outro lado o estudo multicêntrico conduzido pela ARDSNetwork do Instituto da
Saúde Americano (NIH) foi terminado precocemente por razões éticas já que os
dados preliminares revelaram uma diminuição de mortalidade de 25% nos doentes
ventilados segundo a estratégia protectora, ou seja com volumes correntes de 6
ml/kg.
Insuflação
Traqueal de Gás
Outra
manobra acessória usada na ventilação protectora pulmonar e utilizada para
ultrapassar a hipercapnia permissiva é a Insuflação Traqueal de Gás (TGI).
Trata-se de uma manobra simples em que através de uma sonda de oxigénio,
introduzida no tubo endotraqueal e com a extremidade distal posicionada a nível
da carina, se introduz O2 com um débito de aproximadamente 2 l/min. Assim
consegue-se uma “lavagem” do espaço morto proximal e maior eliminação e redução
do CO2.
Num
estudo realizado em 1996 por Barnett et al (10) a utilização da TGI em
doentes com ARDS diminuiu os valores de PaCO2 e de pH de forma
significativa.
Posicionamento do doente com
ARDS
Outra
área de investigação relaciona-se com o impacto do posicionamento do doente
ventilado no ARDS. Mudanças de posição para decúbito ventral e/ou decúbito
lateral extremo melhoraram a perfusão para as áreas pulmonares ventiladas,
traduzindo-se em melhoria franca da oxigenação. Além estas mudanças de posição
melhoram a mecânica e a drenagem pulmonar. O trabalho de Marini et al
(11) de 1996 calcula que entre 50 a 75% dos doentes com ARDS melhoram a
oxigenação com a mudança de posição.
Vários
factores explicam a subida da PaO2 com o decúbito ventral nestes doentes,
nomeadamente o recrutamento de áreas pulmonares paravertebrais, aumento do
volume pulmonar e uma distribuição mais homogénea da ventilação favorecendo a
redistribuição da perfusão pulmonar e diminuindo o desequilibro
ventilação/perfusão.
Novas
direcções
Outras
estratégias não farmacológicas foram entretanto sendo utilizadas na abordagem
farmacológica do doente traumatizado com ALI/ARDS, nomeadamente a Ventilação
Liquida (VL) utilizando o preenchimento total ou parcial da via aérea com
perfluorocarbono e a Circulação Extracorporal para Oxigenação por Membrana
(ECMO) e para Remoção de CO2 (ECCO2). Em relação VL o estudo realizado por
Bartlett
et al (12)
apesar de mostrar melhoria dos parâmetros de dinâmica pulmonar e dos índices de
oxigenação, não diminuiu o tempo de ventilação nem a mortalidade global do ARDS.
Em relação ao ECMO e ECCO2 a experiência limitada existente revela uma taxa de
complicações significativa dado a caracter invasivo da
técnica.
Apresenta-se
na tabela seguinte as estratégias de tratamento e suporte fundamentadas pelos
conhecimentos clínicos actuais, aquelas que não se justificam perante os
conhecimentos actuais e por fim as que aguardam fundamentação por estudos e
ensaios clínicos
Intervenção
não farmacológicas no ARDS
|
Fundamentadas |
Não
Fundamentadas |
Aguardam
estudos RC |
|
Hipercapnia
permissiva |
ECMO
e ECCO2 |
“Open
Lung Approach” |
|
“Pressure
Targeted Ventilation” |
|
Ventilação
Liquida |
|
Relação
I:E Invertida |
|
Insuflação
Traqueal |
|
|
|
“Prone
Positioning” |
As
boas notícias
Ao
continuar-mos a viver numa sociedade cada vez mais dependente de tecnologia
sofisticada mas também agressora do seu utilizador, é altamente improvável que o
numero de acidentes e a sua gravidade venham a diminuir.
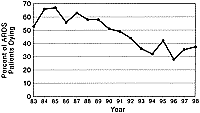
Nos
últimos 10 anos ao contrario do sinistralidade geral, a mortalidade do ARDS tem
vindo a melhorar. Tradicionalmente a mortalidade deste síndroma situava-se acima
dos 50% e não se tinha modificado desde 1967.
No
entanto um estudo recente de Milberg et al. (13) avalia a mortalidade
anual do ARDS entre 1983 e 1993 e conclui que se verificou um decréscimo
significativo; para a globalidade da população com ARDS este autor verificou uma
mortalidade de 53 a 68% entre 1983 e 1987 contra cerca de 36% em 1993. As razões
para esta mudança não são claras e certamente serão de caracter multifactorial,
incluindo certamente o melhor suporte vital e melhoria do suporte
ventilatório.
 Estes
dados devem ser encarados com optimismo e fazer-nos avançar no sentido do
aprofundamento dos conhecimentos da patofisiologia do síndroma assim como no
melhor controle da disfunção inflamatória a ele associada.
Estes
dados devem ser encarados com optimismo e fazer-nos avançar no sentido do
aprofundamento dos conhecimentos da patofisiologia do síndroma assim como no
melhor controle da disfunção inflamatória a ele associada.
Almada,
Novembro de 2000
Referencias:
1. Bernard
GR, Artigas A, Brigham KL, et al. Report
of the American-European consensus conference on ARDS: definitions, mechanisms,
relevant outcomes and clinical trial coordination. The Consensus Committee.
Intensive Care Med. 1994;20:225–232.
2. Hudson
LD, Milberg JA, Anardi D, Maunder RJ. Clinical risks for development of the
acute respiratory distress syndrome. Am J Respir Crit Care Med.
1995;151(2 Pt 1):293–301.
3. Gattinoni
L, Pelosi P, Suter PM, et al. Acute respiratory distress syndrome caused by
pulmonary and extrapulmonary disease: different syndromes? Am J Respir Crit
Care Med. 1998; 158: 3-11
4. Hickling
KG, Walsh J, Henderson S, Jackson R. Low mortality rate in adult respiratory
distress syndrome using low-volume, pressure-limited ventilation with permissive
hypercapnia: a prospective study. Crit Care Med. 1994;
22:1568
–1578.
5. Gentilello
LM, Anardi D, Mock C, Arreola R-C, Maier Permissive hypercapnia in trauma
patients. J Trauma. 1995; 39:846 –852.
6. Amato
MB, Barbas CS, Medeiros DM, et al. Beneficial
effects of the “open lung approach” with low distending pressures in acute
respiratory distress syndrome: a prospective randomized study on mechanical
ventilation. Am J Respir Crit Care Med. 1995;152(6 Pt
1):1835–1846.
7. Amato
MB, Barbas CSV, Medeiros DM, et al. Effect
of a protective-ventilation strategy on mortality in the acute respiratory
distress syndrome. N Engl J Med. 1998;338: 347-354
8. Brochard
L, Roudat-Thoraval F, Roupie E, et al. Tidal volume reduction for prevention of
ventilator-induced lung injury in Acure Respiratory Distress Syndrome. Am J
Respir Crit Care Med. 1998;158:1831–1838.
9. Stewart
TE, Meade MO, Cook DJ, et al. Evaluation of a ventilation strategy to prevent
barotrauma in patients at high risk for Acute Respiratory Distress Syndrome.
N Engl J Med. 1998;338:355–361.
10. Barnett CC, Moore FA, Moore EE, et al.
Tracheal gas insufflation is a useful adjunct in permissive hypercapnic
management of acute respiratory distress syndrome. Am J Surg.
1996;172:518 –521.
11. Marini
JJ. Evolving concepts in the ventilatory management of acute respiratory
distress syndrome. Clin Chest Med. 1996;17:555–575.
12. Bartlett RH, Hirschl RB. Liquid
ventilation in ARDS. Acta Anaesthesiol Scand Suppl. 1997;111:68
–69.
13. Milberg JA, Davis DR, Steinberg KP,
Hudson LD. Improved survival of patients with acute respiratory distresssyndrome
(ARDS): 1983–1993. JAMA. 1995;273:306
–309.
 Publicado
recentemente um estudo de Hudson e al (2) avaliou prospectivamente os
doentes com factores de risco para a instalação de ALI/ARDS e verificou uma
incidência de 25% nos politraumatizados e de 40% nos sujeitos a transfusões
maciças (>15 u/24h)
Publicado
recentemente um estudo de Hudson e al (2) avaliou prospectivamente os
doentes com factores de risco para a instalação de ALI/ARDS e verificou uma
incidência de 25% nos politraumatizados e de 40% nos sujeitos a transfusões
maciças (>15 u/24h)


