
MONITORIZAÇÃO DA EVOLUÇÃO DA GRAVIDADE DA DOENÇA
Ricardo Matos, Rui Moreno
Unidade de Cuidados Intensivos Polivalente
Hospital de St. António dos Capuchos
Lisboa
INTRODUÇÃO
A publicação em 1981 do Acute Physiology and Chronic Health
Evaluation (APACHE) [1], introduziu na prática clínica dos intensivistas a
avaliação e quantificação da gravidade da doença. Descritos inicialmente para a
avaliação da gravidade e prognóstico de doentes individuais, cedo estes instrumentos
passaram a ser aplicados apenas para a avaliação de grupos de doentes.
Este facto
pode ser explicado, pelo menos parcialmente, pelos seguintes aspectos:
-
a
natureza probabilística dos instrumentos existentes, capazes apenas de, mesmo
que excelentemente calibrados, fornecerem informações acerca da probabilidade
de um determinado acontecimento;
-
o facto
de serem baseados no grau de disfunção fisiológica avaliado à admissão ou às 24
horas de internamento na Unidade de Cuidados Intensivos (UCI), sendo incapazes
de acompanhar a evolução da gravidade do processo fisiopatológico;
Tais factos impediram a sua adopção generalizada como instrumentos de apoio à decisão clínica, em tempo real, à cabeceira do doente.
Surgiu assim a consciência na comunidade científica mais ligada a esta problemática da necessidade de desenvolver instrumentos que permitam acompanhar o doente ao longo do seu internamento, assumindo que os processos fisiopatológicos do doente crítico são dinâmicos, dependentes da evolução da doença de base, das suas consequências nos vários órgãos e sistemas, da resposta à terapêutica e do aparecimento de complicações. Várias estratégias foram propostas neste contexto:
- a avaliação repetitiva da presença, gravidade e número de disfunções / falências de órgão;
- a avaliação repetida do grau de disfunção fisiológica, corrigida eventualmente para a presença e grau de disfunções / falência de órgão;
- o desenvolvimento de índices destinados à avaliação repetida do grau de lesão de um determinado órgão ou sistema, como o sistema nervoso central ou do aparelho respiratório.
Tais modelos não entraram ainda na avaliação e monitorização de rotina do doente crítico. Tal facto deve-se principalmente à sua complexidade e insuficiente validação. É todavia previsível que, com o desenvolvimento da informática médica, com a avaliação e a integração automática dos vários dados disponíveis sobre um doente, tais obstáculos venham a ser ultrapassados. Surgirão assim instrumentos que vão permitir complementar e integrar os dados provenientes da monitorização clínica, laboratorial e imagiológica.
ÍNDICES DE FALÊNCIA MÚLTIPLA DE ÓRGÃO (FMO)
Desde a publicação
em 1985 por William Knaus e colaboradores de uma escala prática para a
quantificação da FMO [2], que vários modelos têm aparecido na literatura. Os
últimos sistemas publicados são o Multiple Organ Dysfunction score (MODS),
descrito em 1995 por John Marshall e colaboradores [3], o Logistic Organ Dysfunction (LOD) score descrito em
1996 por Jean-Roger Le Gall e colaboradores [4] e o Sequential Organ Failure Assessment (SOFA) score,
desenvolvido em 1996 por um grupo de trabalho da Sociedade Europeia de Cuidados
Intensivos [5]. Podem ser baseados em variáveis fisiológicas ou
terapêuticas (Quadro I).
Quadro I. Tipos de variáveis utilizadas nos sistemas de quantificação da disfunção
/ falência múltipla de órgão. Adaptado de John Marshal [6].
|
Órgão/sistema |
Variáveis fisiológicas |
Variáveis terapêuticas |
|
Respiratório |
PaO2/FiO2 |
Ventilação
mecânica Nível
de PEEP |
|
Cardiovascular |
Pressão
arterial |
Uso
de fármacos vasoactivos |
|
Renal |
Débito
urinário Ureia
sérica Creatinina
sérica |
Uso
de diálise |
|
Hematológico |
Plaquetas Leucócitos Hematócrito |
Uso
de sangue e derivados |
|
Neurológico |
Escala
de comas de Glasgow |
Uso
de sedação |
O mais utilizado na
actualidade e o único validado de forma multicêntrica no nosso país é o SOFA
score (Quadro II).
Quadro II. Sequential Organ Failure Assessment (SOFA) score [5]
|
|
0 |
1 |
2 |
3 |
4 |
|
Respiratório1 PaO2/FiO2, mm3 |
> 400 |
£ 400 |
£ 3001 |
£ 2001 |
£ 1001 |
|
Hematológico Plaquetas(x 1000/mm3) |
> 150 |
£ 150 |
£ 100 |
£ 50 |
£ 20 |
|
Hepático Bilirrubina sérica, mg/dL (mmol/L) |
< 1.2 |
1.2 – 1.9 |
2.0 – 5.9 |
6.0 – 11.9 |
> 12.0 |
|
Cardiovascular Hipotensão |
PAM2 ³ 70 |
PAM < 70 |
Dopamina £ 5 ou |
Dopamina > 5 |
Dopamina > 15 |
|
Neurológico Escala comas de Glasgow |
15 |
13 – 14 |
10 – 12 |
6 – 9 |
< 6 |
|
Renal Creatinina sérica, mg/dL (mmol/L) ou |
< 1.2 |
1.2 – 1.9 |
2.0 – 3.4 |
3.5 – 4.9 |
> 5.0 |
Os agentes adrenérgicos (dopamina, dobutamina, adrenalina e noradrenalina)
devem ser administrados em perfusão contínua EV, de duração superior a uma
hora. As doses indicadas estão em micrograma/kg/minuto.
1: com suporte ventilatório
2: PAM: pressão arterial media, mmHg
Todos eles foram desenvolvidos com pressupostos comuns [5]:
-
serem capazes de descrever a disfunção crescente de órgãos individuais
e de avaliar a FMO como um continuo de disfunção/falência de
órgão em vez de um fenómeno binário (ausente/presente);
-
serem
aplicados de modo repetitivo, dada a FMO não ser um fenómeno estático e o grau
de disfunção variar com o tempo no decurso da evolução do processo patológico;
-
serem
constituídos por variáveis simples, objectivas, disponíveis por rotina em todas
as UCIs, especifícas para o órgão em questão e independentes das
características basais dos doentes;
-
serem
idealmente independentes da terapêutica, embora este facto seja virtualmente
impossível de atingir na prática [3]
Para a monitorização da evolução da gravidade da doença, estes instrumentos devem ser aplicados diariamente durante todo o internamento na UCI, podendo fornecer ao médico vários tipos de informação [7]:
1. a pontuação de admissão, ou seja a condição do doente na admissão na UCI (Figura 1);
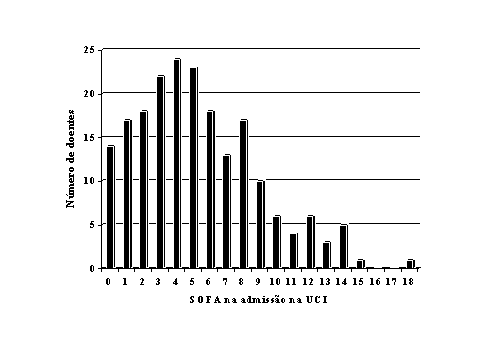
Figura 1. SOFA de admissão dos doentes internados na Unidade de cuidados Intensivos
Polivalente do Hospital de Santo António dos Capuchos no ano de 1999.
2. a pontuação diária, ou seja, a soma das pontuações individuais dos vários órgãos e sistemas avaliados num determinado dia. Pode ser avaliada de forma agregada (Figura 2) ou separadamente para cada órgão e sistema analisado (Figura 3);
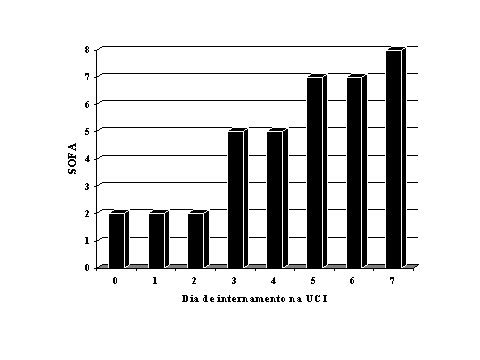
Figura 2. SOFA score durante os primeiros 7 dias na UCI da doente MLP, admitida no pós operatório de colectomia total por megacolón tóxico.
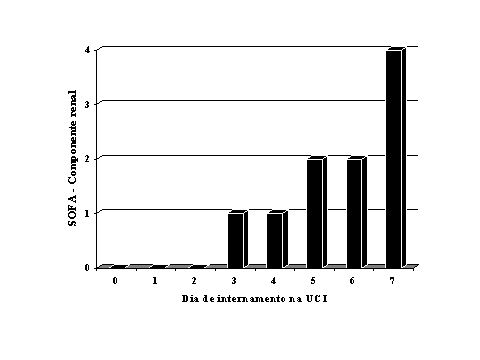
Figura 3. Componente renal do SOFA score durante os primeiros 7 dias na UCI da doente MLP, admitida no pós operatório de colectomia total por megacolón tóxico.
3. a pontuação máxima total, ou seja, a soma da pontuação máxima para cada órgão ou sistema avaliado durante todo o internamento, como medida agregada do insulto cumulativo total sofrido pelo doente;
4. a pontuação delta, ou seja, a diferença entre a pontuação máxima e a pontuação de admissão, reflectindo o grau de disfunção / falência que apareceu após a admissão na Unidade. Só pode ser calculado à data de alta da UCI;
ÍNDICES DE GRAVIDADE
Os índices de gravidade gerais constituem indicadores agregados do grau de disfunção fisiológica de um doente, e foram também aplicados na monitorização da evolução da gravidade da doença.
O primeiro autor a propor de forma sistemática a sua utilização foi René Chang [8]. Utilizando o APACHE II corrigido para o grau de falência múltipla de órgão, aplicado diariamente, este autor pretendia identificar os doentes que pela gravidade e duração da falência de órgão não apresentavam qualquer hipótese de sobrevivência.
Esta metodologia, muito discutível, foi proposta para fins tão diversos como a selecção dos doentes que já não beneficiariam de alimentação parentérica total [9] ou para a suspensão de tratamento activo [10]. A validação desta metodologia foi considerada insuficiente em estudos independentes [11] e está hoje quase abandonada.
Mais tarde, Douglas Wagner e colaboradores, descreveram o APACHE III adaptado para a avaliação prognóstica durante os primeiros 7 dias de internamento na UCI [12]. Este sistema toma em linha de conta o motivo de internamento, a idade, o estado crónico de saúde, a terapêutica efectuada antes da admissão na UCI, o grau de disfunção fisiológica à admissão na UCI, o grau de disfunção fisiológica no dia em análise e a diferença entre o grau de disfunção fisiológica nas últimas 24 horas. Complexa e cara, esta metodologia nunca ganhou popularidade na Europa. Nos Estudas Unidos da América, modelos similares utilizados no contexto do projecto SUPPORT, dando ao clínico estimativas da probabilidade de mortalidade a médio prazo para algumas categorias de doentes, não se revelaram eficazes na melhoria dos cuidados [13].
Uma variante desta abordagem foi descrita por Jack Zimmerman e colaboradores para prever a necessidade de cuidados intensivos no dia seguinte de, podendo ser aplicada no planeamento das altas [14].
Mais tarde, Stanley Lemeshow e colaboradores descreveram a adaptação dos Mortality Probability Models (MPM II) para utilização às 48 e 72 horas na UCI [15], suplementando os modelos já existentes para a admissão e as 24 horas de internamento [16]. Problemas de calibração levaram à pouca aplicação desta metodologia [17].
Um exemplo da aplicação dos MPM II na Unidade de Cuidados Intensivos Polivalente do Hospital de santo António dos Capuchos é apresentado nas figuras 4 e 5.

Figura 4. Aplicação dos MPM II no doente MCM, admitido na UCI por peritonite biliar. Pode-se observar que o doente, admitido com uma mortalidade estimada de 92.86% (intervalo de confiança a 95%: 84.14% - 96.45%)., apresenta uma resposta favorável à terapêutica, sendo a sua mortalidade estimada às 72 horas de internamento de apenas 26.89% (intervalo de confiança a 95%: 20.39% - 34.55%).
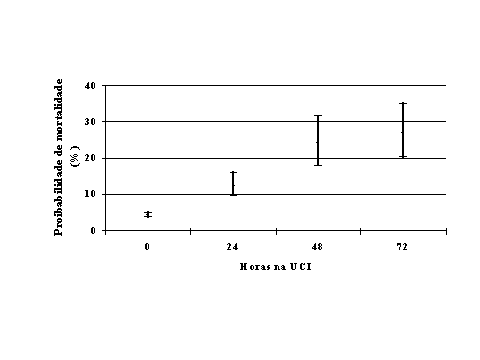
Figura 5. Aplicação dos MPM II no doente CDM, admitido na UCI por sépsis. Pode-se observar que o doente, admitido com uma mortalidade estimada de 4.24%. (intervalo de confiança a 95%: 3.71% - 4.83%), apresenta uma deterioração progressiva, sendo a sua mortalidade estimada às 72 horas de internamento de 26.97% (intervalo de confiança a 95%: 20.21% - 35.00%).
Mais recentemente, alguns investigadores têm proposto a utilização repetida de índices de gravidade gerais, como o APACHE II [18]ou o SAPS II [19], para a monitorização da evolução da gravidade da doença. Utilizando esta metodologia, observa-se um aumento ao longo do tempo do poder discriminativo dos instrumentos, ou seja, uma melhor capacidade para distinguir os doentes sobreviventes dos falecidos. Para além disso, a observação da tendência evolutiva do doente pode dar ao clínico importantes informações. Esta abordagem necessita todavia maior investigação. Um exemplo é descrito na figura 6.
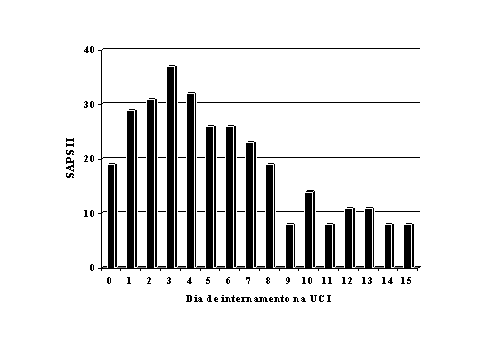
Figura 6. SAPS II diário do doente JCN, admitido na Unidade de Cuidados Intensivos Polivalente do Hospital de Santo António dos Capuchos por sépsis devido a fasceíte do membro inferior.
CONCLUSÕES
Dispomos hoje já de instrumentos para a monitorização da evolução da gravidade da doente. O desenvolvimento das possibilidades tecnológicas e estatísticas verificados nos últimos anos, de que são exemplos o aparecimento da análise das probabilidades de transição [20] e das redes neuronais [21], faz-nos pensar que poderemos esperar no futuro próximo um aumento da utilização destas metodologias.
Se não sabemos
hoje com segurança o que o futuro nos reserva, podemos sempre esperar que os
índices de gravidade do futuro nos tragam uma ajuda importante no complexo
processo de tomada de decisão. Esta ajuda, que está provado não ter efeitos
deletérios [22], pode ser seguramente muito útil. Para já, os
instrumentos de que dispomos complementam-nos seguramente o juízo clínico,
embora não possam nem devem substitui-lo. É necessária seguramente mais
investigação neste campo.
Estamos ainda longe do conselho de
Hipócrates, que nos dizia “…and he will manage the cure best who has
foreseen what is to happen from the present state of matters…”. Esperemos que a próxima geração de
instrumentos de avaliação prognóstica nos traga esta capacidade.
REFERÊNCIAS
1.
Knaus WA, Zimmerman JE, Wagner DP, Draper EA,
Lawrence DE. APACHE - acute physiology and chronic health evaluation: a
physiologically based classification system. Crit Care Med 1981;9:591-7.
2.
Knaus WA, Draper
EA, Wagner DP, Zimmerman JE. Prognosis in acute organ-system failure. Ann Surg
1985;202:685-93.
3.
Marshall JC, Cook
DA, Christou NV, Bernard GR, Sprung CL, Sibbald WJ. Multiple organ dysfunction
score: a reliable descriptor of a complex clinical outcome. Crit Care Med
1995;23:1638-52.
4. Le Gall JR, Klar J, Lemeshow S, et al. The logistic organ dysfunction system. A new way to assess organ dysfunction in the intensive care unit. JAMA 1996;276:802-10.
5.
Vincent J-L, Moreno R, Takala J, et al. The SOFA (Sepsis-related organ failure assessment)
score to describe organ dysfunction/failure. Intensive Care Med 1996;22:707-10.
6. Marshall JD, Bernard G, Le Gall J-R, Vincent J-L. Conclusions. Sepsis 1997;1:55-7.
7.
Moreno R, Vincent J-L, Matos R, et al. The use of maximum SOFA score to quantify organ
dysfunction/failure in intensive care. Results of a prospective, multicentre
study. Intensive Care Med 1999;25:686-96.
8.
Chang RW, Jacobs
S, Lee B. Predicting outcome among intensive care unit patients using
computerised trend analysis of daily Apache II scores corrected for organ
system failure. Intensive Care Med 1988;14:558-66.
9.
Chang RW, Jacobs
S, Lee B. Use of APACHE II severity of disease classification to identify
intensive-care-unit patients who would not benefit from total parenteral
nutrition. Lancet 1986;1483-6.
10.
Chang RWS, Lee B,
Jacobs S, Lee B. Accuracy of decisions to withdraw therapy in critically ill
patients: clinical judgement versus a computer model. Crit Care Med
1989;17:1091-7.
11.
Jacobs S, Arnold
A, Clyburn PA, Willis BA. The Riyadh intensive care program applied to a
mortality analysis of a teaching hospital intensive care unit. Anaesthesia
1992;47:775-80.
12.
Wagner DP, Knaus
WA, Harrel Jr. FE, Zimmerman JE, Watts C. Daily prognostic estimates for
critically ill adults in intensive care units: results from a prospective,
multicenter, inception cohort analysis. Crit Care Med 1994;22:1359-72.
13.
Knaus WA, Harrell
FE, Lynn J, et al. The SUPPORT prognostic model. Objective estimates for
seriously ill hospitalized adults. Study to understand prognoses and
preferences for outcomes and risks of treatments. Ann Intern Med
1995;122:191-203.
14.
Zimmerman JE,
Wagner DP, Draper EA, Knaus WA. Improving intensive care unit discharge
decisions: supplementary physician judgment with predictions of next day risk
for life support. Crit Care Med 1994;22:1373-84.
15.
Lemeshow S, Klar
J, Teres D, et al. Mortality probability models for patients in the intensive
care unit for 48 or 72 hours: a prospective, multicenter study. Crit Care Med
1994;22:1351-8.
16.
Lemeshow S, Teres
D, Klar J, Avrunin JS, Gehlbach SH, Rapoport J. Mortality Probability Models
(MPM II) based on an international cohort of intensive care unit patients. JAMA
1993;270:2478-86.
17.
Moreno R, Reis
Miranda D, Fidler V, Van Schilfgaarde R. Evaluation of two outcome predictors
on an independent database. Crit Care Med 1998;26:50-61.
18.
Rogers J, Fuller
HD. Use of daily acute physiology and chronic health evaluation (APACHE) II
scores to predict individual patient survival rate. Crit Care Med
1994;22:1402-5.
19.
Moreno R, Estrada H, Miranda I, Massa L.
SAPS II overtime: a preliminary study [abstract]. Clin Intensive Care 1994;5:S122.
20.
Rangel-Frausto
MS, Pittet D, Costigan M, Hwang T, Davis CS, Wenzel RP. The natural history of
the systemic inflammatory response syndrome (SIRS). A prospective study. JAMA
1995;273:117-23.
21.
Dybowski R,
Weller P, Chang R. Prediction of outcome in critically ill patients using
artificial neural network, synthesised by genetic algorithm. Lancet
1996;347:1146-50.
22. Murray LS, Teasdale GM, Murray GD, et al. Does prediction of outcome alter patient management ? Lancet 1993;341:1487-91.