PANEL DE DISCUSION |
J. Alcázar, E Hernández, M. Praga, J. Segura, C. Campo, JL Rodicio.
Servicio de Nefrología. Hospital Universitario 12 de Octubre. Madrid jalcazard@senefro.org
Resumen:
De un total de 72 pacientes diagnosticados de nefropatía isquémica (NI) se describe un grupo constituido por 21 pacientes (29.1%) en los que la NI se presentó como un fracaso renal agudo (FRA). En 12 casos el FRA estaba asociado a la administración de inhibidores del enzima de conversión de la angiotensina (IECA), como tratamiento de su hipertensión, y en 6 fue debido a trombosis arterial, bien en el seno de trombosis aórtica o de la/s arteria/s renal/es. En los tres casos restantes, el FRA fue consecuencia de la realización de coronariografía (2) y de nefritis instersticial inmunoalérgica (1).
En estos 21 pacientes, un 71.4% presentaba datos de enfermedad vascular extrarrenal, que orientaba hacia el diagnóstico, siendo imprescindible la realización de angiografía renal para confirmar el diagnóstico en todos los casos..
La función renal mejoró significativamente en 19 de los 21 pacientes (90.4%), incluyendo seis pacientes que precisaron diálisis. En 17 casos se realizaron técnicas de revascularización (cirugía en 13 casos y angioplastia / endoprótesis en 4 casos).
Se trata de una patología de prevalencia creciente, que puede manifestarse como FRA y de evolución muy favorable con técnicas de revascularización
Palabras claves: Nefropatia isquemica, fracaso renal agudo, revascularización renal, angioplastia.
INTRODUCCION
Bajo el nombre de enfermedad renal isquémica se agrupan varias entidades caracterizadas por insuficiencia renal secundaria a una obstrucción hemodinamicamente significativa de la/s arteria/s renal/es, que suele cursar con hipertensión (1,2). La estenosis de la arteria renal, causante de hipertensión vasculorrenal, fue una de las primeras patologías identificadas. Más tarde, Jacobson y cols (1,2 ), definieron con el nombre de Nefropatía Isquémica, al daño renal secundario a las lesiones ateroscleróticas que afectan a las arterias renales y producen pérdida de masa y de función renal.
Dean y cols ( 3 ), describieron la evolución natural de la patología vasculorrenal demostrando que, como consecuencia de la isquemia renal mantenida, se produce disminución del tamaño renal y del filtrado glomerular. La arteriosclerosis progresa lentamente, lo que permite que el riñón desarrolle circulación colateral a expensas de arterias suprarrenales, lumbares y ureterales, manteniéndose el parénquima renal con una presión de filtración muy baja y una anulación del filtrado glomerular ("riñón no filtrante") ( 4 ).
El patrón morfológico que se puede encontrar es: a) estenosis de ambas arterias renales; b) estenosis unilateral con obstrucción y/o anulación del riñón contralateral; c) trombosis de ambas arterias renales y/o trombosis de aorta con trombosis de las arterias renales y anulación de la función renal.
En estas circunstancias el deterioro de la función puede ser progresivo (5-9), incluso, en un momento determinado, manifestarse clínicamente como un FRA anúrico por trombosis completa de las arterias renales. El interés excepcional de estas circunstancias fisiopatológicas y anatómicas, es que el riñón se mantiene viable gracias a la circulación colateral. Mediante técnicas de revascularización se puede conseguir aumentar el flujo renal renal y con ello el filtrado glomerular.
El objetivo del trabajo es conocer la incidencia del FRA como una forma clínica de presentación de la NI, así como analizar los factores asociados, respuesta al tratamiento y evolución.
PACIENTES Y METODOS
Se estudiaron 72 pacientes (tabla 1) con el diagnóstico de NI (creatinina >1.5 mg/dl), establecido inicialmente mediante gammagrafía renal y/o eco-doppler y confirmado posteriormente con arteriografía.. En cada caso se analizaron la historia clínica y las exploraciones complementarias realizadas a partir de las manifestaciones clínicas que motivaron el ingreso y/o estudio del paciente.
| Numero de pacientes | 72 |
| Sexo: hombres/mujeres | 82/18% |
| Edad | 63 + 8.3 (42 -78 años) |
| CAUSAS: | |
| Aterosclerosis aorta/art. renales | 69 (95.8%) |
| Fibrodisplasia | 3 (4.2%) |
| Estenosis bilateral | 68 (94.4%) |
| Estenosis unilateral * | . 4 (5.6%) (Agenesia renal 1, riñones hipoplasicos 3) |
En la tabla 2, se recogen las distintas formas clínicas de presentación de la NI, destacando en 21 de ellos (29.1%), un deterioro agudo de la función renal (FRA), definido por elevación brusca de la creatinina sérica (creatinina >2.0 mg/dl) y/o oligoanuria. En cada uno de los pacientes se investigaron las posibles causas responsables del FRA.
| Insuficiencia renal e hipertensión | 30 (41.6%) |
| Insuficiencia renal progresiva en pacientes hipertensos | 17 (23.6%) |
| Uremia en pacientes mayores con arterioesclerosis extrarrenal | 4 (5.5%) |
| FRACASO RENAL AGUDO | 21 (29.5%) |
RESULTADOS.
Las distintas causas del FRA (tabla 3), fueron:
a) administración de IECA en 12 pacientes (57%);
b) trombosis de las arterias renales en 6 casos; 3 como consecuencia de trombosis de la aorta (Sindrome de Leriche) y 3 por trombosis aislada de las arteria/s renal/es;
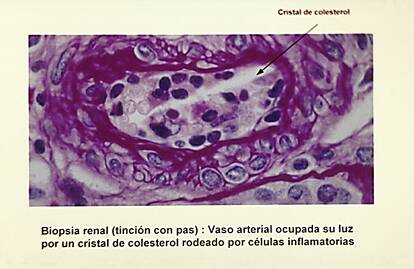
c) un caso de ateroembolismo, secundario a una coronariografia y confirmado mediante biopsia renal (figura 1);
d) un caso de nefritis inmunoalérgica atribuible a furosemida, con demostración histológica;
e) un caso de toxicidad por contrastes iodados, secundario a la realización de una coronariografia.

| IECA* | 12 (57%) |
| Trombosis de aorta infrarrenal o trombosis de arterias renales | 6 (28.5%) |
| Ateroembolismo de colesterol | 1 (4.7%) |
| Nefritis intersticial inmunoalergica | 1 (4.7%) |
| Toxicidad por contrastes yodados | 1 (4.7%) |
La figura 2 corresponde al estudio aortográfico de un varón de 51 años, con antecedentes de diabetes méllitus tipo II, hipertensión arterial, cardiopatía isquémica tipo angina y claudicación de miembros inferiores. Estaba siendo tratado con Captopril e ingresó en el servicio de Urgencias del Hospital en oliguria, edema agudo de pulmón y con creatinina de 2.6 mg/dl. Tras la retirada del IECA, recuperó diuresis y descendió la creatinina sérica. El aortograma, demostró un Síndrome de Leriche, con trombosis de aorta infrarrenal, trombosis de la arteria renal izquierda y estenosis del 80% de la arteria renal derecha. Previa demostración de la viabilidad del riñón derecho, mediante la realización de una gammagrafia renal, se realizó cirugía revascularizadora, con un by-pass aorto-bifemoral y aorto renal derecho.
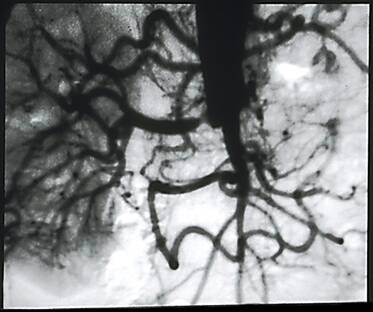
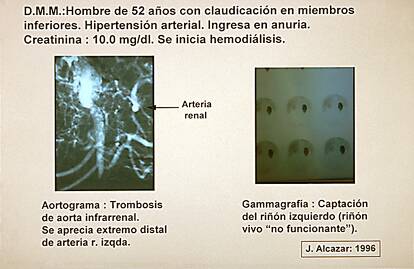
La figura 3 corresponde a un aortograma de un varón de 52 años, con antecedentes de hipertensión arterial y clínica de claudicación de miembros inferiores que ingresa en el Servicio de Urgencias del Hospital en anuria completa y con creatinina de 10.0 mg/dl. Se realizaron varias sesiones de diálisis hasta completar su estudio, que demostró una trombosis de aorta infrarrenal, con trombosis de ambas arterias renales y ausencia de nefrograma.
En el lado izquierdo se apreciaba el cabo distal de la arteria renal izquierda. La gammagrafía renal (figura 4) demostró captación positiva por el riñón izquierdo. Con estos datos, que confirmaban la del viabilidad riñón izquierdo, y que Libertino (4) definió como "riñón no funcionante", se realizó cirugía con un by-pass aorto bifemoral y aorto-renal izquierdo. Ocho años despues mantiene una creatinina de 3.0 mg/dl y un aclaramiento de Cr de 29 ml/min.
En quince de los 21 pacientes con FRA, existían datos de patología aterosclerótica extrarrenal (Tabla 4), destacando en 14 (66.6%) la presencia de clínica de isquemia de miembros inferiores y un caso con cardiopatía isquémica.
Siete pacientes precisaron diálisis de forma temporal (3 días a 2 meses) durante la fase de estudio.
| Enfermedad vascular periférica | 10 (47.6%) |
| Aterosclerosis coronaria | 1 (4.7%) |
| Enf. vascular periférica + coronaria | 3 (14.2%) |
| Enf. vascular periférica + carotidea | 1 (4.7%) |
| CAUSAS | CIRUGIA | ANGIOPLASTIA/STEN | CONSERVADOR |
| IECA | | | |
| Trombosis aortica/renal | | | |
| Ateroembolismo | | | |
| Nefritis intersticial | | | |
| Contrastes yodados | | |
EVOLUCION.
En los 12 pacientes con FRA por IECA, la retirada de los mismos sirvió para una recuperación parcial o total de la función renal.
En la tabla 5, se describe el tratamiento seguido en relación con la etiología responsable del FRA. En un total de 13 pacientes se realizó cirugía revascularizadora de las arterias renales, aislada o asociada a by-pass aorto-bifemoral . En cuatro casos se hizo angioplastia, con colocación de endoprótesis en dos pacientes.
En 19 pacientes (90.4%) se obtuvo una mejoría significativa de la función renal, destacando que seis de los siete pacientes (85%) que precisaron hemodiálisis recuperaron función renal.
DISCUSION.
La prevalencia exacta de la insuficiencia renal terminal secundaria a la NI se desconoce, pero diversos autores estiman que representa de un 11% a un 15% de todas las causas de insuficiencia renal (5,8,9).
La incidencia de patología a nivel de las arterias renales, en pacientes con aterosclerosis extrarrenal oscila del 11% al 42% (5,8,9), aunque no se conoce la velocidad de progresión de las lesiones ni si se produce en todos los pacientes.
En varios trabajos prospectivos (10-13) se demuestra que el daño vascular va progresando en un 36%-70% de los casos y desarrolla trombosis completa de la luz del vaso en un 11% a 16% de todos los pacientes.
No hay ninguna duda de que estamos ante una patología creciente y que se debe de pensar en ella en pacientes mayores, fundamentalmente varones, con antecedentes de consumo de tabaco, diabetes mellitus tipo II y signos de arteriosclerosis extrarrenal. Por tal motivo, su presentación como FRA, es bastante usual, bien sea desencadenada por las alteraciones hemodinámicas intraglomerulares secundarias a los IECA (14) o por trombosis aguda de las arterias renales (15).
En esta serie se presentan un total de 21 pacientes diagnosticados de FRA, en 18 de ellos fue la manifestación clínica iniciales de la NI y en los tres restantes, el fracaso renal se produjo a consecuencia de exploraciones complementarias o fármacos utilizados en su tratamiento.
Es por tanto fundamental pensar en esta posibilidad diagnostica, especialmente en pacientes con el perfil vascular anteriormente descrito.
Se trata de una patología compleja, con morbilidad y mortalidad elevada, pero a su vez el riñón es un órgano muy agradecido a las técnicas de revascularización renal, ya que pese a la trombosis completa de la arteria renal, el riñón puede mantenerse viable, aunque no funcionante, gracias a la existencia de una intensa circulación colateral que se ha ido estableciendo a lo largo del tiempo.
La cirugía es muy efectiva en el tratamiento de pacientes con afectación de ambas arterias renales; los resultados de la literatura muestran de un 85 % a un 90% de éxitos; aproximadamente en un 55% a 65% de los pacientes mejora significativamente la función renal, mientras que en un 25-30% de los casos, la función renal se estabiliza (16-20).
Los resultados con la angioplastia transluminal percutánea (ATP) son peores, con un 35%-50% de mejoría de la función renal y un 12%-15% de estabilización. Existe un elevado porcentaje de reestenosis (5% a 38%) (20-24) y en algunos pacientes se produce un deterioro de la función renal a corto plazo.
Para mejorar estos resultados y evitar reestenosis tan precoces, se están colocando endoprótesis expandibles durante la realización de la angioplastia (25-27).
En esta serie, un total de 19 pacientes (90.4%) recuperan función renal gracias a las técnicas de revascularización renal. Se trata de una patología compleja, pero muy agradecida al tratamiento, si se dispone de experiencia y de una buena organización entre cirujanos, radiólogos y nefrólogos.
BIBLIOGRAFIA
1. Jacobson H.R. Ischemic renal disease: an overlooked clinical entity?. Kidney Int 1988; 34:729-743.
2. Breyer J.A: Jacobson H.r. Ischemic nephropathy. Current Opinion in Nephrology and Hypertension 1993;2:216-224.
3. Dean RH; Kieffe RW; Smith BW. Renovascular hypertension anatomic and renal function changes drug theraphy. Arch. Surg. 1981; 116:1408-1415.
4. Libertino JA; Zinman L; Breslin DJ; Swinton NW; Lagg M. Revascularization of ischemic nonfunctioning kidneys with restoration of renal function. JAMA 1980; 244:1340-1344.
5. Zucchelli P; Zuccala A. Hypertension and renal dysfunction. Current Opinion in Nephrology and Hypertension 1996; 5:97-101.
6. Scoble J.E; Maher E.R; Halmilton G, Dick R; Sweney P; Moorhead J.F. Atherosclerotic renovascular disease causing renal impairment. A case for treatment. Clin Nephrology 1989; 31:119-122.
7. Appel R.G; Bleyer A.J: Reavis S; Hansen K, Renovascular disease in older patients beginning renal replacement teraphy. Kidney Int 1995;48:171-176.
8. Greco BA; Breyer JA. The natural history of renal artery stenosis: Who should be evaluated for suspected ischemic nephropathy?. Semin Nephrology 1996;16:2-11.
9. Preston R.A; Epstein M. Ischemic renal disease: an emerging cause of chronic renal failure and end-stage renal disease. J. Hypertension 1997;15:1365-1377.
10. Wollenweber J; Sheps S.G; Davis G.D. Clinical course of artherosclerotic renovascular disease. Am. J. Cardiol 1968; 91:60-71.
11. Meaney T.F; Dustan H.P; McCormack L.J. Natural history of renal artery disease. Radiology 1968; 91:881-887.
12. Dean R.H; Foster J.H. Criteria for the diagnosis of renovascular hypertension. Surgery 1973;74:926-929.
13. Schreiber M.J;Pohl M.A; Novick A.C. The natural history of atherosclerotic and fibrous renal artery disease. Urol Clin North Am 1984;11:383-392.
14. Toto R.D; Mitchel H.C; Lee H.C; Milan C; Pettinger W.A. Reversible renal insuffiency due to angiotensin converting enzyme inhibitors in hypertensive nephrosclerosis. Ann Intern. Med 1991; 115:513-519.
15. Le Goff C; Ryckelynck B; Levaltier B; Henri P; Lobbedez T; Hurault de Ligny B: Reversible acute renal failure following aortic thrombosis inducing bilateral renal-artery occlusive disease. Nephrol. Dial Transpl. 1995; 10:879-881.
16. Novick A.C; Ziegelbaum M; Viat D.G; Gifford R.W; Phl M.A; Goormastic M. Trend in surgical revascularization for renal artery disease ten years experience. JAMA 1987;257:498-501.
17. Hallett J.W; Textor S.C; Kos P.B; Nicpon G; Bower T.C; Cherry K.J; Gloviczki P; Pairolero P.C. Advanced renovascular hypertension and renal insufficiency: Trend in medical commorbidity and surgical approach from 1970 to 1993. J. Vasc. Surg 1995;21:750-760.
18. Hansen K.J; Thomason R.B; Craven T.E; Fuller S.B; Keith D.R; Appel R.G. Surgicl management of dialysis-dependent ischemic nephropathy. J. Vasc. Surg 1995; 21:197-211.
19. Crinniou J.N; Gough M.J. Bilateral renal artery atherosclerosis. The results of surgical treatment. Eur.J. Vasc. Endovasc. Surg 1996;11:353-358.
20. Alcazar J.Mª; Caramelo C.A; Alegre E.R; Abad J. Ischemic renal injury . Current Opinion. Nephrology and Hypertension 1997;6:157-165.
21. Sos T.A; Pickering T.G; Sniderman K. Percutaneous transluminal renal angioplasty in renovascular hypertension due to atheroma or fibromuscular dysplasic. N. Eng. J. Med 1983;309:274-279.
22. Pickering T.G; Sos T.A; Suddehni S; Rozenblit G; James D.G; Orestein A; Helseth G; Laragh J.H.: Renal angioplasty in patients with azotemia and renovascular hypertension. J. Hypertens. 1986; 4 (suppl 6):s667-s679.
23. O' Donovan R.M; Gutierrez O.H; Izzo J.C, Preservation of renal function by percutaneous renal angioplasty in high-risk ederly patients: short-term outcome. Nephron 1992; 60:187-192.
24. Pattison J.M; Reidy J.F; Rafferty M.J; Ogg C.S; Cameron J.S; Sacks S.H; Williams D.G. Percutaneous transluminal renal angioplasty in patients with renal failure. Q.J. Med 1992; 308:883-888.
25. van de Ven P.J; Beutler J.J, Atee R; Beek F.J; Mali W.P; Geyskes G.G: Koomans H.A. Transluminal vascular stent for atherosclerotic renal artery stenosis. Lancet 1995; 346: 672-674.
26. Blum U; Krumme B; Flügel P; Gabelmann A; Lehnert T; Buitrago-Tellez C; Schollmeyer P; Langer M. Treatment of ostial renal-artery stenoses with vascular endoprostheses after unsuccessful ballon angioplasty. N. Engl. J.Med 1997; 336:459-465.
27. Tuttle K.R; Chouinard R.F; Webber J.T; Dahlstrom L.R; Short R.A; Henneberry K.J; Dunham L. A; Raabe R. D. Treatment of atherosclerotic ostial renal artery stenosis with the intravascular stent.. Am. J. Kidney Dis 1998; 32:611-622.