PANEL DE DISCUSION |
Care and Anticoagulation of Extracorporeal Renal Replacement Therapies.
1. Monitorización de Circuitos Extracorpóreos
2. Mecanismos de coagulación de los circuitos extracorpóreos
3. Pautas y Alternativas de Anticoagulación
4. Bibliografía
El mantenimiento de los circuitos extracorpóreos de las técnicas continuas de reemplazo de la función que venimos aplicando en el paciente con fracaso renal agudo en el escenario de las unidades de pacientes críticos, implica una especial atención en la prevención de complicacones y en su correcta aplicación. Son técnicas que además de invasivas funcionan 24 horas al día y siete días a la semana. Por ejemplo, la falta de precisión en las bombas de líquido de diálisis y/o de ultrafiltración (dependiendo del sistema de que se trate) puede constituir importantes fuentes de error en el cálculo de los balances hídricos.
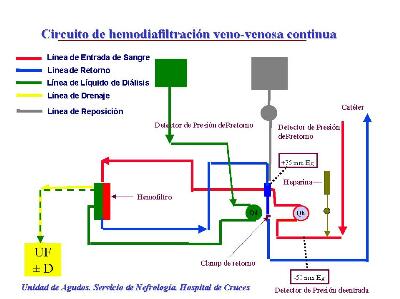
La probabilidad de errores humanos es elevada. Por ejemplo, el que se encuentre inadvertidamente pinzada la línea que suministra líquido de diálisis (en modalidad de hemodiafiltración Figura 1), condicionaría no computar como ultrafiltrado aquel volumen que atribuiríamos al líquido de dialisis (en nuestro protocolo 1 litro por hora). Ello supondría una pérdida adicional a la deseada de 8 litros por turno de enfermería. Imaginar la repercusión hemodinámica resulta sencillo. Afortunadamente los monitores de nueva generación previenen contra estos fallos.

Nosotros recientemente hemos revisado el tratamiento dialítico del fracaso renal agudo, analizando en profundidad algunos aspectos técnicos y conceptuales que al lector de este primer Congreso de Nefrología por Internet le pueden resultar interesantes, revisión que aparece en en el libro del Fracaso Renal Agudo de Liaño y Pascual publicado este pasado mes de Enero de 2.000 (1) o complementarlos con el libro de Ronco y Bellomo de 1998 (2).
Aquí tan solo reseñaremos algunos aspectos a considerar en la monitorización de sistemas y en la anticoagulación de los circuitos extracorpóreos, quizá el talón de aquiles, de estas técnicas.
I. Monitorización de Sistemas Extracorpóreos
Con respecto a el mantenimiento de los circuito extracorpóreos los parámetros más importantes a monitorizar incluyen: En primer lugar los flujos de sangre, de ultrafiltrado, de reposición y de líquido de diálisis. En segundo lugar el registro de presiones en diferentes puntos del circuito. Por último, una serie de controles de seguridad encaminados a detectar la existencia de burbujas de aire en las líneas sanguíneas (y un sistema de clampaje automático distal al detector) y la existencia de sangre en el efluente, que se corresponde con la pérdida de integridad de la membrana del filtro dializador. Algunas máquinas disponen de un sistema colorimétrico que detecta el descenso de nivel de la trampa atrapaburbujas. Los sistemas mejores para la detección de aire y espuma en la línea de sangre son los de ultrasonidos. Para detectar espuma en los sistemas con infrarrojos hay que aumentar mucho la sensibilidad, con lo que dan muchas falsas alarmas. Adicionalmente se puede determinar la concentración de urea en el efluente. Un cociente entre esta concentración y la concentración sérica < de 0,6 indica pérdida de función de la membrana y nos debe sugerir el cambio electivo del dializador.
Con respecto a las bombas de sangre, cabe reseñar que pueden llegar a ser muy poco precisas. Los sistemas que incluyen el fenómeno Doppler para su calibración, o sistemas más manuales deben tenerse en consideración. Para calibrar una bomba por nosotros mismos podemos utilizar el método de la burbuja. Si consideramos que la fracción de filtración no debe superar el 25% (para prevenir la excesiva hemoconcentración en la región de salida del hemofiltro), un flujo menor del deseado con una ultrafiltración importante puede ser causa de la pérdida frecuente de filtros por coagulación.
La falta de precisión en las bombas de líquido de diálisis y/o de ultrafiltración (dependiendo del sistema de que se trate) puede constituir importantes fuentes de error en el cálculo de los balances hídricos. Un sistema de comprobación implicaría la recogida y cuantificación de todo el efluente y el registro de todas las bolsas y botellas empleadas en la diálisis y reposición. Sin embargo, los modernos monitores incluyen control del balance por sistema gravimétrico (de balanzas) o volumétrico.
Un circuito extracorpóreo ideal debería controlar las presiones a la entrada y a la salida del catéter de doble luz, a la entrada y de la salida del filtro, a la entrada y a la salida de la trampa atrapaburbujas (una parte importante de la coagulación de los filtros se produce a este nivel por la interfase aire-sangre) y en la salida del ultrafiltrado. De esta forma nos permitiría detectar precozmente a que nivel se encuentra el problema, y en ocasiones subsanarlo y reemplazar simplemente el sector afectado. Evitando así el coste innecesario de recambiar todo el sistema. Muchos monitores de diálisis intermitente han obviado la utilización de toma de presión prefiltro, ya que la coagulación del filtro en períodos cortos es poco probable, Sin embargo, con las técnicas continuas se hace más necesaria esta medición. La presión de la rama de entrada, antes de la bomba, refleja el funcionamiento del acceso vascular (una presión excesivamente negativa nos indicará falta de flujo y puede favorecer la hemólisis y la entrada de aire en el circuito) y nos alertará de una posible desconexión de la línea "arterial" al igualarse la presión a la atmosférica.
Algunos monitores equiparan la presión del filtro a la que miden en la trampa atrapaburbujas de la rama de retorno. Esto es una aproximación, ya que la caída aproximada de presión dentro del hemofiltro a un flujo de 100 mL/min es de 20 mm Hg.
A partir de estos parámetros se puede calcular la presión transmembrana (calculada como la diferencia entre la semisuma de las presiones de entrada y salida al filtro, menos la presión en la rama del efluente), el coeficiente de ultrafiltración (cociente entre el flujo de ultrafiltrado y la presión transmembrana), las resistencias arterial, venosa, del filtro y a través de la trampa atrapaburbujas (cociente, esta última, entre la diferencia de presiones a la entrada y salida de la trampa y el flujo sanguíneo).
Una máquina de última generación, como la PRISMA (de Hospal-Cobe), con cuatro cuerpos de bomba peristáltica más una bomba de heparina (u otra medicación) incluye el registro de la presión en línea de entrada, presión en línea de retorno, presión prefiltro y presión en línea de efluente. Presenta detector de aire por ultrasonidos y detector de fuga de sangre en el efluente. Anticipa y detecta una presión transmembrana excesiva y la coagulación del filtro. Su flujo sanguíneo queda limitado de 10 a 180 mL/min. Tres balanzas actúan sobre los flujos de las bombas de efluente, diálisis y reinyección. El fabricante describe una precisión en la balanza de ± 0,45%. La preparación del circuito es automática y se realiza en tan solo ocho minutos. Presenta una pantalla táctil monocroma, que puede mostrarnos el historial de las últimas 24 horas. (Como la PRISMA de Cobe-Hospal) o controles volumétricos (como la HYGIEA plus, de Kimal, comercializada en España por Idemsa) En el caso de la PRISMA. Dispone de forma opcional, de la posibilidad de adaptar un calentador para líquidos.
Otro monitor, el MULTIMAT B-IC de Bellco, comercializado por Sorin en España, dispone de dos bombas peristálticas. La primera sirve para bombear el ultrafiltrado y la segunda bombea a la vez, con un ingenioso sistema de doble tubo en el segmento de bomba, sangre y líquido de reinfusión en HFVVC (en proporción de 100:15) o sangre y líquido de diálisis en HDVVC (en proporción 100:30) un sistema de balanza (gravimétrico) controla el balance de líquidos, con una gran autonomía, al disponer de bolsas de 12 litros. Incluye además, detección de presiones en línea de entrada de sangre, de salida y prefiltro. Posee además detector de aire ultrasónico y detector de fuga de sangre. Esta máquina adolece de la falta de bomba para heparina.
La HYGIEIA plus de Kimal, comercializada en España por Idemsa, posee un impecable control volumétrico (muy probablemente el de menor error). Además, al no ser de balanzas carece del inconveniente de los desequilibrios accidentales al mover la máquina. Dispone además de una batería de emergencia que la hace continuar funcionando en períodos de interrupción del suministro eléctrica. Posee una pantalla táctil de color unas grandes prestaciones técnicas. Está dotada de calentador de líquidos, de serie. Su inconveniente mayor parece ser el precio, que es el más elevado de entre los que conocemos, pero puede merecer la pena.
La BSM32 IC de Cobe-Hospal, más sencilla, con dos cuerpos de bomba peristáltica más otra bomba de émbolo para la heparina, dispone de control de presiones pre-bomba, presión prefiltro, caída de presión del hemofiltro (calculando además la presión media del filtro) y la presión de retorno. Detecta igualmente aire y espuma en la línea hemática y fugas de sangre en el ultrafiltrado. El fabricante describe una precisión de las bombas de ± 10%, con un rango de flujo sanguíneo que va desde 30 a 750 mL/min. No dispone de sistema gravimétrico ni volumétrico de control de líquidos. Para evitar errores dispone de un sistema de seguridad de fin de infusión. Su ventaja es que es familiar para la enfermería que ha trabajado en hemodiálisis intermitente con MONITRAL.
En Baxter combinan la BM11 y la BM14 para todo tipo de terapias continuas, disponiendo de líneas y filtros pediátricos. Entre ambos monitores se integran un total de tres bombas peristálticas: una para sangre, otra para sustitución y otra para ultrafiltración (con un rango de hasta 11 litros por hora). Posee monitorización de presión arterial, venosa y PTM. La precisión de la bomba de sangre de ±10% y la del balance de líquidos del 0,5%. Posee además un sistema de calentamiento de líquidos de substitución desde 33ºC a 40ºC.
El mayor inconveniente en la aplicación de las TCRR es la necesidad de una anticoagulación continua. Aunque consideramos que con diferentes pautas y alternativas, el riesgo de hemorragia severa inducida puede reducirse sustancialmente. Al hablar de anticoagulación en las TCRR lo más importante es tener bien claro el objetivo principal de nuestra intervención: Mantener sin coágulos el filtro, las líneas extracorpóreas y el/los catéter(es) y evitar una anticoagulación sistémica que favorezca las complicaciones hemorrágicas.
Como objetivo secundario podríamos incluir el mantener inerte la superficie de la membrana (para que no impida sus funciones difusiva, convectiva y adsortiva).
En primer lugar revisaremos someramente los mecanismos por los que se puede producir la coagulación del sistema de depuración. En segundo lugar analizaremos las alternativas utilizadas y referidas en la literatura médica. Nuestra experiencia se centra en la utilización de heparina sódica infundida a dosis bajas en la entranda al hemofiltro, ajustándose a parámetros de la coagulas, a la utilización de heparina fraccionada y de prostaglandinas. A continuación extractamos aquí algunas consideraciones para los participantes de este primer Congreso de Nefrología por Internet.
II. Mecanismos de coagulación de los circuitos extracorpóreos
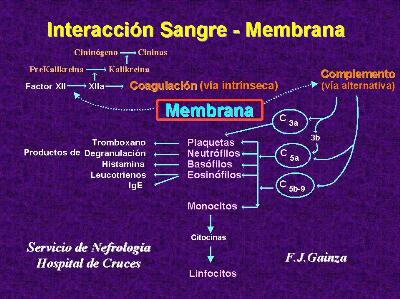
Las reacciones de la coagulación, que terminan en la formación de cadenas de fibrina, pueden ser desencadenadas por mecanismos de contacto (activándose el factor XII o Hageman) o por la liberación de mediadores tisulares -vía extrínseca-. El proceso culmina con la disolución de la fibrina mediada por la plasmina. En todo este proceso se encuentran implicadas varias enzimas, estableciéndose un equilibrio muy bien mantenido. Como dato interesante cabe decir que en un sólo mililitro de sangre existen las suficientes enzimas como para activar todo el fibrinógeno del organismo en tan sólo 15 segundos.
La interacción de la sangre (Figura 2) con el sistema del circuito extracorpóreo depende de varios factores:
1) Flujo sanguíneo
2) Viscosidad de la sangre
3) Diseño de la membrana
4) Activación de los mecanismos de hemostasia.
Con respecto al flujo sanguíneo en la modalidad arteriovenosa hay que decir que éste es a su vez dependiente del diámetro interno del catéter utilizado y de su boca. En esta modalidad se prefieren catéteres de boca ancha y cortos y el flujo dependerá de la tensión arterial media. Un menor flujo sanguíneo condiciona una mayor fracción de filtración (Flujo de ultrafiltrado dividido por flujo plasmático de entrada en el hemofiltro), lo que condiciona una mayor hemoconcentración y viscosidad a lo largo del filtro y un mayor riesgo de coagulación. Se barajan cifras del 20% de fracción de filtración como óptimas.
Con respecto a la bomba sanguínea (modalidad veno-venosa) cabe recordar que el flujo que indica el monitor puede no corresponderse con el real; además en los monitores antiguos (como en el módulo BSM-22, Hospal) no existe indicador de presión prefiltro, lo cuál puede hacer pasar inadvertido un problema de coagulación parcial del catéter. Esto está superada en los monitores de nueva generación como en el Prisma (Hospal-Cobe Renal).
La activación de la coagulación está en relación con la geometría de la membrana (las placas son algo menos trombogénicas que los capilares) y con su estructura química, estando íntimamente relacionada con el concepto de biocompàtibilidad (3). El contacto con una superficie extraña al organismo supone la activación de contacto que se inicia con el Factor XII (Factor Hageman). Este pone en marcha la activación del factor X a través de la denominada vía intrínseca de la coagulación donde entran en juego el factor XI, la calicreina de alto peso molecular, la precalicreina, el factor VIII y el IX. A partir de aquí concurren ambas vías de la coagulación con la activación del factor X que activa la trombina y esta a su vez el paso de fibrinógeno a fibrina, culminando con la polimerización de esta y la formación del coágulo.
III. Pautas posibles de anticoagulacion
Las diferentes alternativas de anticoagulación han sido revisadas recientemente por Mehta (4,5) y quedan resumidas en la Tabla 1. Como la práctica más extendida es la utilización de heparinas nos extenderemos más en ellas.
Tabla 1. Diferentes pautas de anticoagulación en hemofiltración y hemodiafiltración continuas
|
Pauta |
Sustancia |
Dosis |
Control |
|
Sin anticoagulación |
NaCl al 0,9%
|
100-150 mL/h |
Visualizar el filtro |
|
Dextrano de bajo p. molecular |
RheomacrodexR |
25 mL/h |
Visualizar el filtro |
|
Citratos |
Citrato trisódico 4% Calcio i.v. |
100-180 mL/h 4 mEq/h |
Monitorizar Calcio Visualizar tras bolos |
|
Prostaglandinas y derivados |
PGI2 Epoprostenol PE1 Taprostene |
4-8 ng × Kg-1× min-15 ng × Kg-1× min-120 ng· Kg-1 × min-125-35 ng × Kg-1× min-1 |
Visualizar el filtro
|
|
Inhibidor de proteasas
|
Mesilato de Nafamostat |
0,1 mg × Kg-1× h-1 |
TCA |
|
Heparina no fraccionada uso de protamina |
Heparina sódica Heparina-Protamina |
5-10 UI × Kg-11 mg de protamina por cada 100 UI de heparina Na |
APTT, TCA APTT, Heparinemia |
|
Heparinas de bajo peso molecular Membranas con heparina |
Enoxaparina Dalteparina sódica Duraflo |
10-40 mg/6h 2500-5000 UI/12h |
anti-Factor Xa anti-Factor Xa
|
TCA: tiempo de coagulación activado; APTT: tiempo parcial de tromboplastina activado
TCA: tiempo de coagulación activado; APTT: tiempo parcial de tromboplastina activado
La infusión de suero salino (unos 2 litros) es un paso obligado en la preparación y purgado de cualquier filtro. Sin embargo se han descrito pautas que comprenden la exclusiva utilización de suero salino durante todo el proceso. El ritmo recomendado de infusión oscila entre 100 y 250 mL por hora, siempre pre-filtro (4).
La diálisis sin heparina puede ser adoptada cuando exista un trastorno severo de la coagulación como: plaquetopenia severa, fallo hepático, o coagulopatía. Establecer una barrera pude ser muy pretencioso, y es al final el juicio clínico el que nos llevará a tomar la decisión. Los criterios que pueden adaptarse para la no utilización de anticoagulación son: 1) Recuento de plaquetas menor de 50 a 70(109 por litro. 2) Tiempo parcial de tromboplastina activado mayor de 60 segundos o dos veces el valor control, 3) un INR de protrombina mayor de 2 -o utilización de dicumarínicos- y 4) la presencia de sangrados espontáneos o coagulopatía intravascular diseminada.
En nuestra experiencia hemos podido mantener sin heparina los circuitos durante períodos prolongados de tiempo en el contexto de trombocitopenias. Bellomo et al (6) no utilizaron heparina en pacientes de alto riesgo de sangrado con supervivencia de filtro superiores a las treinta horas. Y en una serie de 37 pacientes Martin et al (7) reportaron una duración media de los filtros de 22,1 horas, apenas diferente a la que encontraron con heparina a dosis baja -como la empleada por nosotros- o con heparina a altas dosis.
Smoyer et al (8) en una serie de 114 pacientes pediátricos y adultos jóvenes no utilizaron heparina en el 47% de los casos, utilizando para ello criterios similares a los arriba mencionados. Además, no encontraron una disminución significativa en la duración de los filtros con o sin heparina.
III.B. Dextrano de bajo peso molecular Otras alternativas como la utilización de Dextranos de bajo peso molecular (RheomacrodexR) en infusión continua no han resultado ser eficaces en un estudio controlado aleatorizado, pero con sólo 11 pacientes tratados (9). El Dextrano de bajo peso molecular inhibe la agregación plaquuetaria, la actividad de trombina, y la agregación de monómeros de fibrina. III.C. Anticoagulación con citratos
Se ha propuesto la infusión de citrato trisódico al 4% a ritmo de 100 a 180 mL por hora. El citrato posee el riesgo de provocar hipocalcemia severa por lo que es obligada la monitorización de este catión divalente y su infusión por una vía central. Recomendándose la infusión de 40 mL/h de una solución que contenga 1 mEq de calcio por cada 10 mL (10, 11).
Nosotros tenemos amplia experiencia con citratos (ACD) en plasmaféresis, pero no los hemos aplicado en las TCRR. ). Se ha descrito la anticoagulación con citratos al 2,2% en un paciente con FRA e hipercalcemia tumoral con mieloma múltiple (12). Tambien se ha utilizado (13) un líquido de reposición prefiltro, es decir, predilución, con citrato trisódico a una concentración de 13,3 mMol/L (40 mEq/L), cloruro sódico 100 mMol/L, cloruro magnésico 0,75 mMol/L y dextrosa 0,2%. Precisando infundir por otra línea una solución con 20 gramos de gluconato cálcico por litro de glucosado al 5% para mantener una concentración de calcio iónico de entre 1 y 1,1 mMol/L, es decir, de 4 a 4,4 mg/dL.
III.D. Prostaciclinas
Derivada del metabolismo del ácido araquidónico, la prostaciclina (PGI2), es sintetizada por las células endoteliales y posee un efecto anticoagulante. Asociada a heparina o en forma aislada y en dosis de 4 a 8 ng por Kg de peso por minuto, posee la ventaja de ahorrar heparina pero el inconveniente de producir hipotensión arterial. Sin embargo, se ha descrito una buena tolerancia (14) clínica, en parte por que se pierde con el ultrafiltrado y en parte porque posee una vida media corta. Nosotros hemos utilizado el epoprostenol (FlolanR) a dosis de 5 ng/kg por minuto con buenos resultados y buena tolerancia (datos sin publicar)
Un derivado sintético análogo de la prostaciclina, el taprostene (con el 20 por ciento de la actividad inhibidora frente a la agregabilidad plaquetar que posee la PGI2) ha sido empleado a dosis de 25 a 35 ng/Kg/minuto. Cuando se utilizó de forma aislada tan sólo fue eficaz durante 2 horas precisando asociarse a heparina a dosis bajas (200 UI/h) para conseguir anticoagulación eficaz (15). Con el objeto de aminorar la tendencia a la trombocitopenia que aparece en el Fallo Multiorgánico y en el inicio de la hemofiltración Klotez et al (16) utilizaron, asociado a dosis muy bajas de heparina (350 UI/h), PGI2 a 20 µg/h. III.F. Mesilato de Nafamostat
A dosis de 0,1 mg por Kg y hora tiene la desventaja de disminuir la eficacia del filtro. Es uno de los inhibidores de proteasa con cierta actividad anticoagulante. Tiene una vida media de 5 a 8 minutos. Su mecanismo de acción es inhibiendo la trombina, los factores Xa y XIIa y la agregación plaquetar. su monitarización incluye el Tiempo de Coagulación Activado. Es considerado por algunos como anticoagulante de primera línea en los pacientes críticos (17). Sin embargo consideramos que la experiencia con este producto es muy reducida y desconocemos posibles inconvenientes.
III.G. Diálisis con heparina no fraccionada:
Es, sin duda alguna el procedimiento más empleado. La gran experiencia acumulada por los centros, la familiarización con el uso de heparina tanto por el personal sanitario de las unidades de cuidados intensivos, reanimaciones como de nefrología y su reducido coste económico la convierten en un fármaco ampliamente aceptado.
Un porcentaje minoritario de pacientes son tributarios de anticoagulación sistémica (portadores de prótesis valvulares cardíacas, tromboembolismos pulmonares, trombosis venosas profundas, etc.). Es en ellos donde el manejo de los hemofiltros puede resultar más cómodo ya que no supone un control de laboratorio añadido al que ya venga realizando de forma rutinario la unidad de hematología correspondiente. Sin embargo, con relativa frecuencia en estos casos la reiterada coagulación de filtros- incluso en intervalos inferiores a las 12 horas- nos ha llevado a infundir por la rama arterial del filtro dosis muy bajas de heparina (1,25 a 2,5 mg por hora).
El resto de los pacientes, la mayoría de ellos, son tributarios de una heparinización regional en donde se infunden, por la rama arterial, dosis bajas de heparina sódica. Las dosis más ampliamente utilizadas oscilan entre los 5 mg/h de forma fija o bien 10 Unidades Kg de peso (100 Unidades equivalen a 1 mg). Es decir un paciente de 70 Kg recibiría una dosis horaria de 7 mg. Así por citar algunos autores, Smoyer et al (8) emplearon la anticoagulación regional en el 49% de sus casos reportados.
El control de laboratorio que requiere esta anticoagulación es la determinación del Tiempo Parcial de Tromboplastina activado (aPTT), que es el que evalúa de forma específica la vía intrínseca de la coagulación. El objetivo marcado por trabajos más recientes y por nosotros mismos es mantener un aPTT de entre 1,3 y 1,5 veces el control (8), Así Van de Wetering et al (18) recomiendan aPTT de entre 35 a 45 segundos; encontrando además que el riesgo de coagulación del filtro disminuye un 25% por cada 10 segundos que se incrementa el APTT. De esta forma se va titulando la dosis de heparina en función del resultado (duración de los filtros, volumen de ultrafiltrado y presencia de sangrados y su importancia). Esta determinación se puede realizar cada 6, 12 o 24 horas. Nuestra preferencia es realizar cada 12 horas el control de APTT en rama arterial (previo a la entrada de la heparina) y en rama venosa cada 12 horas. Buscamos APTT casi normales (inferiores a 40 segundos) en rama arterial (que se corresponde con el APTT sistémico) y valores próximos a 1,5 veces y siempre inferiores al doble del control en rama venosa (salida del filtro).
En una reciente y amplia serie sobre 408 pacientes la anticoagulación fundamental se basó en la administración de heparina sódica continua para conseguir APTT de entre uno y dos veces el valor control (19). Estos autores describen la utilización de prostaciclina en dosis de 5 ng/kg/min en el contexto de diátesis hemorrágica o asociada a heparina, en el supuesto de coagulaciones frecuentes.
Existen autores que ajustan la dosis de heparina no fraccionada en función del Tiempo de Coagulación activado, para mantenerlo por encima de 110 segundos (20).
III.H. Heparina-Protamina
Con el objetivo de neutralizar los efectos de la heparina que se infunde a la entrada del circuito se puede infundir a la salida del hemofiltro protamina en dosis de 1 mg por cada 100 unidades de heparina. No es una técnica muy extendida y se suele reservar para pacientes a riesgo de sangrar. Implica una monitorización más estrecha de controles de laboratorio. Por ejemplo en una serie de 114 tratamientos sobre 98 pacientes Smoyer et al. (8) utilizan una anticoagulación prefiltro en infusión continua (sin bolo de inicio) para conseguir unos APTT de entre 130 y 150 por ciento del valor control a nivel del filtro, sin intentos de anticoagulación sistémica, y que la protamina tan sólo la emplearon en unos pocos casos para revertir la anticoagulación. En el estudio de Bellomo et al (6) se describe la utilización de protamina para mantener APTT sistémicos inferiores a 40 segundos y en filtro superiores a 80 segundos.
III.I. Diálisis con heparina de bajo peso molecular:
Es una alternativa no generalizada que puede presentar ventajas (21). La contrapartida quedaría reflejada en un mayor coste económico. Cabe preguntarse ante todo ¿es mejor la heparina de bajo peso molecular que la no fraccionada?
Antes de entrar en materia sobre la preferencia de una u otra en la practica clínica merece la pena hacer algunas consideraciones genéricas sobre las diferencias existentes entre ambas desde el punto de vista de su mecanismo de acción y farmacocinética. Para ello utilizando un editorial de Schafer (22) extractamos las siguientes consideraciones:
La heparina actúa como anticoagulante al unirse a la antitrombina III plasmática. Esta interacción induce cambios conformacionales en la antitrombina III que mayormente aumenta su capacidad de activar las enzimas de la coagulación, incluyendo la trombina y el factor Xa. Los preparados de heparina estándar (no fraccionada) se componen de una mezcla heterogénea de cadenas de polisacáridos que van desde 3.000 a 30.000 daltons de peso molecular.
Los preparados de heparina de bajo peso molecular son fragmentos de heparina estándar, producidos comercialmente, mediante procesos enzimáticos o de despolimerización química, consiguiendo cadenas de entre 4.000 y 6.000 daltons. La actividad anticoagulante de ambas heparinas reside en una única secuencia de 5 sacáridos que se encuentra aleatoriamente distribuida a lo largo de la cadena de heparina y que se une con gran afinidad a la antitrombina III.
La principal diferencia entre la heparina estándar y la de peso molecular bajo radica en el efecto inhibitorio sobre el factor Xa y la trombina. Cualquier heparina, conteniendo la secuencia del pentasacárido, inhibe el factor Xa simplemente por unirse a la antitrombina III y de esta forma acelerando la interacción entre factor Xa y antitrombina III. Por contra, la inactivación de la trombina por la heparina requiere que ésta se una tanto a antitrombina III como a trombina, formándose un complejo ternario. Este complejo sólo se puede formar con un mínimo de unidades de 18 sacáridos de longitud que incluya además la secuencia de pentasacáridos. La mayoría de las moléculas de heparina estándar tienen al menos esa longitud, mientras que sólo un porcentaje pequeño de moléculas de heparina de bajo peso molecular son lo suficientemente largas como para unirse a la vez a la antitrombina III y a la trombina. Es decir, la heparina estándar posee una actividad inhibitoria equivalente ante el factor Xa y la trombina mientras que las preparaciones de heparina de bajo peso molecular preferentemente inactivan el factor Xa.
La heparina de peso molecular bajo ha sido considerada, desde el punto de vista teórico, superior a la estándar en varios aspectos. Primero, es más efectiva porque puede inactivar el factor Xa unido a las plaquetas y puede resistir la inhibición por el factor 4 plaquetar, el cuál se libera durante la coagulación. Segundo, puede causar menos complicaciones hemorrágicas, posiblemente por su menor efecto sobre la función plaquetar y la permeabilidad vascular. Tercero, su biodisponibilidad y farmacocinética son más favorables porque se une con menor facilidad al endotelio vascular, macrófagos y proteínas plasmáticas que la estándar. Su vida media es dos a cuatro veces mayor que la de la heparina estándar. Todo ello permite que sea administrada sólo una o dos veces al día, prácticamente sin monitorización de laboratorio. Si se realiza incluiría el control sobre el Factor Xa, ya que no altera sustancialmente el APTT. Algunos autores cuando emplean heparina de bajo peso molecular (3) ajustan las dosis para conseguir niveles de anti-Xa entre 0,1 y 0,5 UI/mL, o entre 0,25 y 0,5 UI/mL (21).
III.J. Membranas adheridas con moléculas anticoagulantes
El desarrollo de membranas a las que se unen determinadas moléculas como la heparina, parecen abrir nuevos campos en la prevención de la coagulación precoz y permitiendo ahorrar dosis de anticoagulación. El DuraflóR es un ejemplo de membrana de polisulfona con moléculas unidas de heparina.
Datos sobre nuestara experiencia con anticoagulación, dosis y duración de los filtros aparecen recientemente publicados en el libro de Net y Roglan (23). Por otra parte, . Nosotros hemos analizado un total de 710 hemofiltros aplicados en 107 pacientes (24). Nuestro objetivo era recambiar a las 48 horas los filtros o antes si se coagulaban. Los filtros resistieron ese período en un 26% de los casos y se coagularon antes en el 45%. En los capilares la duración promedio fue de 27,3 horas y en las placas de 30,5 horas. Si bien el APTT en el primer caso fue de 41 (± 14: DE) segundos y en las placas de 48 (±18) segundos.
Diferencias debidas a que utilizamos dosis diferentes (4,7±1,98 y 5,7±2,9 mg/h de heparina sódica, respectivamente). Esta experiencia se basa fundamentalmente en hemodiafiltración veno-venosa continua con máquina BSM 22 con detector de presión venosa de retorno (VPM).
IV. Bibliografía
1. Gainza FJ, Minguela I, Urbizu JM. Tratamiento dialítico del fracaso renal agudo. En: Liaño y Pascual (editores). Fracaso Renal Agudo. Masson,Madrid 2.000, pp:
2. Current technology for continuous renal replacement therapies. En : Ronco C & Bellomo R editores; Critical care nephrology. Kluwer Academic Publishers. Amsterdam 1998. pp.: 1269-1308
3. Hakim RM. Clinical implications of hemodialysis membrane biocompatibility. Kidney Int 1993; 44: 484-494
4. Mehta RL. Anticoagulatiopn during continuous renal replacement therapy. ASAIO J 1994; 40: 931-935
5. Mehta RL. Anticoagulation strategies for continuous renal replacement therapies: What works?. Am J Kidney Dis 1996; 28 (5S3): S8-S14
6. Bellomo R, Teede H, Boyce N. Anticoagulant regimens in acute continuous hemoodiafiltration: a comparative study. Intensive Care Med 1993; 19: 329-332
7. Martin PY, Chevrolet JC, Suter P, Favre H. Anticoagulation in patients treated by coontinuoous venoovenous hemooffiltration: A retrospective study. Am J Kidney Dis 1994; 24: 806-812
8. Smoyer WE, McAdams C, Kaplan BS, Sherbotie JR. Determinants of survival in pediatric continuous hemofiltration. J Am Soc Nephrol 1995; 6:1401-1409
9. Pelevski PM, Burr R, Moreland L, Yokiwa Y, Greenberg A. Failure of low molecular weight dextran to prevent clotting during continuous renal replacement therapy. ASAIO J 1995; 41: 847-849
10. Mehta RL, McDonald BR, Aguilar M, Ward DM. Regional citrate anticoagulation for continuous arteriovenouous hemodialysis in critically ill patients. Kidney Int 1990, 38: 976-981
11. Mehta RL, McDonald BR, Ward DM. Regional citrate anticoagulation for continuous arteriovenouous hemodialysis -An update after twuelve months. En: Sieberth HG, Mann H, Stummvoll HK (editores). Contrib Nephrol. Basel. Karger 1991, Vol 93. pp 210-214
12. Stramek V, Novak I, Matejovic, Rokyta, Nalos M, Hora P, Pittrova H. Continuous venovenous hemodiafiltration (CVVHDF) with citrate anticoagulation in the treatment of a patient with acute renal failure, hypercalcemia, and thrombocytopenia. Intensive Care Med 1998; 24(3): 262-264
13. Palsson R, Niles JL. Regional citrate anticoagulation in continuous venovenous hemofiltration in critically ill patients with a high risk of bleeding. Kidney Int 1999; 55: 1991-1997
14. Journois D, Chanu D, Pouard P, Mauriat P, Safran D. Assesment of standarized ultrafiltrate production rate using prostacyclin in continuous venovenous hemofiltration. En: Sieberth HG, Mann H, Stummvoll HK (edits). Contrib Nephrol. Basel. Karger 1991, Vol 93. pp 202-204
15. Maurin N. Antithrombotic management with a stable prostacyclin analogue during extracorporeal circulation. En: Sieberth HG, Mann H, Stummvoll HK (edits). Contrib Nephrol. Basel. Karger, 1991, Vol 93. pp 205-209
16. Klotz KF, Gellersen H, Brzelinski T. Use of prostacyclin with continuous hemofiltration after open heart surgery. En: Sieberth HG, Stummvoli HK, Kierdof H (editores) Continuous extracorporeal treatment in in multiple organ dysfunction syndrome. Contrib Nephrol. Basel Karger 1995, Vol 116 pp 136-139
17. Ohtake Y, Hirasawa h, Sugai T, Oda S, Shiga H, Matsuda K, Kitamura N. Nafamostat Mesylate as anticoagulant in continuous hemofiltration and continuous hemodiafiltration. En: Sieberth HG, Mann H, Stummvoll HK (edits). Contrib Nephrol. Basel. Karger 1991, Vol 93. pp 215-217
18. van de Wetering J, Westendorp RGJ, van der Hoeven JG, Stolk B, Feuth JDM, Chang PC. Heparin use in continuous renal replacement procedures: the struggle between filter coagulation and patient hemorrhage. J Am Soc Nephrol 1996; 7: 145-150
19. ones CH, Richardson D, Goutcher E, Newstead CG, Will EJ,Cohen AT, Davison AM. Continuous venovenous high-flux dialysis in multiorgan failure: A 5-year single-center experience. Am J Kidney Dis 1998; 31: 227-233
20. Stefanidis I, Hägel J, Maurin N. Influence of coagulation parameters on filter running time during continuous venovenous hemofiltration. En: Sieberth HG, Stummvoli HK, Kierdof H (edits). Continuous extracorporeal treatment in in multiple organ dysfunction syndrome. Contrib Nephrol. Basel Karger 1995, Vol 116 pp 145-149
21. Wynckel A, Bernieh B,Toupance O, N'Guyen PH, Wong T, Lavaud S, Chanard J. Guidlines to the use of enoxaparin in slow continuous hemodialysis. En: Sieberth HG, Mann H, Stummvoll HK (edits). Contrib Nephrol. Basel. Karger 1991, Vol 93.pp 221-224
22. Schafer AI. Low-molecular weight- heparin -- An opportunity for home treatment of venous thrombosis. N Eng J Med 1996; 334: 724-725
23. Gainza FJ, Minguela JI, Urbizu JM. Anticoagulación de los circuitos extracorpóreos en hemofiltración y hemodiálisis continuas. En: Fracaso renal agudo en el paciente crítico. De: Net y Roglan (editores). Barcelona 1999. Springer-Verlag Ibérica.. pp: 229-238
24. Urbiza JM, Minguela JI, Gainza FJ, Gimeno I, Lampreabe I. Técnicas continuas de depuración en el fracaso renal agudo: Relación de la arquitectura de los hemofiltros con su duración y parámetros de coagulación (resumen). Nefrología 1998; 18(3): 25