Barley J, Blackwood A, Miller M, et al. Angiotensin converting enzyme gene I/D polymorphism, blood pressure and the renin-angiotensin system in Caucasian and Afro-Caribbean peoples. J Hypertens 1996; 10:31
Broekroelofs J, Stegeman CA, Navis G, Tegzess AM, De Zeeuw D, De Jong PE. Risk factors for long-term renal survival after renal transplantation: a role for angiotensin-converting enzyme (insertion/deletion) polimorphism?. J Am Soc Nephrol 1998; 9:2075
Cambien F, Ahlenc-Gelas F, Herbeth B, et al. Familial resemblance of plasma angiotensin-converting enzyme level: the Nancy study. Am J Hum Genet 1988; 43:774
Deng Y, Rapp JP. Cosegregation of blood pressure with angiotensin converting enzyme and atrial natriuretic peptide receptor genes using Dahl salt-sensitive rats. Nature Genet 1992; 1:267
Doi Y, Yoshizumi M, Iino K, et al. Association between a polymorphism in the angiotensin-converting enzyme gene and microvascular complications in Japanese patients with NIDDM. Diabetologia 1996; 39:97
Fernández-Llama P, Poch E, Oriola J, Botey A, Coll E, Darnell A, Rivera F, Revert L. Angiotensin converting enzyme gene I/D polymorphism in essential hypertension and nephroangiosclerosis. Kidney Int 1998; 53:1743
Fernández-Llama P, Poch E, Oriola J, Botey A, de la Sierra A, Revert L, Rivera F, Darnell A. Polimorfismos genéticos del sistema renina angiotensina e hipertensión arterial esencial. Med Clin (Barc) 1999; 112:561
Fornage M, Amos CI, Kardia S, et al. Variation in the region of the angiotensin-converting enzyme gene influences interindividual differences in blood pressure levels in young white males. Circulation 1998; 97:1773
Fujisawa T, Ikegami H, Kawaguchi Y, et al. Meta-analysis of association of insertion/deletion polymorphism of angiotensin I-converting enzyme gene with diabetic nephropathy and retinopathy. Diabetologia 1998; 41: 47
Fujisawa T, Ikegami H, Shen G-O, et al. Angiotensin I-converting enzyme gene polymorphism is associated with miocardial infarction, but not with retinopathy or nephropathy, in NIDDM. Diabetes Care 1995; 18:983
Giner V, Poch E, Bragulat E, Oriola J, González D, Coca A, de la Sierra A. Renin-angiotensin system gene polymorphisms and salt sensitivity in essential hypertension. Hypertension 2000; 35:512
Harden PN, Geddes C, Rowe PA, et al. Polymorphism in angiotensin-converting enzyme gene and progression of IgA nephropathy. Lancet 1995; 345:1540
Henley TE, Julian BA, Phillips JA, et al. Angiotensin converting enzyme gene polymorphims: Potencial silent motif and impact of progression in IgA nephropaty. Kidney Int. 1996; 49:571
Higashimori K, Zhao Y, Higaki J, et al. Association analysis of a polymorphism of the angiotensin converting enzyme gene with essential hypertension in the Japanese population. Biochem Biophys Res Commun 1993; 191:399
Hilbert P, Lindpaintner K, Beckmann JS, et al. Chromosomal mapping of two genetic loci associated with blood pressure regulation in hereditary hypertensive rats. Nature 1991; 353:521
Itoh H, Mukoyama M, Pratt RE, Gibbons GH, Dzau VJ. Multiple autocrine growth factors modulate vascular smooth muscle cell growth response to angiotensin II. J Clin Invest 1993;91:2268
Jacob HJ, Lindpaintner K, Lincoln SE, et al. Genetic mapping of a gene causing hypertension in the stroke-prone spontaneously hypertensive rat. Cell 1991; 67:1213
Jeunemaitre X, Lifton RP, Hunt SC, Williams RR, Lalouel JM. Absence of linkage between the angiotensin converting enzyme locus and human essential hypertension. Nature Genet 1992;1:72
Johnson AG, Simons LA, Friedlander Y, Simons J, Davis DR, Macallum J. I/D polymorphism of the angiotensin-converting enzyme gene does not predict isolated systolic or systolic diastolic hypertension in the elderly. J Hum Hypertens 1996;10:171
Kario K, Kanai N, Nishiuma S, et al. Hypertensive nephropathy and the gene for angiotensin-converting enzyme. Arterioscler Thromb Vasc Biol 1997; 17:252
Kiema T-R, Kauma H, Rantala AO, et al. Variation at the angiotensin-converting enzyme gene and angiotensinogen gene loci in relation to blood pressure. Hypertension 1996; 28:1070
Koike G, Krieger JE, Jacob HJ, Mukoyama C, Pratt RE, Dzau VJ. Angiotensin converting enzyme and genetic hypertension: cloning of rat cDNAs and characterization of the enzyme. Biochem Biophys Res Commun 1994; 198:380
Krege JH, John SWM, Langenbach LL, et al. Male-female differences in fertility and blood pressure in ACE-deficient mice. Nature 1995; 375:146
Kreutz R, Hübner N, Ganten D, Lindpaintner K. Genetic linkage of the ACE gene to plasma angiotensin-converting enzyme activity but not to blood pressure. A quantitative trait locus confers identical complex phenotypes in human and rat hypertension. Circulation. 1995; 92:2381
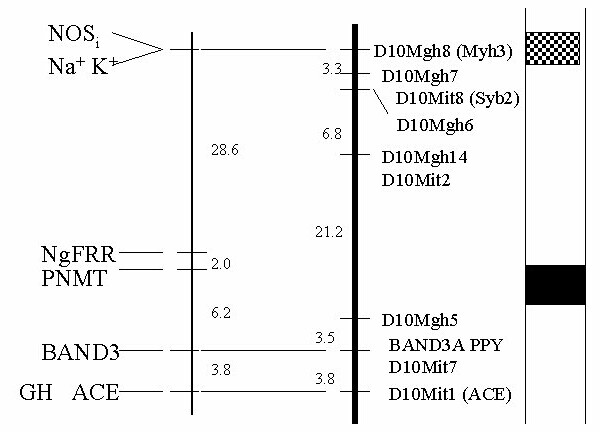
Kreutz R, Hubner N, James MR, et al. Dissection of a quantitative trait locus for genetic hypertension on rat chromosome 10. Proc Natl Acad Sci USA 1995; 92:8778
Lander ES, Schork NJ. Genetic dissection of complex traits. Science 1994; 265:2037
Lifton RP. Genetic determinants of human hypertension. Proc Natl Acad Sci USA 1995: 92:8545
Marre M, Bernadet P, Gallois Y, et al. Relationship between angiotensin I converting enzyme gene polymorphism, plasma levels, and diabetic retinal and renal complications. Diabetes 1994; 43:384
McLaughlin KJ, Harden PN, Ueda S, Boulton-Jones JM, Connell JMC, Jardine AG. The role of genetic polymorphisms of angiotensin-converting enzyme in the progression of renal diseases. Hypertension 1996; 28:912
MoriyamaT, Kitamura H, Ochi S, et al. Association of Angiotensin I-converting enzyme gene polymorphism with susceptibility to antiproteinuric effect of angiotensin I-converting enzyme inhibitors in patients with proteinuria. J Am Soc Nephrol. 1995; 6:1674
O'Donnell CJ, Lindpaintner K, Larson MG, et al. Evidence for association and genetic linkage of the angiotensin-converting enzyme locus with hypertension and blood pressure in men but not women in the Framingham heart study. Circulation 1998; 97:1766
Ohno T, Kawazu S, Tomono S. Association analyses of the polymorphisms of angiotensin-converting enzyme and angiotensinogen genes with diabetic nephropathy in japanese non-insulin-dependent diabetics. Metabolism 1996; 45:218
Parving H-H, Jacobsen P, Tarnow L, et al. Effect of deletion polymorphism of angiotensin converting enzyme gene on progression of diabetic nephropathy during inhibition of angiotensin converting enzyme: observational follow up study. Br Med J 1996; 313:591
Poch E. Cómo diagnosticar las formas genéticas de hipertensión, en Decisiones clínicas y terapéuticas en el paciente hipertenso, Segunda Edición, editado por A Coca and A de la Sierra. Ed. JIMS, Barcelona, 1998:167
Pontremoli R, Sofia A, Tirotta A, et al. The deletion polymorphism of the angiotensin I-converting enzyme gene is associated with target organ damage in essential hypertension. J Am Soc Nephrol 1996; 12:2550
Rigat B, Hubert C, Alhenc-Gelas F, Cambien F, Corvol P, Soubrier F. An insertion/deletion polymorphism in the angiotensin I-converting enzyme gene accounting for half the variance of serum enzyme levels. J Clin Invest 1990; 86:1343
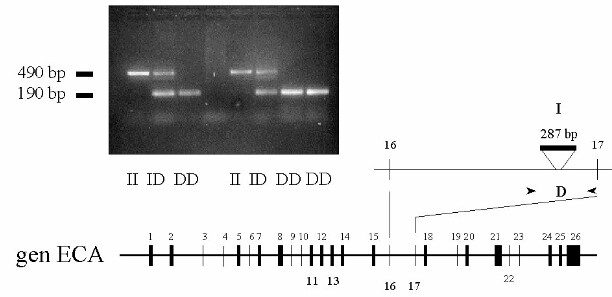
Rigat B, Hubert C, Corvol P, Soubrier F: PCR detection of the insertion/deletion polymorphism of the human angiotensin converting enzyme gene (DCP1) (dipeptidyl carboxipeptidase 1). Nucleic Acids Res. 1992; 20:1433
Rutledge DR, Kubilis P, Browe CS, Ross EA. Polymorphism of the angiotensin converting enzyme gene in essential hypertensive patients. Biochem Mol Biol Int 1995; 35:661
Schmidt S, Schöne N, Ritz E, and the Diabetic Nephropathy Study Group. Association of ACE gene polymorphism and diabetic nephropathy? Kidney Int 1995; 47:1176
Schmidt S, Van Hoof I, Grobbee D, Ganten D, Eberhard R. Polymorphism of the angiotensin I-converting enzyme gene is apparently not related to high blood pressure: Dutch Hypertension and Offspring Study. J Hypertens. 1993; 11:345
Schunkert H, Hense H-W, Muscholl M, Luchner A, Riegger GAJ. Association of angiotensin converting enzyme activity and arterial blood pressure in a population-based sample. J Hypertens 1996; 14:571
Shanmugam V, Sell KW, Saha BK. Mistyping ACE heterozygotes. PCR Meth Appl. 1993; 3:120
Solini A, Sfriso A, Trevisan M, et al. Analysis of ACE polymorphism in sib-pairs concordant for NIDDM and microalbuminuria. Diabetologia 1996; 39 (suppl):A74
Tarnow L, Cambien F, Rossing P, et al. Lack of relationship between an insertion/deletion polymorphism in the angiotensin I-converting enzyme gene and diabetic nephropathy and proliferative retinopathy in IDDM patients. Diabetes 1995; 44:489
Tarnow L, Rossing P, Jacobsen P, et al. Progression of diabetic nephropathy and the insertion/seletion polymorphism (ACE I/D) of the angiotensin-converting enzyme gene (Abstract) J Am Soc Nephrol 1996; 6:441.
Tiret L, Rigat B, Visvikis S, et al. Evidence, from combined segregation and linkage analysis, that a variant of the angiotensin I-converting enzyme (ACE) gene controls plama ACE. Am J Hum Genet 1992; 51:197
van Essen GG, Rensma Pl, de Zeeuw D, Sluiter WJ, Scheffer H, Apperloo AJ. Association between angiotensin-converting enzyme gene polymorphism and failure of renoprotective therapy. Lancet 1996; 347:94
Ward R. Familial aggregation and genetic epidemiology of blood pressure. En: Laragh JH, Brenner BM, editores. Hypertension: Pathophysiology, diagnosis and management. Raven Press Ltd, New York, 1994: 67
Yoshida H, Kuriyama S, Atsumi Y, et al. Angiotensin I converting enzyme gene polymorphism in non-insulin dependent diabetes mellitus. Kidney Int.1996; 50:657
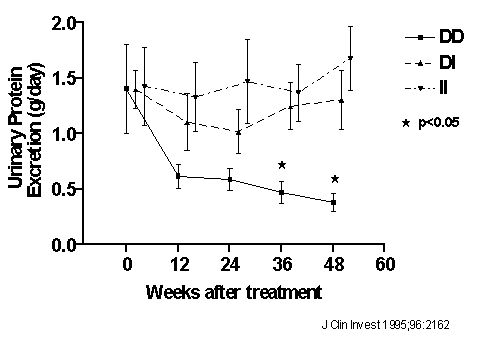
Yoshida H, Mitarai T, Kawamura T, et al. Role of the deletion polymorphism of the angiotensin converting enzyme genein the progression and therapeutic responsiveness of IgA nephropathy. J Clin Invest 1995; 96:2162
Zee RYL, Lou Y, Griffiths LR, Morris BJ: Association of a polymorphism of the angiotensin I converting enzyme gene with essential hypertension. Biochem Biophys Res Commun. 1992; 184:9