
| DISCUSSION BOARD |
1. Información que aporta la biopsia ósea sin descalcificar.
El término osteodistrofia renal (ODR) se utiliza desde hace años para englobar de forma sindrómica al conjunto de lesiones óseas que aparecen en la insuficiencia renal crónica (IRC) (1) y para su conocimiento y compresión era necesario el estudio de la estructura y dinámica ósea , mediante la biopsia ósea (3-5).
Durante décadas la preparación del tejido óseo para su estudio consistió en la eliminación previa de los componentes inorgánicos para obtener un tejido lo suficientemente blando y homogéneo para que, después de ser incluido en parafina, pudiera ser cortado de manera rutinaria junto a las muestras procedentes de otros órganos. Esta técnica es inadecuada para el estudio de la patología ósea metabólica pues no permite distinguir el hueso mineralizado del que no lo está, ni realizar un estudio dinámico (2). Por consiguiente, para que la muestra nos proporcione una información útil es necesario que no haya sido descalcificada previamente.
A final de los años 50, los métodos de inclusión en plástico, destinados para obtener cortes ultrafinos para microscopía electrónica se introdujeron en los laboratorios de patología ósea. Los plásticos, al polimerizarse, pueden adquirir un grado de dureza semejante al del tejido óseo y, al infiltrar simultáneamente hueso y médula ósea, dan al bloque una consistencia homogénea. De este modo, se puede cortar y pulir la inclusión sin que se provoquen artefactos.
Con el estudio de la biopsia ósea sin descalcificar podemos estudiar como está funcionando el hueso, es decir, su actividad celular, cantidad mayor o menor de hueso mineralizado y osteoide, la existencia o no de fibrosis peritrabecular y el volumen óseo. En el caso que se haya realizado el marcaje con tetraciclinas se puede estudiar de manera dinámica la mineralización del hueso. Utilizando técnicas histoquimicas específicas como la tincion con el ácido aurín tricarboxílico ( Aluminón) podemos valorar la existencia de depósitos de Al, su cantidad y situación. Por último, todos los elementos que integran el hueso pueden cuantificarse mediante histomorfometría ósea (3-6).
2. ¿ Qué ha aportado la biopsia ósea en el enfermo urémico?.
La biopsia ósea sin descalcificar ha aportado una valiosa información sobre la patogénesis, diagnóstico y respuesta al tratamiento de las enfermedades óseas en general. En el caso de la ODR ha sido fundamental para clasificar de manera racional las diferentes formas que la integran, desenmascarar la enfermedad por aluminio (Al), y establecer una conducta terapéutica según las lesiones predominantes (3-5).
En base a esto, la ODR se clasifica en tres tipos histológicos diferentes: enfermedad ósea de alto remodelado u osteítis fibrosa (OF), enfermedad ósea de bajo remodelado que incluye a la osteomalacia (OM) y a la enfermedad ósea aplasica o adinámica (EOA) y, por último, la enfermedad ósea mixta (EM) (7).
La OF se caracteriza por una imagen histológica de remodelado aumentado. En las trabéculas óseas se observa un aumento del número de unidades de remodelado óseo (BRU) y, por lo tanto se advierte, un aumento del número y tamaño de los osteoblastos, hiperplasia de los osteoclastos multinucleados con aumento del número de resorciones y túneles de resorción. La fibrosis peritrabecular que se extiende a la zona medular es uno de los hallazgos característicos de las entidades de alto remodelado(Fig.1). Los índices dinámicos exhiben un aumento en la longitud y en el número de dobles bandas de tetraciclinas(Fig. 2), con una velocidad de aposición y tasas de formación óseas aumentadas (7-10). Cuandos estos hallazgos son incipientes se puede denominar ODR mínima o leve, siendo a veces difícil de diferenciar del hueso normal.

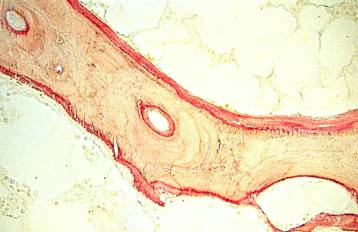
La OM se caracteriza por una marcada disminución en la tasa de formación ósea y por exceso de tejido osteoide laminar (5,7-10). El acúmulo de osteoide se produce por defecto en la mineralización a diferencia de la OF que se produce por la rápida formación de matriz extracelular. La fibrosis peritrabecular está ausente, y los pocos osteoblastos que se pueden observar no muestran signos de actividad(Fig. 3). En el estudio dinámico es característico la disminución en la tasa de formación ósea y el aumento en el retardo de la mineralización.

La EOA, a diferencia de la OM, presenta un área de osteoide disminuida (Fig. 4). Al igual que la OM presenta disminución o ausencia de BRU y ausencia de fibrosis peritrabecular (5-10).
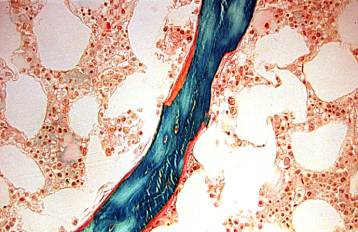
En la EM se observan signos de OF junto a otras alteraciones propias de OM. Hay un aumento en el número de BRU y fibrosis peritrabecular manifiesta(Fig. 5). En cambio, el volumen de osteoide suele ser superior al 15% y, en el estudio dinámico, la tasa de formación ósea puede estar disminuida, normal o aumentada.
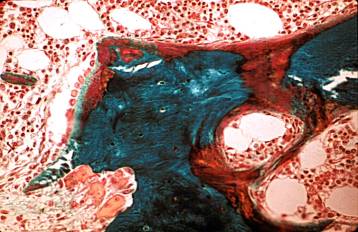
En cuanto a la sobrecarga tisular de Al, en las diferentes series publicadas se describe que puede observarse Al en cualquier tipo histológico de ODR, aunque en unos porcentajes muy diferentes. En la ODR de alto remodelado, la presencia de Al suele ser escasa, mientras que en los bajos remodelados, generalmente OM, dicha presencia es casi constante (7-10).
3. ¿Por qué se realizan pocas biopsias óseas?.
Lo cierto es que más del 85-90% de los pacientes en diálisis con ODR no son estudiados mediante biopsia ósea de manera ni siquiera ocasional (5,11). Existen una serie de posibles razones para esta escasa difusión: requiere una dedicación importante por el departamento o servicio interesado en la enfermedad ósea metabólica; los pacientes precisan una preparación previa para el marcaje óseo con tetraciclinas para el estudio dinámico; la técnica de realización, aunque no es difícil, requiere aprendizaje, es invasiva y, a veces, dolorosa para el paciente; requiere una infraestructura de procesado compleja, con microtomos costosos, que son de poca utilidad para otras tareas; el procesado y tinción han de ser cuidadosos ya que, de no ser óptimos, dificultan mucho el contaje histomorfométrico; el contaje es laborioso y lleva tiempo (entre 1-3 horas por biopsia, dependiendo del método empleado). Todo ello hace que existan pocos grupos que tengan la infraestructura y conocimientos necesarios para la realización y estudio de la biopsia ósea en un grupo poblacional.
De ahí el interés de los investigadores en el desarrollo en los últimos años de marcadores bioquímicos del remodelado óseo que nos pueden ser de utilidad en el diagnóstico y seguimiento no invasivo de la patología ósea metabólica.
4. Alcance diagnóstico de los marcadores bioquímicos del remodelado óseo.
La hormona paratiroidea (PTH) no debe ser considerada como un marcador óseo, sino como un simple índice hormonal de una enfermedad metabólica ósea (12). La mayoría de los autores consideran que, en ausencia de estudio histológico, la PTH intacta (PTHi) medida por IRMA es el parámetro que con más precisión nos da una idea del remodelado óseo en los pacientes con IRC(13-22). Se han conseguido unas buenas correlaciones entre los niveles de PTHi y los diferentes parámetros histomorfométricos tanto de formación como de resorción. Igualmente, cuando observamos la media aritmética de la PTHi entre los diferentes tipos de ODR son diferentes. Es decir, que la media de PTHi entre la OF y otra forma de bajo remodelado como al EOA es diferente. El problema existente es que hay solapamiento importante entre los valores de los grupos. Por ello debemos avanzar más y estudiar la verdadera capacidad discriminatoria y de diagnóstico de los diferentes marcadores, realizando estudios de sensibilidad, especificidad y valores predictivos.
Torres y cols. en un amplio estudio de 119 pacientes observaron que una PTHi menor de 120pg/ml conseguía, para el diagnóstico de bajo remodelado, una sensibilidad del 48% , una especificidad de 94% y un valor predictivo positivo del 89%. Igualmente, una PTHi mayor de 450pg/ml descartó el bajo remodelado con una sensibilidad del 43%, especificidad del 100% y valor predictivo positivo de 1 (14).
Gerakis y cols. observaron que un nivel de PTHi superior a 200pg/ml conseguía, para el diagnóstico de OF, unos valores predictivos positivos y negativos de 78% y 74% respectivamente (22).
Coen y cols. en su reciente trabajo observaron como un nivel de corte de PTHi de 79,7pg/ml presentó una sensibilidad y especificidad del 88% y 93% respectivamente para el diagnóstico de alto remodelado (23).
La Fosfatasa Alcalina Total (FAT) es el marcador bioquímico más ampliamente utilizado para el estudio de las enfermedades óseas metabólicas, y en nuestro caso la ODR. Como principales ventajas presenta que nos está influenciado por el ritmo ciarcadiano y que no se acumula en la insuficiencia renal. Como principal inconveniente presenta una baja especificidad al no tener solamente un origen óseo.
Hay varios estudios donde se obtienen buenas correlaciones entre la FAT y parámetros histomorfométricos estáticos y dinámicos (superficie osteoblástica, superficie de osteoide, tasa de remodelado óseo y velocidad de aposición) (7, 12, 15, 21, 22-24). En cambio, cuando se intentan diferenciar los tipos de ODR, los niveles de FAT se solapan, obteniéndose unos valores predictivos bajos (14, 21-22).
La Fosfatasa Alcalina Osea (FAO) es una glicoproteína tetramérica sintetizada por el osteoblasto que por acción de una fosfolipasa de membrana se transforma en dimérica, siendo así como se encuentra en sangre. Debido a su procedencia del hueso en formación se le atribuye una mayor sensibilidad y especificidad que a la FAT. Los dos métodos más utilizados para su detección son la electroforesis en gel de agarosa y el método inmunorradiométrico con doble anticuerpo monoclonal. Se ha descrito una excelente correlación entre los dos métodos (25). En un reciente estudio, la FAO medida por IRMA se correlacionó mejor con parámetros de formación y resorción óseos que la PTHi y la FAT. Valores de FAO mayores a 20ng/ml obtuvieron una sensibilidad y especificidad del 100% para alto remodelado con excelente correlación con la tasa de formación ósea (26).
Couttenye y cols. observaron que la FAO menor a 27 U/l presentaba una sensibilidad del 78% y especificidad del 86% para el diagnóstico de bajo remodelado (27).
En cambio, Hutchinson y cols. no consiguieron aumentar el poder discriminatorios de la PTHi cuando le añadían la FAO(16).
La Osteocalcina (OC) es la proteína no colágena más representativa del hueso y ha sido ampliamente estudiada en la última década. Es producida exclusivamente por osteoblastos y odontoblastos para ser incorporada a la matriz ósea (12). Como marcadores óseos presenta una serie de inconvenientes como acumularse en la insuficiencia renal, estar sometidos sus niveles al ritmo circadiano y estar estimulada su producción por el calcitriol.
En los diferentes estudios realizados sobre las correlaciones de la OC y los diferentes parámetros histomorfométricos hay disparidad de resultados. Unos han obtenido buenas correlaciones con parámetros tanto de formación como de resorción, incluso siendo capaz de diferenciar los altos de los bajos remodelados (15, 28, 29). Para otros, en cambio, los resultados fueron inferiores a la hora de diferenciar los grupos de ODR (18). Los resultados han mejorado con nuevos radioinmunoensayos que miden la OC intacta y no los fragmentos(30).
Péptidos terminales del procolágeno tipo I. Durante el procesamiento extracelular del procolágeno tipo I se produce una rotura de los péptidos terminales de las regiones aminoterminal (PINP) y carboxiterminal (PICP) antes de que se forme la fibra de colágeno. Estos péptidos pueden ser utilizados como marcadores de formación ósea (31). Hay pocos trabajos sobre estos marcadores en los pacientes en hemodiálisis y apuntan diferentes resultados. El PICP se correlacionó bien con otros marcadores de formación (FAT y OC) y con la tasa de formación ósea, pero estas correlaciones se perdían cuando existía enfermedad por Al (24). Por lo general tiene poca relevancia como parámetro no invasivo en la ODR (21).
La piridinolina (Pyr) y deoxipiridinolina (Dpyr) son los dos puentes de piridinolina no reducibles presentes en la forma madura de colágeno (31). La concentración de Pyr y Dpyr en fluidos biológicos se consideran procedentes en su mayor parte del hueso, aunque la Pyr se encuentra también en cartílago. Tanto una como otra se pueden medir en forma libre o unida a péptidos.
Hay pocos estudios en pacientes con insuficiencia renal, pero coinciden en que la Dpyr presenta buenas correlaciones con la PTHi, OC, FAT y parámetros de resorción ósea (32-34).
El telopéptido sérico carboxiterminal del colágeno tipo I (ICTP) es producido junto con otros péptidos cuando las fibras de colágeno sufren resorción. Es de pequeño tamaño, se filtra libremente por el glomérulo, pudiendo ser determinado en suero. En un estudio reciente se observaron buenas correlaciones con parámetros bioquímicos e histológicos tanto de formación como de resorción (21), pero , en general, es poco utilizado y considerado de escasa sensibilidad (32).
La fosfatasa ácida resistente a tartrato (TRAP) es un parámetro utilizado para valorar la resorción ósea y se han obtenido buenas correlaciones con PTHi y FAT. Pero la falta de especificidad de la actividad de la TRAP plasmática por los osteoclastos, su inestabilidad en muestras congeladas y la presencia de enzimas inhibidores en suero limitan su utilidad (31). Con la creación de nuevos inmunoensayos utilizando anticuerpos especificamente dirigidos hacia este isoenzima se deben mejorar los resultados (31, 32).
5. Diagnóstico de la enfermedad por Al.
Se considera enfermedad ósea relacionada con el Al (EORA) cuando se detecta en la biopsia ósea tinción positiva para el Al recubriendo más de un 15-25% de la superficie trabecular(Fig. 6) y la tasa de remodelado óseo está francamente reducida (35-36).
La utilización de los valores de Al sérico como reflejo de la EORA encuentra muchas dificultades de interpretación. Cuando cuantificamos la aluminemia basal, y tras estar seguros de no incurrir en errores de contaminación, estamos midiendo el Al distribuido en un 3-5% del peso corporal. La extrapolación de esta cuantificación al valor de los depósitos tisulares de Al debe hacerse con precaución, dado que la mayoría de los estudios muestran una pobre correlación entre el Al basal y la concentración de éste en hueso y otros tejidos (37,38). A pesar de ello, si tenemos controladas las dos fuentes fundamentales de intoxicación alumínica (quelantes con Al y agua de hemodiálisis), una cifras permanentemente elevadas de aluminemia nos darán una información importante de la sobrecarga corporal de Al (39). El problema que se plantea es el de decidir a partir de qué nivel plasmático consideramos sobrecarga tisular de Al. El nivel recomendado por la CE en su resolución de 1986 fue de 60m g/l (40), a partir del cual, la sobrecarga sería probable, aunque no estaría invariablemente presente.
A medida que se han ido controlando las fuentes de exposición al Al, el nivel crítico de aluminemia a partir del cual se considera sobrecarga ha ido modificándose por otros autores hasta 30 e incluso 20m g/l (35-41).
Dadas las limitaciones diagnósticas de la aluminemia basal, algunos autores observaron que la infusión de DFO ( test de la deferoxamina) diagnosticaba mejor la sobrecarga tisular de Al (42-44). Desde que se realizaron los primeros test, no ha existido unanimidad en cuanto a las formas de realización e interpretación.
D’Haese y cols. estudiaron el valor diagnóstico del test de la DFO positivo (incremento de Al mayor a 50m g/l tras la administración de 5mg/kg de peso de DFO). Cuando coincidía con una PTHi mayor a 650pg/ml no se desarrollaba EORA; en cambio, cuando la PTHi era menor de 650pg/ml se observaba un déficit en la mineralización. El riesgo más importante de intoxicación alumínica fue cuando la PTHi era menor de 150pg/ml (35).
Es decir, unos niveles altos de aluminio o un test de DFO positivo nos indican sobrecarga tisular de aluminio, pero nunca nos dará certeza de su localización en el hueso. Debido a ello se tendrán que combinar con los marcadores del remodelado óseo para valorar, en lo posible, su influencia sobre el déficit en la mineralización.
6. Nuestra experiencia con la biopsia ósea.
En el transcurso de varios años hemos realizado estudio histomorfométrico a unas 100 biopsias óseas donde hemos encontrado un predominio de los altos remodelados: 10% de enfermedad leve, 50% de OF, 6% de EM, 29% de EOA y solamente 2 casos de OM (45).
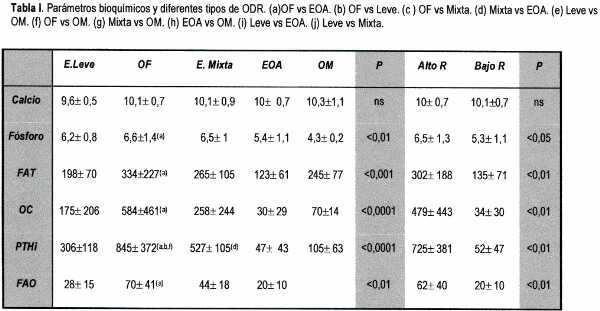
Observamos como las medias de PTHi, FAT, FAO y OC fueron diferentes en los distintos grupos histológicos pero el solapamiento entre los grupos fue alto (Tabla I).
Las correlaciones obtenidas entre los marcadores bioquímicos y los paramétros histomorfométricos fueron buenos, destacando la PTHi, aunque seguida muy de cerca por la OC, FAO y FAT (Tabla II).
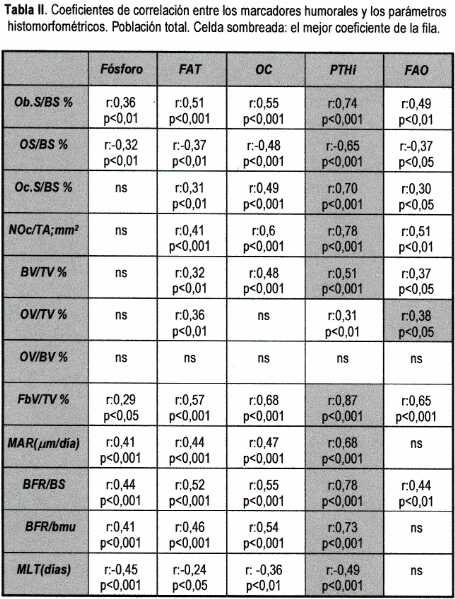
Para valorar la capacidad diagnóstica de estos marcadores dividimos a la población en alto y bajo remodelados y realizamos diferentes puntos de corte para cada marcador mediante curvas ROC (Figs. 7 y 8).
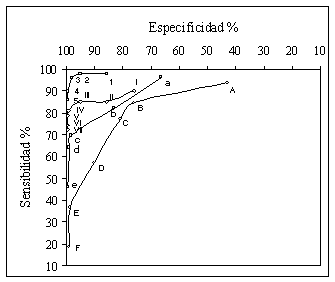
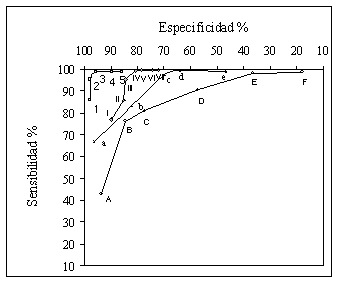
La PTHi destacó como el mejor marcador seguida de la OC, FAO y FAT.
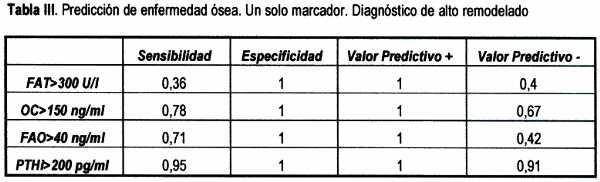
Cuando se observaron los marcadores de una manera individualizada para el diagnóstico de alto remodelado se pudo conseguir una especificidad del 100% pero con unas sensibilidades que variaban desde el 36% con la FAT hasta el 95% con la PTHi (Tabla III)
Igualmente cuando intentamos diagnosticar el bajo remodelado bajando de manera llamativa los diferentes puntos de corte, se consiguieron altas especificidades con sensibilidades variables (Tabla IV).
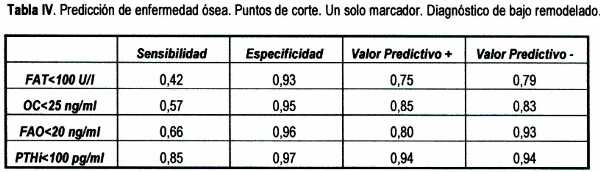
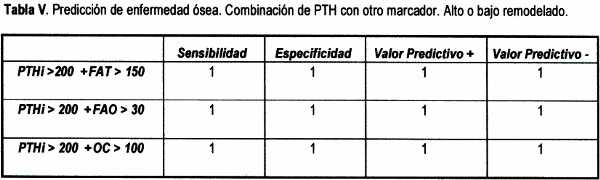
Cuando añadimos al mejor punto de corte discriminatorio de la PTHi, el mejor punto de corte de cualquier otro marcador, fuimos capaces de diferenciar el alto del bajo remodelado con unos valores predictivos positivos y negativos de 1 (Tabla V).
Cuando realizamos tinción para Al (ácido aurín tricarboxílico-Aluminón), pudimos observar que estaba presente en todos los grupos histológicos aunque en unos porcentajes muy variables (46). El 8% de las OF presentaron tinción positiva para el Al, mientras que la EM y OM lo presentaron en un 80 y 100% respectivamente. Un 26% de los pacientes con EOA presentaron tinción positiva para el aluminio, lo que nos lleva a pensar que éste no juega un papel fundamental ni imprescindible en el desarrollo de la enfermedad.
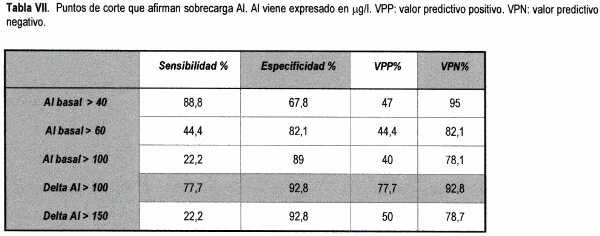
Cuando realizamos aluminemia basal y test de la DFO con 40mg/kg de peso observamos que era mucho más fácil descartar que afirmar sobrecarga tisular de aluminio (Tablas VI, VII).
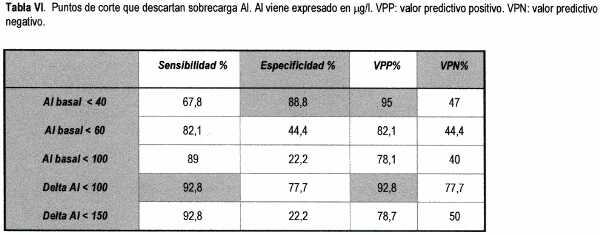
Generalmente con Al basal menor de 40m g/l se descartan tanto sobrecarga tisular de aluminio como EORA. En cambio, no fue posible diagnosticar con certeza la sobrecarga ni la EORA ni con el aluminio basal ni con el test de la DFO (Tabla VIII).
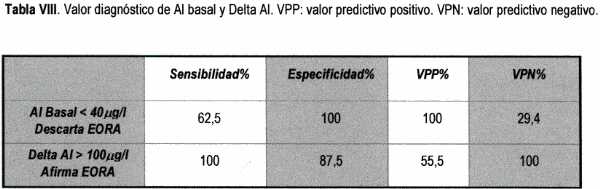
Cuando tuvimos en cuenta el remodelado óseo mediante la PTHi (mejor punto de corte discriminatorio de PTHi 200pg/ml) y le añadimos el delta Al fuimos capaces de diagnosticar la EORA a todos nuestros pacientes (Tabla IX). Es decir, todos los pacientes con PTHi menor de 200pg/ml y delta Al mayor de 100m g/l presentaron EORA.

7. Indicaciones de la biopsia ósea.
Al nefrólogo desde el punto de vista práctico le interesa saber cuando debe tomar una posición activa sobre todo en los pacientes sintomáticos ( dolores óseos, hipercalcemia, mala respuesta a tratamiento habitual …). Esto suele reducirse a tres actitudes fundamentales:
Evidentemente se puede pensar que todo paciente que presenta unas cifras elevadas de PTHi de forma mantenida en el tiempo, difícilmente tendrá una EORA. Pero no debemos olvidar que pacientes con cifras de PTHi elevadas (500-650pg/ml), que generalmente presentan un remodelado elevado, pueden tener importantes depósitos de Al en el frente de mineralización en el contexto de una enfermedad mixta. Estos deberían ser tratados con DFO, en caso de estar sintomáticos, con objeto de disminuir la sobrecarga de aluminio ante la posibilidad de una posterior paratiroidectomía. Según nuestra experiencia, cifras de PTHi superiores a 650-700 pg/ml, aunque pueden tener sobrecarga de Al en el hueso, éste suele estar localizado fuera del frente de mineralización y por consiguiente sin afectar a la misma.
El esquema de seguimiento podría ser el siguiente:
Cuando la PTHi es menor a 200pg/ml y el Al basal mayor a 40m g/l se debería realizar el test de la DFO. Si éste fuese positivo (delta Al mayor de 100m g/l) se debería tratar como EORA y posteriormente comprobar si han descendido los niveles con la aluminemia basal o un nuevo test. En caso de no concordancia en resultados se debería realizar biopsia ósea.
Cuando la PTHi sea mayor de 200pg/ml y el Al basal menor de 40m g/l, descartamos casi con toda seguridad EORA y debemos hacer control del hiperparatiroidismo secundario bien médico o quirúrgico. En este grupo se debe tener sumo cuidado y asegurarnos que esas cifras mantenidas de PTHi son con niveles de calcio en sangre normales (no con hipocalcemia) y que el aluminio basal sea menor de 40m g/l de manera mantenida y no estemos sometiendo al paciente a sobrecarga alguna de aluminio.
Cuando la PTHi es mayor a 200pg/ml y el Al basal mayor de 40m g/l, debemos realizar el test de la DFO. Si fuese positivo, lo ideal sería realizar biopsia ósea para descartar depósitos de Al en el frente de mineralización. Si no fuese posible se debería tratar con DFO y posteriormente valorar si han descendido las cifras de aluminemia para tratar el hiperparatiroidismo secundario.
Al igual que hemos avanzado mucho con los marcadores bioquímicos en el manejo de la ODR, también debemos conocer sus limitaciones y pérdida de capacidad discriminante en determinados casos. Generalmente suelen ser pacientes con tendencia a la hipercalcémia, sintomáticos y en rangos medios de PTHi. Ante estos casos creemos que la biopsia ósea juega un papel fundamental para el exacto diagnóstico y acertado tratamiento.
BIBLIOGRAFÍA.
1.- Cannata JB, Gómez Alonso C, Grosso S, Altadill A, Diaz López JB. Osteodistrofia Renal, clasificación y concepto actual. Nefrología 1995; 15 supl 1: 20-24.
2.- Serrano S, Mariñoso ML, Aubia J, Guañabens N. Valor de la biopsia transilíaca en el diagnóstico de la patología metabólica del hueso. Sandorama 1986; 1: 5-8.
3.- Teitelbaum SL. Renal osteodystrophy. Human Pathology 1984; 15: 303-323.
4.- Torres A. ¿ Es necesaria la biopsia ósea?. Nefrología 1992;12: 210-214.
5.- De Francisco ALM. ¿ Es necesaria la biopsia ósea?. Nefrología 1992; 12: 202-209.
6.- Serrano S, Mariñoso ML. Bases histológicas de la histomorfometría ósea. En Serrano S, Aubia J, Mariñoso ML (eds). Patología Osea Metabólica. Doyma. Barcelona, 1990: 55-69.
7.- Llach F. Osteodistrofia renal y diálisis de mantenimiento. En Llach F, Valderrábano F (eds). Insuficiencia renal crónica. Norma. Madrid, 1990: 203-245.
8.- Malluche H, Faugere MC. Renal bone disease 1990: an unmet challenge for the nephrologist. Kidney Int 1990; 38: 193-211.
9.- Malluche HH, Faugere MC. Bone biopsies: Histology and histomorphometry of bone. En Avioli LV y Krane SM (eds). Metabolic bone disease and clinically related disorders. WB Saunders Company. Philadelphia, 1990: 283-328.
10.- Velásquez F. Biopsia ósea metabólica en el diagnóstico de las osteodistrofias renales. En Llach F, Valderrabano F (eds). Insuficiencia Renal Crónica. Diálisis y Trasplante Renal. Norma. Madrid, 1997; 403-421.
11.- Grosso S, Fernández Martín JL, Gómez Alonso C, Barreto S, Díaz Corte C, Cannata JB. Prevención, diagnóstico y tratamiento de la intoxicación alumínica en España. Encuesta multicéntrica. Nefrología 1996; 16: 158-166.
12.- Coen G, Mazzaferro S. Bone metabolism and its assessment in renal failure. Nephron 1994; 67: 383-481.
13.-Hernández D, Concepción MT, Lorenzo V, Martínez ME, Rodríguez A, De Bonis E, González-Posada JM, Felsenfeld AJ, Rodríguez M, Torres A. Adynamic bone disease with aluminium staining in predialysis patients: prevalence and evolution after maintenance dialysis. Nephrol Dial Transplant 1994; 9: 517-523.
14.- Torres A, Lorenzo V, Hernández D, Rodríguez JC, Concepción MT, Rodríguez AP, Hernández A, De Bonis E, Darias E, González-Posada JM, Losada M, Rufino M, Felsenfeld AJ, Rodríguez M. Bone disease in predialysis, hemodialysis, and CAPD patients: Evidence of a better bone response to PTH. Kidney Int 1995; 47: 1434-1442.
15.- Mazzaferro S, Coen G, Ballanti P, Bondatti F, Bonucci E, Pasquali M, Sardella D, Tomei E, Taggi F. Osteocalcin, iPTH, alkaline phosphatase and hand X-Ray score as predictive indices of histomorphometric parameters in renal osteodystrophy. Nephron 1990 ; 56: 261-266.
16.- Hutchinson AJ, Whitehouse RW, Boulton HF, Adams JE, Mawer EB, Freemont TJ, Gokal R. Correlation of bone histology with parathyroid hormone, vitamin D3, and radiology in end-stage renal disease. Kidney Int 1993; 44: 1071-1077.
17.- Felsenfeld AJ. The diagnosis of secondary hiperparathyroidism. Nefrología 1993; 13 supl 3: 11-14.
18.- Cohen Solal ME, Sebert JL, Boudailliez BB, Marie A, Moriniere P, Gueris J, Bouillon R, Fournier A. Comparison of intact, midregion, and carboxy terminal assays of parathyroid hormone for the diagnosis of bone disease in hemodialyzed patients. J Clin Endocrinol Metab 1991;73: 516-524.
19.- Quarles LD, Lobaugh B, Murphy G. Intact parathyroid hormone overestimates the presence and severity of parathyroid-mediated osseous abnormalities in uremia. J Clin Endocrinol Metab 1992; 75: 145-150.
20.- Joffe P, Heaf JG, Hyldstrup. Osteocalcin: a non-invasive index of metabolic bone disesase in patients treated by CAPD. Kidney Int 1994; 46: 838-846.
21- Mazzaferro S, Pasquali M, Ballanti P, Bonucci S, Costantini S, Chicca S, De Meo S, Perruzza I, Sardella D, Taggi F, Coen G. Diagnostic value of serum peptides of collagen synthesis and degradation in dialysis renal osteodystrophy. Nephrol Dial Transplant 1995; 10: 52-58.
22.- Gerakis A, Hutchinson AJ, Apostolou TH, Freemont AJ, Billis A. Biochemical markers for non invasive diagnosis of hyperparathyroid bone disease and adynamic bone in patients on haemodialysis. Nephrol Dial Transplant 1996; 11: 2430-2438.
23.- Coen G, Ballanti P, Bonucci E, Calabria S, Centorino M et al. Bone markers in the diagnosis of low turnover osteodystrophy in haemodyalisis patients. Nephrol Dial Transplant 1998; 13: 2294-2302.
24.- Hamdy NAT, Risteli J, Risteli L, Harris S, Beneton MNC, Brown CB, Kanis JA. Serum type I procollagen peptide: a non- invasive index of bone formation in patients on haemodialysis? Nephrol Dial Transplant 1994; 9: 511-516.
25.- Van Hoof VO, Martin M, Blockx P. Immunoradiometric method and electrophoretic system compared for quantifying bone alkaline phosphatase in serum. Clin Chem 1995; 41: 853-857.
26. Ureña P, Hruby M, Ferreira A, Ang KS, de Vernejoul MC. Plasma total versus bone alkaline phosphatase as marker of bone turnover in hemodialysis patients. J Am Soc Nephrol 1996;7: 1-7
27.- Couttenye MM, D’ Haese PC, Van Hoof VO, Lemoniatou E, Goodman W, Verpooten GA, De Broe ME. Low serum levels of alkaline phosphatase of bone origin: a good marker of adynamic bone disease in haemodialysis patients. Nephrol Dial Transplant 1996; 11: 1065-1072.
28.- Malluche HH, Faugere MC, Fanti P, Price PA. Plasma levels of bone GLA-protein reflect bone formation in patients on chronic maintenance dialysis. Kidney Int 1984; 26: 869-874.
29.- Charon SA, Delmas PD, Malaval L, Chavassieux PM, Arlot M, Chapuy MC, Meunier PJ. Serum bone GLA-protein in renal osteodystrophy: Comparison with bone histomorphometry. J Clin Endocrinol Metab 1986; 63: 892-897.
30.- Garnero P, Grimaux M, Demiaux P, Preaudat C, Seguin P, Delmas PD. Measurement of serum osteocalcin with a human-specific two-site inmunoradiometric assay. J Bone Mineral Res 1992; 12: 1389-1398.
31.- Garnero P, Delmas PD. Marcadores bioquímicos del remodelado óseo. REEMO 1996; 5: 171-175.
32.- Schmidt-Gayk, Drueke T, Ritz E. Non-invasive circulating indicators of bone metabolism in uraemic patients: can they replace bone biopsy? Nephol Dial Transplant 1996; 11: 415-418.
33.- Ureña P, Ferreira A, Kung VT. Serum pyridinoline as a specific marquer of colagen breakdown and bone metabolism in hemodialysis pateints. J Bone Miner Res 1995; 10: 932-939.
34.- Niwa T, Shiobara K, Hamada T. Serum pyridinolines as specific markers of bone resorption in heamodialyzed patients. Clin Chim Acta 1995; 235: 33-40.
35.- D’Haese PC, Couttenye MM, Goodman WG, Lemoniatou E, Digenis P, Sotornik I, Fagalde A, Barsoum RS, Lamberts LV, De Broe ME. Use of the low-dose deferrioxamine test to diagnose and differentiate between patients with aluminium-related bone disease, increased risk for aluminium toxicity, or aluminium overload. Nephrol Dial Transplant 1995; 10: 1874-1884.
36.- D’Haese PC, De Broe ME. Aluminum toxicity. En Daugirdas T y Ing TS (eds). Handbook of Dialysis. Little, Brown and C. Boston, 1994: 522-536.
37.- Frazao JM, Coburn JW. Toxicidad del aluminio. En Llach F y Valderrábano F (eds). Insuficiencia Renal Crónica. Diálisis y Trasplante Renal. Norma. Madrid, 1997: 375-402.
38.- Mazzuchi N, Cannata JB. Prevención, diagnóstico y tratamiento de la intoxicación alumínica. Revisión y perspectivas. Nefrología 1989; 9: 15-19.
39.- Cannata JB. Utilidad de la Deferroxamina en el diagnóstico y en el tratamiento de la intoxicación alumínica. Nefrología 1992; 12: 295-301.
40.- Resolution of the Council and the representatives of the Members States, meeting with the Council, of 16th june 1986 , concerning the protection of dialysis patients by minimizing the exposure to aluminium. Off J Eur Comm 1986; C184: 16-18.
41.- Cannata JB. Hypokinetic azotemic osteodystrophy. Kidney Int 1998; 54: 1000-1016.
42.- Nebeker H, Andress D, Milliner D, Ott S, Alfrey A, Slatopolsky E, Sherrard D, Coburn J. Indirect methods for the diagnosis of aluminium bone disease: Plasma aluminium , the desferrioxamine infusion test , and serum iPTH. Kidney Int 1986; 29 supl 18: 96-99.
43.- Coburn JW, Norris KC, Nebeker HG. Osteomalacia and bone disease. Arising from aluminium. Seminars in Nephrology 1986; 6: 68-89.
44.- Slatopolsky E. The interaction of parathyroid hormone and aluminium in renal osteodystrophy. Kidney Int 1987; 31: 842-854.
45.- Jarava C, Armas JR, Palma A. Estudio de la osteodistrofia renal mediante biopsia ósea. La edad como factor independiente. Utilidad diagnóstica de los marcadores del remodelado óseo. Nefrología 2000; 20: 362-371.
46.- Jarava C, Armas JR, Palma A. Aluminio y enfermedad ósea urémica. Utilidad diagnóstica del aluminio sérico y del test de la deferoxamina (DFO). Nefrología 2001; 21: 174- 181.