
Dieguez Stella Maris MD
| DISCUSSION BOARD |
La presencia de albuminuria ha sido reconocida como un signo adverso en el pronóstico de la enfermedad renal .
Por muchos años solo fue un marcador de la severidad de la enfermedad y se consideró que la albúmina era una molécula con características para ejercer la presión oncótica y actuar como carrier en la circulación.
Un hallazgo universal en las progresión de la enfermedad glomerular es la presencia de proteinuria. La hipótesis que el grado de proteinuria se correlaciona con la progresión de la enfermedad ayuda a la idea de que es un elemento independiente en el desarrollo de la nefropatía y no un simple marcador de la enfermedad renal.
Más recientemente se sugirió que podría influenciar a las células que contacta y actuar como señal para iniciar procesos moleculares.
Se ha visto que los pacientes que tienen mayor albuminuria desarrollan cicatrices tubulointersticiales y progresan a la insuficiencia renal crónica (1).
Aunque la albúmina normalmente tiene acción antioxidante en el túbulo, cuando su concentración aumenta, los daños que produce en las células expuestas son graves por ejemplo: en la célula del túbulo proximal (CTP), la albúmina estimula la cascada PI3 kinasa y pp77 con lo que se incrementa la mitosis(2;3;4).
Su función es mantener la homeostasis del sitio, pero su aumento alteraría el mecanismo de homeotasis y provocaría daño intersticial.
In vitro las CTP expuestas a la albúmina estimulan la síntesis de ET-1 , éste incrementa el tono de la arteriola aferente y eferente, reduciendo el flujo en el capilar peritubular causando isquemia, fibrosis y estimulando la activación de macrófagos, la proliferación de fibroblastos y el depósito de matriz .
Independiente del ET-1 estimula la salida de MCP-1(proteína quimioatrayente de monocitos) y RANTES (reguladores de la actividad normal, expresión y secreción de las celulas T). Esta salida de citoquinas inducida por albúmina, expresa genes relevantes para el desarrollo de inflamación y cicatriz.
En vivo, se observó marcada apoptosis y proliferación pues la albúmina cargada de lípidos actúa como intermediario en la señalización inflamatoria.
Cuando la albúmina tiene distorsión oxidativa lleva lípidos oxidados y productos avanzados y finales de la glicolisación (grupos AGE). Los receptores AGE abren la puerta para el daño celular.
En el siguiente cuadro se observa la respuesta de las células a la sobrecarga de albúmina
CUADRO I

DETECCION DE NEFROPATIA POR EL USO DE LA MICROALBUMINURIA
La albúmina puede ser medida en la orina aún cuando se encuentre en pequeñas cantidades permitiendo al nefrológo diagnosticar en forma temprana la presencia de daño renal. Viberti(5), acuñó el término "microalbuminuria" para indicar incremento de la excreción urinaria de albúmina en pacientes con proteína urinaria normal.
En 1982, Viberti y col.(5) observaron que en pacientes con diabetes insulino-dependiente (DDID), aquellos que tuvieron albuminuria de 30 a 140 micrg/min medida por radioinmunoensayo durante la noche, subsecuentemente desarrollaban proteinuria clínica. En contraste, pacientes con menos de 30 microg/min no desarrollaban proteinuria.
Sin embargo, algunos investigadores han usado otros puntos de corte(6) para indicar el límite de normalidad. No importa cuál es la definición lo importante es que la microalbuminuria parece ser un importante factor de riesgo de daño renal en el paciente con diabetes(7;8).
Con el tiempo este concepto se extendió a otras patologías como la glomerulonefritis post- infecciosa, la hipertensión esencial y otras glomerulopatías (9;10;11;12;13;14).
En nuestro país la nefropatia diabética y el Síndrome urémico hemolítico (SUH) representan unas de las glomerulopatías que más nos inquietan por su evolutividad solapada. Dado que luego de varios años de comenzada la enfermedad y sin presentar alteraciones de laboratorio ni clínicas evidentes pueden ir a la insuficiencia renal.
MICROALBUMINURIA EN ETAPAS TEMPRANAS DE LA NEFROPATIA DIABETICA
Con respecto a la nefropatía diabética algunos pacientes (38%) experimentan albuminurias transitorias sin desarrollar luego nefropatía Esto puede encontrarse en casos con infección urinaria o mal control metabólico.
En los tempranos estadios de la nefropoatía diabética con el ejercicio puede provocarse un aumento de la excreción de microalbuminuria (15).
Nosotros estudiamos 5 niños controles y 8 pacientes con media de edad 9 años y con un tiempo de evolución de la enfermedad de 3 años, que tenían filtrado glomerular normal, sin proteinuria y con tensión arterial normal. Los expusimos a un esfuerzo continuo de 600 kgm/min y determinamos la microalbuminuria (MA) basal, a los 5, 20, 40 y 60 minutos postprueba de esfuerzo.
En el siguiente gráfico vemos que a pesar de tener valores semejantes a los controles en el comienzo de la prueba, los niños con DDID a los 20 minutos presentaron un incremento significativamente mayor.
GRAFICO 1
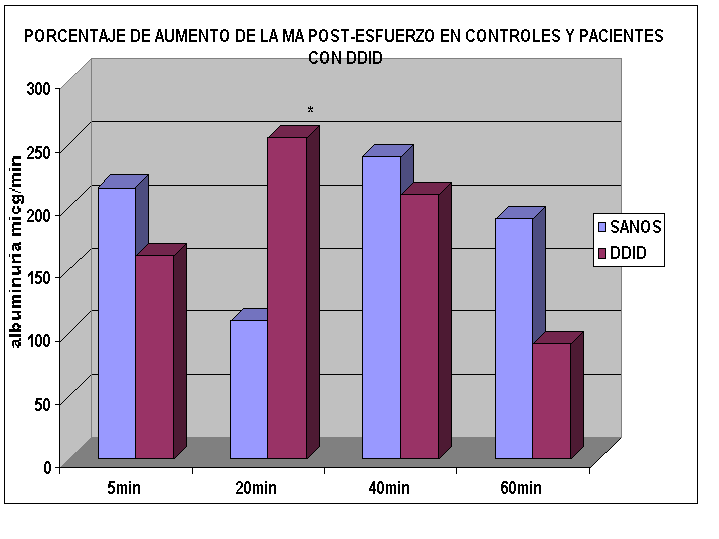
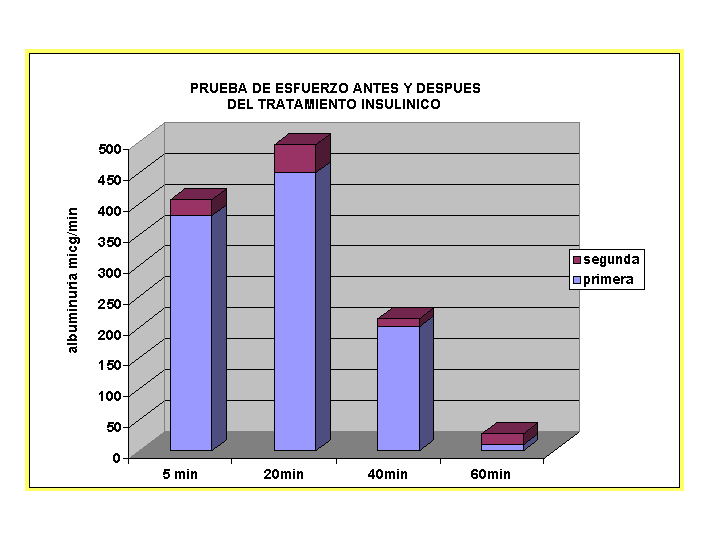
GRAFICO 2
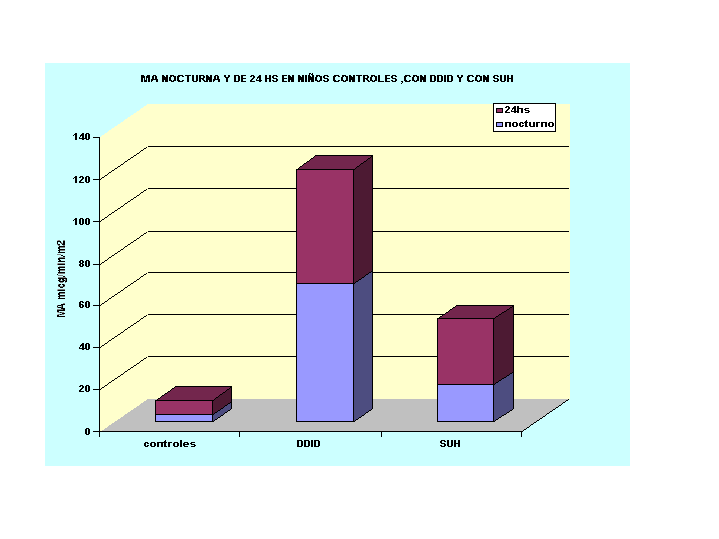
MICROALBUMINURIA DE 24 HS VERSUS MICROALBUMINURIA NOCTURNA EN PACIENTES CON DDID Y EN SUH
La MA está relacionada al daño vascular generalizado. La medición medición varía de día a día hasta en 30-50%.
La excreción de MA en nuestros niños controles tuvo una media de 4,3µg/min/m2 consideramos 15 µg/min/m2 el máximo aceptable de normalidad, pues representa la media más 3 DS.
Dadas las dificultades para la recolección, la influencia de la actividad y la carga de proteínas de las dietas (16) sobre la excrecion de MA, realizamos la determinación de la albúmina partida durante el dia y la noche - en niños controles , en pacientes con DDID y en niños con antecedente de síndrome urémico hemolitico (SUH)- La excreción urinaria de MA se midió en orinas, recolectadas desde la mañana hasta 4 horas después de la cena, se la consireró excreción diurna. A partir de esa hora hasta la primera orina matutina la denominamos excreción nocturna . A ambas las relacionamos con la excreción de las 24 horas.
La correlación entre MA de 24hs vs. MA nocturna fue altamente significativa para los controles 0.81 p<0.01 y para los niños con DDID r= 0.895 p<0.01
Mientras que en los pacientes con SUH no hubo correlación r = 0.23 p >0.05
Los niños normales y los niños con SUH disminuyeron la MA durante la noche; pero no alcanzaron diferencias significativas. Ver Tabla 1
TABLA 1
| Media-DS diurna | Media-DS nocturna | significación | |
| controles | 4.5 ± 2.4 | 3.1± 2.8 | NS |
| SUH | 24 ± 22 | 17 ±10 | NS |
| DDID | 31 ± 20 | 45 ±22 | NS |
Grafico 3
RELACION EXCRECION DE MA NOCTURNA VS. MA DE 24HORAS
El aporte nocturno de la MA a la excreción de 24hs fue mayor en DDID, esta situación podría deberse a recolecciones incompletas, variaciones hemodinámicas o metabólicas durante la recolección de orina.
En cambio en los pacientes con SUH el porcentaje de excreción nocturna de MA se comporta como los niños controles, a pesar que la excreción minutada nocturna fue significativamente mayor.
El empleo de la excreción nocturna de MA serviría como método práctico y de fácil recolección de la orina con menores variaciones dadas por el efecto de la actividad diurna.
SOBRECARGA AGUDA DE AGUA Y MICROALBUMINURIA EN PACIENTES CON SUH
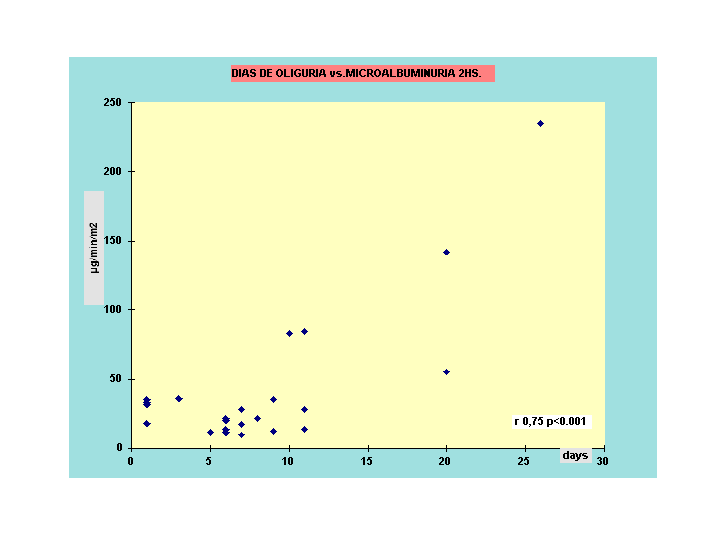
Otra forma de estimular la excreción de microalbulminuria es a través de una carga de agua 20 ml/kg a tomar en 20 minutos (17) y medir la MA en la orina recolectada en las dos horas posteriores. Nosotros en niños controles obtuvimos una media de 14 µg/min/m2 para MA de 2hs y consideramos como punto de corte 38 µg/min/m2 ,valor que representa la media más 3 DS.
En pacientes con antecedente de SUH la MA 2hs tuvo una mejor correlación que la MA de 24hs, cuando las relacionamos con los días de oligoanuria (como vemos en el gráfico siguiente). Los días de oligoanuria están en relación directa con la pérdida nefronal y la evolutividad de la enfermedad.
En el seguimiento alejado de nuestros pacientes la MA 2hs sirvió como predictor de la aparición de proteinuria y pérdida de la reserva funcional renal -Datos aún no publicados- .
Grafico 4
RELACION ENTRE VOLUMEN RENAL Y MICROALBUMINURIA EN PACIENTES CON DDID Y EN SUH
Frazer FL y col (18) relacionaron el volumen renal con el incremento de la microalbuminuria en pacientes diabéticos.
Nosotros estudiamos la relación entre los diámetros,- longitudinal anteroposterior y transverso -y el volumen renal con la microalbuminuria (gráfico siguiente) y con la Hb Glicosilada en niños con DDID y niños con SUH sin proteinuria
Mientras que el volumen renal y los diámetros fueron directamente proporcionales a la microalbuminuria (p < 0.01), éstos no se correlacionaron con la Hb glicosilada, en los pacientes con DDID (gráfico5). En los niños con SUH no hubo ninguna correlación.
Grafico 5
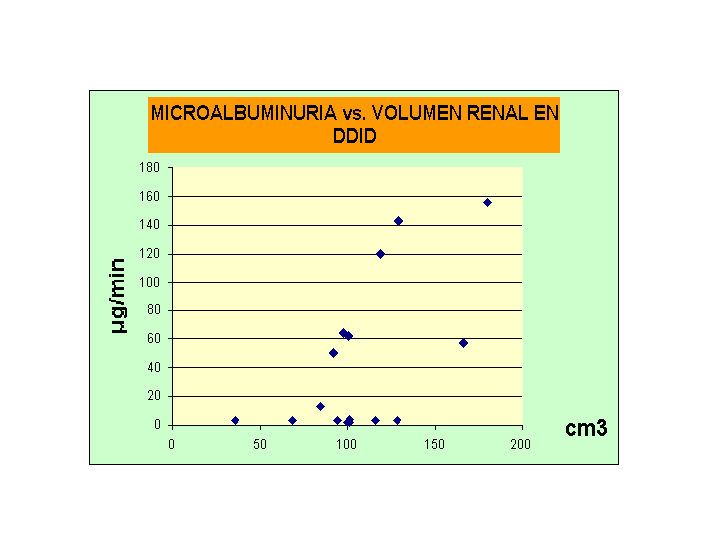
El aumento del volumen renal a expensas del diámetro longitudinal se observa en los primeros estadios de la nefropatía diabética. La disparidad de resultados entre las dos patologías evaluadas nos hablaría de dos mecanismos diferentes de progresión de la enfermedad renal, al menos en esta etapa. En una se debería a la pérdida de masa nefronal y en el otro los efectos del daño metabólico.
REPERCUSION DEL DESARROLLO PUBERAL SOBRE LA MICROALBUMINURIA EN PACIENTES CON SUH Y CON DDID
En pacientes adolescentes con DDID con edad mayor de 12 años Salardi S, y col (9,10,11) encontraron niveles de microalbuminuria mayor que la normal (24,5mg/24hs) y estos valores se correlacionaron con la secreción de HG y no con la duración de la enfermedad, la HbAc o el volumen renal.
La mayoría de los autores coinciden en que la pubertad está estrechamente relacionada con las complicaciones microvasculares en los sujetos diabéticos y el aceleramiento de la enfermedad renal.
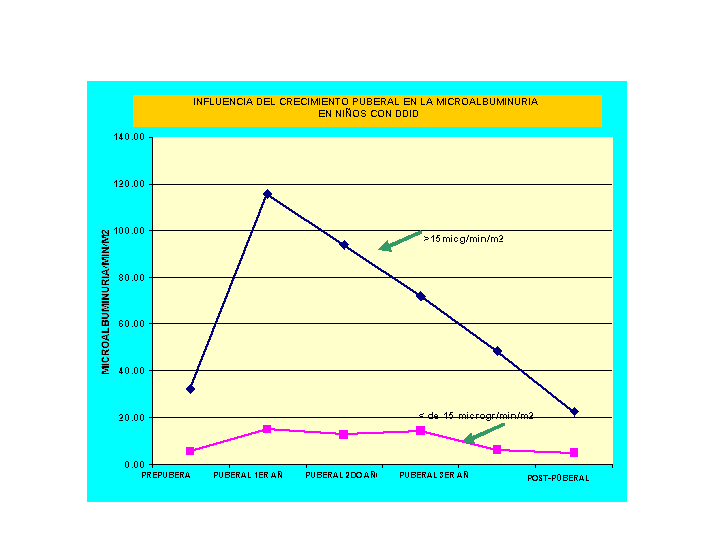
Seguimos la MA de 24hs en pacientes con DDID y con SUH desde el inicio de la pubertad hasta los 18 años con el objeto de evaluar la repercusión producida por el crecimiento puberal sobre la MA.
Los pacientes con DDID que iniciaban la pubertad con valores patológicos de MA, luego de un aumento transitorio, significativo, al terminar la pubertad regresaban a sus valores pre-puberales. Aquellos que partían de valores normales al inicio de la pubertad aumentaban discretamente la MA durante el desarrollo puberal. Como vemos en la gráfico siguiente.
Gráfico 6
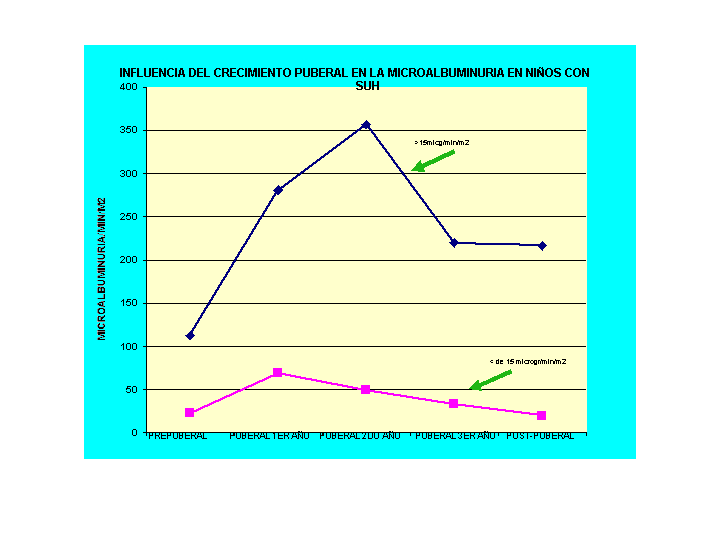
El comportamiento en los niños con SUH fue diferente. Cuando en la pubertad partían de valores patológicos de MA, con el desarrollo puberal también aumentaban significativamente, pero el descenso era hasta valores significativamente superiores a los de comienzo de la pubertad.
Cuando estos niños inician la pubertad con valores normales, con el empuje puberal, alcanzan valores significativamente más altos, pero luego recuperan los valores normales de MA al culminar el desarrollo puberal. Esta es una etapa crítica para estos pacientes en la que puede aparecer proteinuria e hipertensión, por ello deben controlarse hasta completar su desarrollo puberal. Esto se ve en el siguiente gráfico.
Gráfico 7
Dadas las consecuencias que aporta la albuminuria en la progresión de la enfermedad renal, para nosotros la presencia de MA patológica es un desafío para la búsqueda de estrategias renoprotectoras.
Si nos basamos en la evidencia, para los pacientes con DDID la mejor estrategia es el mejor control glucémico ,el control de la hipertensión arterial y el uso de inhibidores de la enzima de conversión (IECA) en dosis que se incrementan lentamente hasta alcanzar los niveles normales de albuminuria (23).
En el SUH nosotros proponemos el uso de dietas con aporte proteico normatizado adecuado a edad y sexo según la recomendación de la RDA y el uso de IECA en los pacientes en que se demuestra microalbuminuria por carga de agua, o presentan aumento progresivo anual de la misma, con el objeto de que lleguen a la pubertad con los menores valores de MA.
En el siguiente gráfico mostramos la respuesta a los IECA en pacientes con SUH que presentaban MA patológica (valores de inicio y luego de 10 años de seguimiento).
Gráfico 8
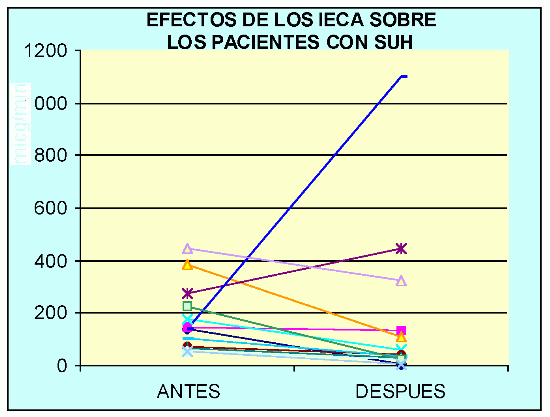
Podemos observar que dos pacientes aumentaron los valores de albuminuria a pesar del uso temprano de renoprotectores. El paciente con línea bordó presentó una hiperkalemia de 8mEq/l por lo que se suspendió el enalapril y luego de 3 meses se inició tratamiento con bloqueantes AT1, sin presentar hiperkalemia después de 2 años 6 meses de seguimiento.
Ambos pacientes tienen leve caída del FG (70 y 68 ml/min/1.73m2) desde hace 2 años y ya han completado el desarrollo puberal.
A diferencia de los pacientes con SUH los niños con DDID descendieron la microalbuminuria, no la normalizaron pero ninguno la aumento. Aún, no tenemos un seguimiento tan prolongado.
El beneficio del uso de los IECA se debe al rol de la AgII en la progresión de la enfermedad renal. En pacientes con DDID ya ha sido demostrado que disminuye la proteinuria y enlentece la pérdida de la función renal (24). Sin embargo en las nefropatías no diabéticas aunque algunos trabajos, (25) han demostrado éxito en la detención de la progresión, en pacientes como los que antes describimos, los IECA parecerían ser insuficientes.
CONCLUSION
La detección de elementos de evolutividad como la MA son fundamentales para el manejo de enfermedades como la DDID y el SUH donde pueden existir, en etapas tempranas, alteraciones no detectables por métodos habituales.
El uso precoz de dietas normoproteicas, hipolipemiantes en niños y de sustancias renoprotectores como los inhibidores de la ECA y los bloqueantes de AT1 podría enlentecer el camino hacia la insuficiencia renal terminal en niños. En algunas patologías pocas son las estrategias comprobadas, deberíamos encontrar otros tratamientos para los pacientes en los que la nefropatía a pesar de los IECA progresa a la insuficiencia renal terminal.
Colaboradoras: Dra Laura Maldonado, Dra. Sandra Ayuso y Dra. Viviana Osta
Agradecimiento: Al jefe del servicio de Nefrologia Dr Carlos Cánepa
BIBLIOGRAFIA:
1.- Brunskill NJ. Albumin and proximal tubular cells--beyond endocytosis. Nephrol Dial Transplant 2000 Nov;15(11):1732-4
2.- Dixon R, Brunskill NJ. Albumin stimulates p44/p42 extracellular-signal-regulated mitogen-activated protein kinase in opossum kidney proximal tubular cells. Clin Sci (Lond). 2000 Mar;98(3):295-301.
3.- Dixon RJ, Brunskill NJ. Lysophosphatidic acid-induced proliferation in opossum kidney proximal tubular cells: role of PI 3-kinase and ERK. Kidney Int. 1999 Dec;56(6):2064-75.
4.- Dixon R, Brunskill NJ. Activation of mitogenic pathways by albumin in kidney proximal tubule epithelial cells: implications for the pathophysiology of proteinuric states. J Am Soc Nephrol. 1999 Jul;10(7):1487-97.
5.- Viberti Gc, Jarret RJ, Mahumud U, et al:Microalbuminuria como un predictor de nefropatia clínica en diabetes mellitus insulino-dependientes. Lancet 1:1430 1982) (2000) 15:1732-1734
6.- Messent JWC, Elliott TG, Hill RD, et al: Prognostic significance of microalbuminuria in insulin-dependent diabetes mellitus: A twenty-three year follow-up study. Kidney Int 41:836, 1992.
7.- Morgense CE. Christensen CK. Predicting diabetic nephropathy in insulin-depdendent patients. N Engl J Med 311:89, 1984
8.- Mattock MB, Morrish NJ, Viberti G, et al: Prospective study of microalbuminuria as predictor of mortality in NIDDM. Diabetes 41:736, 1992.
9.- Kaplan NM: Microalbuminuria: A risk factor for vascular and renal complications of hypertension. Am J Med 92(4B):8S, 1992.
10.- Andrew V White, Wendy E Hoy and David A McCredie. Childhood post-streptococcal glomerulonephritis as a risk factor for chronic renal disease in later life Med J Aust 2001 May 21:174(10):492-6
11.- Pinto SW, Sesso R, Vasconcelos E, Watanabe YJ, Pansute AM. Follow-up of patients with epidemic poststreptococcal glomerulonephritis. Am J Kidney Dis. 2001 Aug;38(2):249-55.
12.- Halimi JM, al-Najjar A, Buchler M, Giraudeau B, Etienne I, Picou S, Marliere J, Nivet H, Lebranchu Y. Microalbuminuria in hypertensive, non-proteinuric renal transplant recipients: role of previous acute rejection episodes and sodium intake]. Arch Mal Coeur Vaiss. 2001 Aug;94(8):933-6. French.
13.- Shammas AG, Maayah JF. Hypertension and its relation to renal function 10 years after pregnancy complicated by pre-eclampsia and pregnancy induced hypertension. Saudi Med J. 2000 Feb;21(2):190-2.
14.- Grunfeld B, Perelstein E, Simsolo R, Gimenez M, Romero JC. Renal functional reserve and microalbuminuria in offspring of hypertensive parents. Hypertension. 1990 Mar;15(3):257-61.
15.- Vittinghus E Mogensen. Albumin excreation and renal hemodynamic response to physical exercise in normal and diabetic man. Scand. J Clin LabInvest. 1981:41-627-632
16.- Stribrna J, Ruzicka M, Englis M, Peregrin J, Lanska V. Albuminuria after acute oral administration of proteins in patients with renovascular hypertension. Cas Lek Cesk. 1993 Feb 5;132(2):50-2.
17.- Viberti GC, Mogensen CE, Keen H, Jacobsen FK, Jarrett RJ, Christensen. Urinary excretion of albumin in normal man: the effect of water loading. Scand J Clin Lab Invest. 1982 Apr;42(2):147-57.
18.- Frazer FL, Palmer LJ, Clarey A, Thonell S, Byrne GC. Relationship between renal volume and increased albumin excretion rates in children and adolescents with type 1 diabetes mellitus.
19.- Christiansen JS, Gammelgaard J, Frandsen M, Parving H-H: Increased kidney size, glomerular filtration rate and renal plasma flow in short-term insulin-dependent diabetics. Diabetologia 20:451, 1981.
20.- Salardi S, Cacciari E, Pascucci MG, Giambiasi E, Tacconi M, Tazzari R, et al. Microalbuminuria in diabetic children and adolescents. Relationship with puberty and growth hormone. Acta Paediatr Scand 1990;79:437-43.
21.- Holl RW, Grabert M, Thon A, Heinze E. Urinary excretion of albumin in adolescents with type 1 diabetes: persistent versus intermittent microalbuminuria and relationship to duration of diabetes, sex, and metabolic control. Diabetes Care 1999 Sep;22(9):1555-60
22- Bangstad HJ, Osterby R, Dahl-Jorgensen K, Berg KJ, Hartmann A, Nyberg G et al. Early glomerulopathy is present in young, type I (insulin-dependent) diabetic patients with microalbumi nuria. Diabetología 1993;36:523-9.
23- Lee A. Hebert, Wilmer,W Falkenhain M et al. Renoprotection: One or many therapies?. Kid.Int Vol59 (2001) pp1211-1226
24.- Maschio G, Alberti D, Janin G, Locatelli F, Mann Jfe, Motolese M, Ponticelli C, Ritz E, Zucchelli P. Effect of the angiotensin-converting-enzyme inhibitor benazepril on the progression of chronic renal insufficiency: The Angiotensin-Converting-Enzyme Inhibition in Progressive Renal Insufficiency Study Group. N Engl J Med 1996, 334:939-945.
25.- Ruggenenti P, Gaspari F, Perna A, Remuzzi G. Cross sectional longitudinal study of spot morning urine protein:creatinine ratio, 24 hour urine protein excretion rate, glomerular filtration rate, and end stage renal failure in chronic renal disease in patients without diabetes. BMJ 1998, 316:504-509.