
Carolina Frías, Ricardo Lauzurica.
| DISCUSSION BOARD |
La infección por el virus de Epstein-Barr (VEB) en pacientes trasplantados se ha asociado al desarrollo de síndromes linfoproliferativos post-trasplante (SLPPT) que tienen en general un mal pronóstico. Como factores implicados en el desarrollo de los SLPPT se han descrito: el tipo de órgano trasplantado, el tipo, duración e intensidad de la inmunosupresión, la edad del receptor y la seronegatividad frente al VEB previa al trasplante, el tratamiento con sueros antilinfocitarios mono o policlonales tanto en inducción como en el tratamiento del rechazo agudo, y el mismatch para el citomegalovirus entre el donante y el receptor.
En el tratamiento de los SLPPT se han empleado: disminución ó descontinuación de la inmunosupresión, antivirales (aciclovir, ganciclovir), γ-IFN, anticuerpos monoclonales anti CD-21, anti CD-24 y otros, cirugνa y quimioterapia. El pronóstico de los pacientes con SLPPT puede mejorar con un tratamiento precoz, lo que hace esencial un diagnóstico rápido del proceso.
Las técnicas serológicas tienen una discreta utilidad diagnóstica debido a que los pacientes trasplantados presentan una respuesta serológica deficiente. La técnica de la reacción en cadena de la polimerasa (PCR) se ha utilizado para detectar y cuantificar el VEB en muestras clínicas. Se ha observado una asociación entre valores elevados de carga viral del VEB en muestras de sangre y los SLPPT, aunque su valor como marcador precoz del desarrollo de los SLPPT y en la monitorización de la eficacia del tratamiento de los mismos está todavía por precisar. Se ha propuesto que la determinación de la carga viral del VEB en pacientes trasplantados adultos tiene valor clínico en: el diagnóstico precoz, posibilitando una terapia precoz, en la monitorización de la eficacia del tratamiento de los SLPPT y en el diagnóstico diferencial de los SLPPT y rechazo agudo, que tienen un abordaje terapeútico opuesto (disminución vs. incremento de la inmunosupresión).
Nuestros objetivos fueron poner a punto una técnica de PCR semicuantitativa para medir la carga viral del VEB en muestras clínicas y su aplicación al seguimiento prospectivo en sangre y saliva en pacientes adultos trasplantados renales; analizar los valores de carga viral del VEB en caso de manifestaciones clínicas y según el tipo de inmunosupresión.
Se monitorizaron prospectivamente 65 pacientes sometidos a trasplante renal (TR) en el Hospital Universitari Germans Trias i Pujol de Badalona entre Julio de 1997 y Junio de 2000. Se recogieron muestras de saliva y sangre justo antes del trasplante, cada quince días durante los 3 primeros meses, a los 4, 5, 6, 9, 12 meses posteriores al trasplante y una vez al año. Igualmente se obtuvieron muestras en caso de manifestaciones clínicas: fiebre de origen infeccioso no bacteriano y rechazo agudo (RA).
La determinación de la carga viral del VEB en las muestras clínicas se realizó mediante un método de PCR semicuantitativa y la detección de los productos de amplificación se efectuó mediante DNA-enzimoinmunoensayo (DEIA) (Sorin Biomedica, Saluggia, Italia). Previamente fue preciso determinar el rango dinámico de la técnica de PCR y el método DEIA, construyéndose una curva semilogarítmica de referencia. Los valores de absorbancia obtenidos mediante el método DEIA se utilizaron para extrapolar el número de copias de DNA VEB a partir de la curva de referencia anteriormente mencionada. En las muestras de leucocitos los resultados se expresaron como número de copias de DNA VEB/75.000 PBMC y en muestras de saliva como número de copias DNA VEB/5 μl de saliva.
La sensibilidad de la técnica de PCR semicuantitativa para la detección de DNA del VEB fue de 5-10 copias de DNA del VEB.
Se estudiaron prospectivamente 65 pacientes TR, siendo el tiempo medio de seguimiento de 20.4 meses (rango 3-36 meses), 16 pacientes se sigueron entre 3 meses-1 año, 23 pacientes entre 1-2 años, y 26 pacientes entre 2-3 años. En cuanto al tratamiento inmunosupresor: el 60% de pacientes TR recibieron tacrolimus (FK), el 31% ciclosporina A (CyA) y en el 31% de pacientes la inmunosupresión incluyó anticuerpos antilinfocitarios. En total se analizaron 1087 muestras: 633 de sangre y 454 de saliva. Todos los pacientes eran seropositivos frente al VEB con anterioridad al trasplante renal.
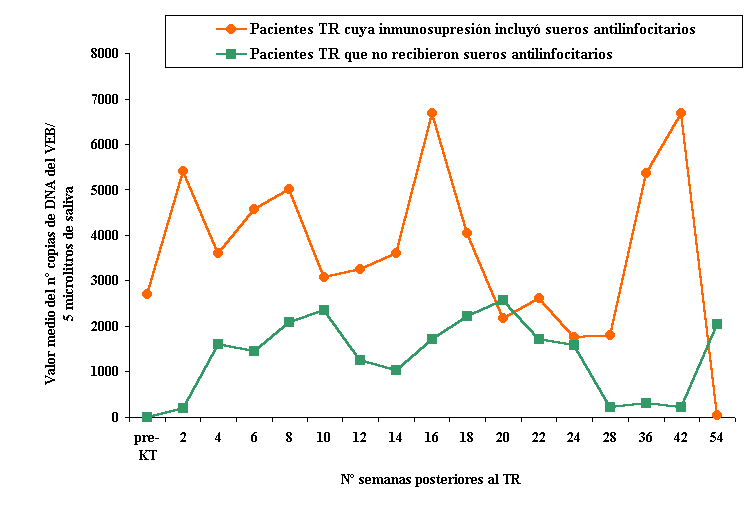
En las muestras de saliva, la carga viral fue muy variable entre los diferentes pacientes TR. Sin embargo, se pudo evidenciar un patrón en la excreción del virus en saliva a partir del momento del trasplante consistente en un aumento progresivo de la excreción del VEB a partir de la segunda semana del trasplante hasta el tercer y sexto mes, decreciendo posteriormente. Los valores más elevados de detección del VEB en saliva correspondieron a los pacientes que recibieron sueros antilinfocitarios tanto en inducción como en el tratamiento del rechazo agudo (Figura 1.). No se observó correlación entre la CV VEB en saliva y manifestaciones clínicas.
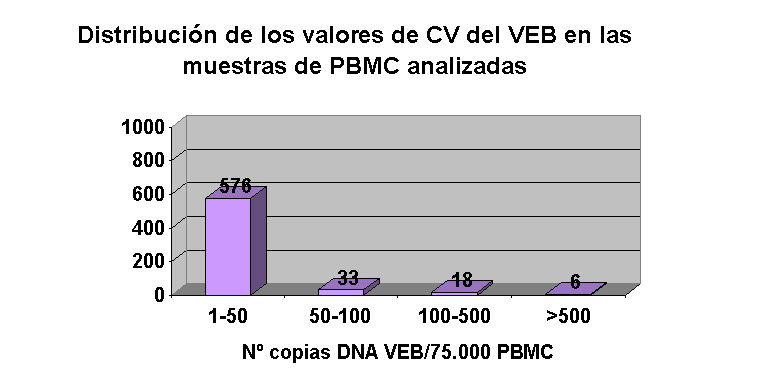
Por lo que respecta a muestras de sangre, en 26 pacientes TR la carga viral del VEB fue inferior a 50 copias DNA VEB/75.000 PBMC durante todo el periodo de seguimiento. En 29 pacientes, aunque los valores medios de carga viral del VEB se situaron entre 25-50 copias de DNA del VEB/75.000 PBMC durante todo el periodo de estudio, se detectaron de forma puntual valores superiores de carga viral del VEB, sin manifestaciones clínicas aparentes excepto en un caso (Figura 2.). No se observó correlación entre los valores de carga viral del VEB registrados en muestras de saliva y de PBMC.
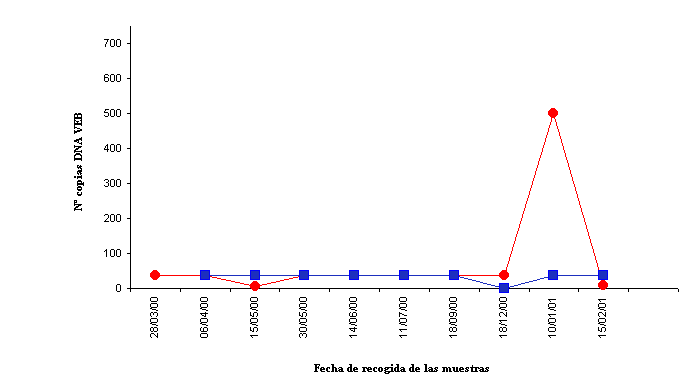
Con respecto a las manifestaciones clínicas, uno de los 65 pacientes TR desarrolló un linfoma cerebral primario de tipo B a los 9 meses y medio del TR, lo cual supone una incidencia del 1.3%. En este paciente la muestra de biopsia del linfoma resultó positiva para VEB mediante técnica de PCR. El análisis de la carga viral del VEB en sangre aumentó de forma notoria en el momento del diagnóstico, volviendo a valores similares a los registrados con anterioridad al diagnóstico del linfoma cinco semanas después del inicio del tratamiento que consistió en descontinuación de la inmunosupresión, quimioterapia y administración de aciclovir (Figura 3.).
Además, se registraron 27 episodios de fiebre en 19 pacientes TR y 15 episodios de RA en 14 pacientes que fueron tratados con bolus de metil-prednisolona. No se observó ninguna relación entre la carga viral del VEB en PBMC o saliva y los episodios de fiebre. Cuando se comparó la carga viral del VEB en PBMC antes y después de los episodios de RA, se detectó un incremento en los niveles de DNA del VEB antes del RA en 2 casos, mientras que en 4 pacientes los niveles de DNA del VEB aumentaron hasta 250-500 copias DNA VEB/75.000 después del tratamiento del RA con corticoides.
La carga viral del VEB se analizó en 11 pacientes trasplantados con infección por CMV (8 primoinfecciones y 3 reactivaciones). El diagnóstico de infección por CMV se realizó mediante detección de pp65 en PBMC (prueba de antigenemia) y detección de IgG CMV en muestras de suero (seroconversión). Todos los pacientes TR seronegativos frente al CMV con anterioridad al trasplante recibieron profilaxis con ganciclovir durante 1 mes. En los pacientes con infección por CMV el tratamiento consistió en ganciclovir durante 3 meses. En 5/11 pacientes TR con in infección por CMV (45%) se evidenció reactivación serológica por VEB. Sin embargo, en ninguno de estos pacientes se observaron variaciones en la carga viral del VEB en PBMC o en saliva. El tratamiento con ganciclovir afectó a la carga viral del VEB en saliva pero no en PBMC. Tampoco se observó relación entre la carga viral del VEB y el tipo de tratamiento inmunosupresor (ciclosporina A vs. Fk).
Según nuestros resultados, no existe relación entre la carga viral del VEB en muestras de saliva y PBMC, ni tampoco entre la carga viral del VEB en saliva y las manifestaciones clínicas. Por ello, creemos que las muestras de saliva no son útiles para la monitorización prospectiva de la carga viral del VEB en pacientes trasplantados.
El valor predictivo positivo de niveles elevados de carga viral de DNA del VEB ³ 500 copias de DNA VEB/75.000 PBMC es bajo dado que sólo 1/6 pacientes TR con niveles de carga viral ³ 500 copias de DNA del VEB/75.000 desarrolló un SLPPT. Por el contrario, el valor predictivo negativo de niveles de DNA en PBMC inferiores a 50 copias parece ser elevado puesto que ninguno de los pacientes TR con valores de carga viral <50 copias de DNA del VEB ha desarrollado un SLPPT.
En los pacientes asintomáticos con niveles de DNA del VEB en PBMC intermedios entre estos valores, es preciso realizar un seguimiento más estrecho para determinar el riesgo de desarrollar un SLPPT.
De acuerdo con nuestra experiencia, la disminución de la carga viral del VEB en pacientes con SLPPT puede tener también utilidad como marcador de la eficacia del tratamiento. La monitorización de la carga viral del VEB en pacientes trasplantados puede ser útil para distinguir los SLPPT del RA, puesto que sólo en el 13.3% de los pacientes con RA se detectó un aumento previo de la carga viral del VEB.