
Gerardo Torres Torres
| DISCUSSION BOARD |
Las principales sustancias oxidantes en lo sistemas biológicos son los radicales libres Se considera un radical libre a cualquier molécula que contenga uno o más electrones sin parear derivados del oxigeno también denominadas ROS, (Reactive oxigeno species) por su actividad La mayor parte de estas sustancias derivan del anión superóxido (O2.-). Tal anión proviene de la cadena respiratoria y es continuamente producido por la membrana interna de las mitocondria en cantidades pequeñas. Pero esta situación cambia en respuesta a un estimulo, aumentando la producción de este anión superoxido (O2.-) a través de la NADPH oxidasa (Nicotinamida Adenina Dinucleotido Fosfato oxidasa)
La NADPHoxidasa de los fagocitos (leucocitos y monocitos) es estimulada por mediadores proinflamatorios como el C5a, interleukina, e1 factor de necrosis tumoral, bacterias, endotoxinas etc.
Cuando se forma el superóxido es inmediatamente transformado mediante la superoxidodismutasa en peróxido de hidrógeno (H2O2) a partir de aquí se pueden seguir tres vías.
| O2.- + Fe3+ ____________ Fe2+ + O2 Fe2+ + H2O2 ____________ Fe3+ + OH- + OH. O2 + H2O ____________ OH- + OH. |
3.-Que en presencia de cloro a través del sistema enzimático de la mieloperoxidasa de los leucocitos se forme ácido hipocloroso (anión hipoclorito) El ácido hipocloroso es el radical más tóxico y la especie mas reactiva formada por los fagocitos. Su efecto tóxico se ejerce también sobre células normales pudiendo oxidar lípidos y proteoglicanos de las membranas celulares. Intracelularmente inhibe los citocromos con lo que se impide la cadena respiratoria.
Asimismo el ácido hipocloroso puede reaccionar con radicales NH2 con lo que forman las cloraminas, oxidante de larga vida media. Algunos tipos de cloraminas son tóxicas cuando el nivel de amoniaco aumenta en sangre.

SISTEMAS ANTIOXIDANTES:
Los radicales libres formados en el organismo pueden iniciar una serie de reacciones en cadena, que continúan hasta que éstos son eliminados tras diversas reacciones con otros radicales libres o por la acción del sistema antioxidante, el cual protege a los tejidos de los efectos que ellos producen. Unos previenen la formación de nuevos radicales libres, convirtiéndolos en moléculas menos perjudiciales antes de que puedan reaccionar o evitando la formación de radicales libres a partir de otras moléculas
Otros capturan los radicales libres impidiendo la reacción en cadena y por fin otros reparan las células dañadas
Los sistemas antioxidantes los podemos dividir en tres clases:
SISTEMAS ENZIMATICOS
El superoxido dismutasa representa la primera línea de defensa acelerando la reacción del anión superoxido a peroxido de hidrógeno. Es una reacción que metabólicamente es poco costosa ya que no requiere el consumo de ningún cofactor.
La catalasa es la responsable de la destrucción del peróxido de hidrógeno en agua y oxígeno.
La glutatión reductasa està también en la segunda línea de defensa del ataque oxidativos reduciendo el peroxido y en general todos los hidroperoxidos organicos tipo R-OOH. Esta ultima requiere un donante de hidrógeno para actuar que es el el glutatión reducido
AGENTES ANTIOXIDANTES NO ENZIMATICOS
El glutatión, presente en todas las células limpia los radicales peróxido de hidrogeno, radical hidroxilo
El alfa tocoferol y vit E está presente sobre todo en las membranas celulares y juega un papel importante protegiendo a los lípidos de la oxidación uniendo los radicales hidroxilos formando una proteina con ninguna actividad metabólica toxica
Ácido ascórbico y Vit C presente de forma intra y extracelular limpia los radicales hidroxilos y los aniones superóxido formando ácido dehidroascorbico que es limpiado por el glutation
Cisteina, taurina y metionina que limpian selectivamente ácido hipocloroso y las cloraminas.
Acido úrico glucosa y el manitol tienen capacidad para neutralizar algunos agentes oxidantes. Por otra parte la ferritina, la transferrina y la ceruloplasmina son capaces de ejercer efecto antioxidante por secuestro de metales transición por ejemplo el hierro e impidiendo la formación de radicales hidroxilos.
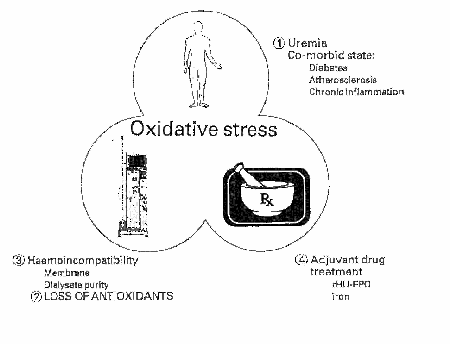
Durante la Hemodiálisis se produce una alteración del equilibrio entre la producción de radicales libres y la perdida de scavanger o eliminadores de estos. En la figura 2 se muestran las diferentes causas del estrés oxidativo en hemodiálisis
ESTADO UREMICO: la uremia es una situación donde la homeóstasis del medio interno se encuentra alterado , por lo que el estrés oxidativo que se produce en la uremia hay que entenderlo en ese contexto.
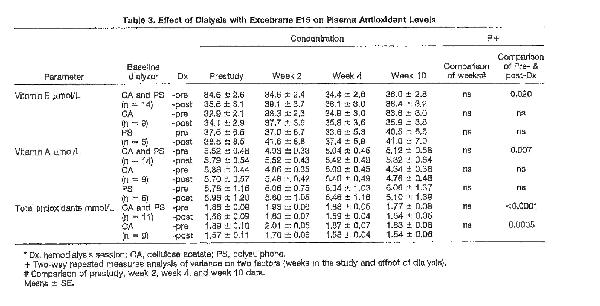
En el trabajo de Clermont y cols publicado en el 2000 objetivan que en la insuficiencia renal crónica se caracteriza por un estado prooxidante demostrado por la depleción de oxidantes y la presencia aumentada de radicales libres como puede verse en la tabla siguiente

HEMODIÁLISIS INDUCE PERDIDA DE SUSTANCIAS ANTIOXIDANTES
La hemodiálisis es un proceso de depuración que esta basado en el peso molecular de las sustancias, en el coeficiente de cribado de la membrana y en las características hidrofóbicas o hidrofílicas de la misma
Por las características de la técnica es fácil de suponer que al par que se pierden toxinas urémicas también hay perdidas de sustancias importantes para el metabolismo como son los aminoácidos glucosa péptidos de bajo peso molecular etc
Por consiguiente la hemodiálisis particularmente las técnicas de alta eficiencia con membranas altamente permeables producen una perdida de solutos entre ellos sustancias antioxidantes particularmente de las vitaminas.
La Vit C como puede verse en figura anterior se ven los niveles plasmáticos disminuidos.Se ha calculado que con la PFD (Filtración en doble camara) se pierde 50 mg por sesión
BIOINCOMPATIBILIDAD DE LOS SISTEMAS DE DIÁLISIS:
La bioincompatibilidad juega un papel critico en la producción de radicales libres aumentando el estado prooxidante.
Cristol ha estudiado la contribución de la membrana comparando la producción de ROS con dializado ultrapuro y membrana derivada de la celulosa contra una membrana sintética. Y objetiva que los monocitos y los polimorfonucleares son activado en los primeros momentos de la hemodiálisis con membranas de cuprophan pero no con las polisulfona
En el año 2000 Biasoli publica un trabajo comparando el efecto de 6 diferentes membrana sobre la actividad antioxidante del plasma y de lo eritrocitos y objetiva que algunas membranas tienen efectos individuales.. Sobre peroxidacion lipídica es mas compatible el hemophan que el diacetato y sobre el sistema antioxidante del hematíe el polimetilmetacrilato es mas compatible que el resto de las membranas
DIALIZADO:
Los microorganismos contenidos en el dializado liberan una serie de sustancias que son capaces de inducir la actividad de las citoquinas, IL-1 IL-6 y TNF alfa estas sustancias también llamadas endotoxinas son estructuralmente elementos de la pared externa de la célula de las bacterias gram negativas y están compuestas por lipopolisacaridos (LPS)
Estas cantidades de LPS son un potente inductor de la producción de ROS vía activación de los polimorfonucleares.
David en un estudio in vitro analiza la importancia de la retrofiltración del liquido de diálisis al objetivar la estimulación de los polimorfonucleares cuando la retrofiltración ocurría
TRATAMIENTOS COADYUVANTES.
En un intento de restaurar las condiciones basales en el insuficiente renal crónico o en paciente que están sometidos a hemodiálisis los médicos prescribimos sustancias que pueden empeorar el estrés oxidativo.
La administración de Fe IV como metal de transición es la principal fuente de radicales hidroxilos a traves de la reaccion de Fenton con la formación del anión superóxido.
Por otra parte Chen en 1997 publicó un estudio en un grupo de 15 pacientes tratados con Epo durante 12 semanas y objetivo un aumento de los ROS al cabo de este tiempo.
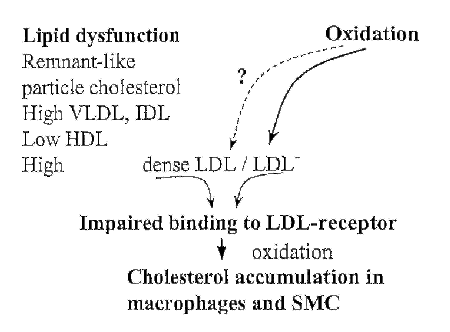
ATEROSCLEROSIS
La principal fuente de aterogénesis se ha demostrado que es la peroxidación lipídica que conlleva la activación in situ de los monocitos y macrófagos, generación de las células espumosas y proliferación de las células musculares de la pared vascular
AMILOIDOSIS:
Algunos marcadores de la peroxidación han sido identificados en los depósitos de beta 2 de la amiloidosis de los pacientes en hemodiálisis
Los radicales libres facilitan la formación de los depositos debeta 2 microglobulina y ejerce su particular efecto tóxico
ANEMIA:
El componente lipídico de las membranas es el lugar ideal para producir el daño celular del estrés oxidativo, este fenómeno podría explicar el acortamiento de la vida media de los hematíes y también podría ser un factor que limitaría la respuesta de a la Epo. Sin embargo hay que tener en cuenta la sobrecarga de Fe contribuye a un estado proxidante.
POSIBILIDADES TERAPÉUTICAS:
El prevenir o reducir el estrés oxidativo después de vistos los factores patogénicos pasa por mejorar la biocompatibilidad de los sistemas de hemodiálisis y por otro suplementar la deficiencia de los antioxidantes
MEJORA DE LA BIOCOMPATIBILIDAD DE LOS SISTEMAS DE HEMODIÁLISIS:
La producción de superóxidodismutasa esta significativamente reducida en las membranas biocompatibles como nos referimos anteriormente al trabajo de Biasoli. Las membranas sintéticas polisulfona, AN69, poliamida tienen virtualmente abolida la producción de ROS
Utilizar dializado ultrapuro definido como estéril y no pirógeno que al no contener o tener reducida la concentración de LPS puede prevenir la activación de NADPH oxidasa y disminuir la cascada inflamatoria
MEJORAR LOS MECANISMOS ANTIOXIDANTES:
Suplemento de productos antioxidantes para restaurar el balance oxidativo es un camino prometedor.
Se han realizado estudios como los de Cristol y Bohm con aporte oral de Vit E y C con lo que consiguen mejorar el estrés oxidativo. Igualmente la administración de selenio se ha demostrado que es efectivo y perfectamente tolerado
Actualmente se están desarrollando nuevas estrategias modificando las técnicas de diálisis para conseguir disminuir el estrés oxidativo.
Entre ellas destacan la hemofiltración con regeneración del ultrafiltrado a través de filtro de carbono activado y la adición de sustancias antioxidantes.
Hay actualmente nuevas técnicas para mejorar el estrés oxidativo una de ellas ha sido desarrolada por terumo que incorpora a la lamina interna de una membrana celulósica vitamina E. Los resultados de los estudios que hay parecen indicar una mejoría del estrés oxidativo aunque el tema esta actualmente en mantilla.
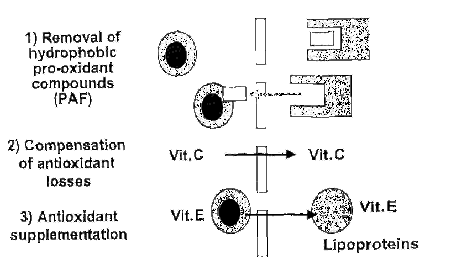
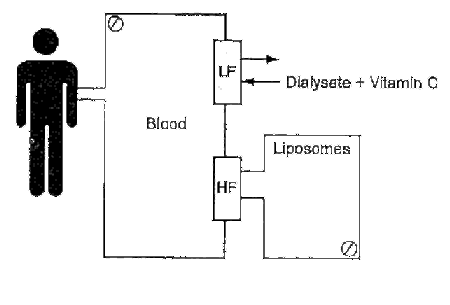
Otra nueva técnica que se esta desarrollando actualmente es la llamada hemolipodiálisis que consiste en añadir vit C al dializado aprovechando sus propiedades hidrofílicas y a través de un nuevo circuito que contiene liposomas se pueda ir soltando Vit E que pasaría a la sangre.
La presencia de liposomas no solo sería importante por añadir vit E sino que también aumentaría la extracción toxinas hidrofóbicas tales como los leucotrienos PAF y radicales hidroperóxidos
BIBLIOGRAFIA
Eiselt J, Racek J, Trefil L, Opatrny K. Effects of a vitamin e-modified dialysis membrane and vitamin c infusion on oxidative stress in hemodialysis patients. Artif Organs. 2001 Jun;25(6):430-6.
Clermont G, Lecour S, Cabanne J, Motte G, Guilland J, Chevet D, Rochette L. Vitamin E-coated dialyzer reduces oxidative stress in hemodialysis patients. Free Radic Biol Med. 2001 Jul 15;31(2):233-41.
Chugh SN, Jain S, Agrawal N, Sharma A. Evaluation of oxidative stress before and after haemodialysis in chronic renal failure. J Assoc Physicians India. 2000 Oct;48(10):981-4.
MacGinley R, Westhuyzen J, Saltissi D, Morgan C, Healy H, Thirlwell GK, Disney AP. Evaluation of a novel vitamin E coated cellulosic membrane hollow fiber dialyzer. ASAIO J. 2001 Jan-Feb;47(1):66-73.
Weiss MF. Vitamin E for dialysis patients. Semin Dial. 2001 Jan-Feb;14(1):71-2.
Himmelfarb J, McMonagle E. Manifestations of oxidant stress in uremia. Blood Purif. 2001;19(2):200-5.
Stenvinkel P. Malnutrition and chronic inflammation as risk factors for cardiovascular disease in chronic renal failure. Blood Purif. 2001;19(2):143-51.
Biasioli S, Schiavon R, Petrosino L, Cavallini L, Cavalcanti G, De Fanti E, Zambello A, Borin D. Role of cellulosic and noncellulosic membranes in hyperhomocysteinemia and oxidative stress. ASAIO J. 2000 Sep-Oct;46(5):625-34.
Wratten ML, Sereni L, Tetta C. Hemolipodialysis attenuates oxidative stress and removes hydrophobic toxins. Artif Organs. 2000 Sep;24(9):685-90.
Lucas AD, Kalson JA, Hutter JC, Wallis RR. Identifying toxic degradation products in cellulose acetate dialyzers. J Biomed Mater Res. 2000 Sep;53(5):449-56.
Handelman GJ. Evaluation of oxidant stress in dialysis patients. Blood Purif. 2000;18(4):343-9.
Clermont G, Lecour S, Lahet J, Siohan P, Vergely C, Chevet D, Rifle G, Rochette L. Alteration in plasma antioxidant capacities in chronic renal failure and hemodialysis patients: a possible explanation for the increased cardiovascular risk in these patients.
Cardiovasc Res. 2000 Aug 18;47(3):618-23.
Morena M, Cristol JP, Canaud B. Why hemodialysis patients are in a prooxidant state? What could be done to correct the pro/antioxidant imbalance. Blood Purif. 2000;18(3):191-9.
Ziouzenkova O, Sevanian A. Oxidative modification of low-density lipoprotein (LDL) in HD patients: role in electronegative LDL formation. Blood Purif. 2000;18(3):169-76.
Nourooz-Zadeh J. Effect of dialysis on oxidative stress in uraemia. Redox Rep. 1999;4(1-2):17-22.
Miyazaki H, Matsuoka H, Itabe H, Usui M, Ueda S, Okuda S, Imaizumi T. Hemodialysis impairs endothelial function via oxidative stress: effects of vitamin E-coated dialyzer. Circulation. 2000 Mar 7;101(9):1002-6.
Lucchi L, Bergamini S, Botti B, Rapana R, Ciuffreda A, Ruggiero P, Ballestri M, Tomasi A, Albertazzi A. Influence of different hemodialysis membranes on red blood cell susceptibility to oxidative stress. Artif Organs. 2000 Jan;24(1):1-6.
Wratten ML, Navino C, Tetta C, Verzetti G. Haemolipodialysis. Blood Purif. 1999;17(2-3):127-33.
Tetta C, Biasioli S, Schiavon R, Inguaggiato P, David S, Panichi V, Wratten ML. An overview of haemodialysis and oxidant stress. Blood Purif. 1999;17(2-3):118-26.
Canaud B, Cristol J, Morena M, Leray-Moragues H, Bosc J, Vaussenat F. Imbalance of oxidants and antioxidants in haemodialysis patients. Blood Purif. 1999;17(2-3):99-106.
Schettler V, Methe H, Staschinsky D, Schuff-Werner P, Muller GA, Wieland E. Review: the oxidant/antioxidant balance during regular low density lipoprotein apheresis. Ther Apher. 1999 Aug;3(3):219-26.
Witko-Sarsat V, Khoa TN, Jungers P, Drueke T, Descamps-Latscha B. Advanced oxidation protein products: oxidative stress markers and mediators of inflammation in uremia. Adv Nephrol Necker Hosp. 1998;28:321-41.
Biasioli S, Schiavon R, Petrosino L, Cavallini L, Cavalcanti G, De Fanti E. Dialysis kinetics of homocysteine and reactive oxygen species. ASAIO J. 1998 Sep-Oct;44(5):M423-32.