
|
Paneles de Discussión
Paneais de Discussio |
INFLAMACIÓN EN LA INSUFICIENCIA RENAL CRÓNICAFrancisco CaravacaServicio Nefrología Hospital Infanta Cristina
fcaravacam@senefro.org
|
|
Efecto pro-aterogénico |
Referencia |
|
|
13 |
|
|
14 |
|
|
15 |
|
|
16 |
|
|
17 |
|
|
18 |
|
|
19 |
|
|
20 |
|
|
18 |
|
|
21 |
Prevalencia de PCR elevada en la IRC
Numerosos estudios han demostrado elevaciones significativas de PCR en pacientes con IRC. La prevalencia de una PCR elevada oscila entre el 25% de los pacientes con IR moderada [22], hasta el 35-50% en pacientes con IR avanzada o en diálisis [23-32].
Un dato destacable es que la prevalencia de inflamación no difiere sustancialmente entre los pacientes con IRC prediálisis y aquellos ya sometidos a diálisis.
El límite superior (punto de corte) de PCR que define el diagnóstico de inflamación es bastante arbitrario. En la población general, una PCR > 3 mg/L se considera marcador de alto riesgo de desarrollo de eventos cardiovasculares [33]. Esta cifra es aproximadamente el tercil superior de la frecuencia de distribución de PCR en la población sana. Estas concentraciones de PCR han demostrado ser relevantes en la patogenia de la aterosclerosis.
Las concentraciones de PCR que predicen un peor pronóstico en pacientes con IRC oscilan ampliamente entre 3 y 15 mg/L [31,34]. Estas diferencias son debidas en parte a la utilización o no de determinaciones de PCR de alta sensibilidad. Es de prever que la utilización más generalizada de PCR de alta sensibilidad en futuros estudios nos permita conocer mejor cuáles son las cifras de PCR que tienen un significado pronóstico negativo en la evolución de los pacientes con IRC.
Posibles causas de una elevación de PCR en la IRC
La alta prevalencia de PCR elevada en los pacientes con IRC ha llevado a una idea generalizada de una relación causa-efecto entre la uremia e inflamación. Sin embargo, hasta el momento no hay datos que prueben que esta relación sea causal.
La frecuencia de distribución de las concentraciones de PCR entre la población con IRC es muy sesgada como se muestra en la figura 1. Este dato sugiere que factores diferentes a la propia uremia, común en todos estos pacientes, podrían estar relacionados con el desarrollo de los signos de inflamación.

Las infecciones, la exposición a materiales poco biocompatibles, los accesos vasculares, y los baños o líquidos de diálisis contaminados podrían jugar un papel importante en el desarrollo de signos inflamatorios en los pacientes sometidos a diálisis (Figura 2) [35-40].
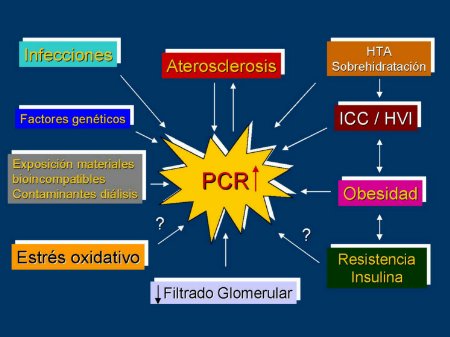
La reducción del filtrado glomerular podría incrementar los marcadores inflamatorios al reducir su aclaramiento [41,42]. La función renal residual se relaciona negativamente con la prevalencia de inflamación [43,44]. Sin embargo, cuando este parámetro se ajusta a otros factores, como el grado de severidad de la hipertensión arterial, o el grado de sobrehidratación, pierde importancia como determinante [45].
Una historia previa de enfermedad aterosclerótica, la hipertrofia miocárdica, la insuficiencia cardiaca, y las calcificaciones vasculares son procesos comórbidos frecuentes en la IRC, que al mismo tiempo se relacionan con una elevación de la PCR en la población con o sin IRC [32, 46-51]. La edad por sí misma no parece ser un determinante de inflamación, sino más bien una variable que incrementa la probabilidad de padecer procesos comórbidos relacionados más directamente con el desarrollo de inflamación.
Otros factores, bien conocidos como determinantes de la inflamación en la población no urémica, como son la obesidad y la resistencia a la insulina, han sido poco estudiados en la población urémica.
El adipocito es una fuente importante de IL-6 [52]. Se calcula que un tercio de las concentraciones de IL-6 circulante tienen su origen en el adipocito. El índice de masa corporal (IMC) se relaciona con los niveles de PCR en la población no urémica [53].
La obesidad de distribución central parece incrementar aun más los niveles de PCR, debido a que la grasa intra-abdominal es capaz de generar tres veces más IL-6 que la grasa subcutánea, y que el drenaje venoso de esta grasa fluye directamente hacia el hígado [54]. Se ha demostrado que el adipocito es capaz de expresar ARNm de la PCR [55]. En algunos estudios en pacientes con IRC se ha observado una relación entre IMC y PCR [32].
Por otro lado, la resistencia a la insulina es otro estado que favorece el desarrollo de inflamación [56]. Debido a la estrecha relación entre obesidad y resistencia a la insulina, existen dudas sobre el papel que podrían jugar cada uno de estos factores por separado [57]. La resistencia a la insulina es muy frecuente en pacientes con IRC [58]. La relación entre la resistencia a la insulina y la inflamación en la IRC es desconocida hasta el momento.
Factores genéticos podrían influir también en el grado de severidad de la inflamación. Determinantes genéticos de la síntesis y secreción de citoquinas como la IL-10, o la adiponectina podrían explicar variaciones en la respuesta inflamatoria ante determinados estímulos, o en la obesidad [55,59].
No obstante, se ha observado que los pacientes en diálisis tienen una secreción espontánea de IL-10 significativamente superior a los sanos, existiendo una correlación positiva entre los niveles de IL-10 e IL-6 [60]. Este aumento de IL-10 podría tratarse de un mecanismo compensador para el control del exceso de producción de otras citoquinas [61].
¿Es la uremia por sí misma un estado proinflamatorio?
Quizá una de las cuestiones más interesantes en la investigación sobre la relación IRC e inflamación es la posibilidad de que la uremia crónica se comporte como un estado proinflamatorio.
Mientras que un 15-20% de los monocitos circulantes de sujetos sanos son capaces de producir citoquinas, hasta el 50% de los monocitos de pacientes sometidos a hemodiálisis producen estas sustancias pro-inflamatorias [62]. Así, el nivel de producción de citoquinas ante determinados estímulos podría incrementarse notablemente en la uremia crónica.
Por otro lado, el ambiente urémico y la exposición a membranas de diálisis aumenta la apoptosis de los monocitos, e induce en estas células cambios propios del envejecimiento [63,64]. La 1,25-dihidroxi-vitamina D tiene también conocidos efectos moduladores sobre la secreción de citoquinas por los monocitos-macrófagos [65,66].
Relación entre estrés oxidativo y diabetes con niveles de PCR
El estrés oxidativo se ha propuesto como causa de inflamación en la uremia crónica [67,68]. Sin embargo las investigaciones que relacionan ambos procesos son hasta el momento escasas y controvertidas.
Se ha observado una correlación entre las concentraciones de PCR y la de alguna sustancia que mide la peroxidación de lipoproteínas (sustancia de reacción del ácido tiobarbitúrico) en pacientes con IRC [69]. También se ha descrito una relación entre los niveles plasmáticos de PCR y de F2-isoprostano [70,71].
Sin embargo, en otros estudios no se ha podido demostrar una relación entre LDL-oxidadas [31] ó entre Productos de Oxidación Proteica Avanzada (POPA) con los niveles de PCR [72]. Los POPA sí se relacionan en cambio con otros reactantes de fase como son el fibrinógeno, orosomucoide o la proteína PAPP-A [72].
La ausencia de relación entre diabetes y prevalencia de PCR elevada es un dato llamativo en casi todos los estudios epidemiológicos realizados en población con IRC. A pesar de que los pacientes diabéticos sufren con mayor frecuencia procesos potencialmente relacionados con la inflamación (aterosclerosis, hipertensión arterial, hipertrofia miocárdica, obesidad, etc.), el porcentaje de pacientes con PCR elevada no es significativamente diferente al de la población no diabética con IRC. Incluso, como hemos podido observar en nuestros pacientes (datos no publicados), cuando la diabetes se ajusta a otros factores determinantes de PCR elevada, resulta ser un predictor negativo.
Este hallazgo paradójico contrasta con los estudios que demuestran una frecuente elevación de los niveles de IL-6 y factor de necrosis tumoral en diabéticos [73,74]. Es posible que la PCR no sea una medida exacta y fiable de inflamación en todos los pacientes, o en determinadas patologías. Más aun, no se ha demostrado una relación entre estrés de glicosilación (cuantificado a través de los productos AGE) e incremento de los reactantes de fase [72]. Parece, por tanto, que la diabetes por sí misma no es una causa de PCR elevada en pacientes urémicos, aunque no se puede descartar que estos pacientes tengan otros marcadores de inflamación elevados.
Independientemente de estos hallazgos, sí se ha demostrado recientemente que un incremento de PCR es mejor predictor de la mortalidad en los pacientes diabéticos que en los no diabéticos con IRC [75].
Mortalidad y niveles de PCR. ¿Aporta algo la PCR a los parámetros clínicos predictores de la mortalidad?
La edad y los índices de comorbilidad son sin duda los datos clínicos que mejor predicen la mortalidad en los pacientes con IRC [76-78]. Estos datos clínicos son más sólidos y probablemente con un significado de predicción más racional y fiable que una determinación aislada de marcadores inflamatorios. Debido a la fuerte correlación entre marcadores de inflamación o de desnutrición con el número y severidad de los procesos comórbidos, cabe preguntarse si la inclusión de la inflamación aporta algo a los modelos predictores sobre la morbi-mortalidad en la IRC.
En la mayoría de los estudios donde se ha demostrado una relación entre niveles de PCR con la mortalidad, los modelos no se ajustaron a índices conjuntos de comorbilidad. En otros estudios, la PCR pierde su poder predictor sobre la mortalidad cuando se ajusta al estado de nutrición o la albúmina sérica [79]. Es necesario establecer en futuras investigaciones el verdadero valor de la PCR u otros marcadores de inflamación, ajustados a los datos clínicos que actualmente nos aportan más información sobre la evolución de los pacientes.
Conclusiones
1. Ridker PM, Glynn RJ, Hennekens CH. C-reactive protein adds to the predictive value of total and HDL cholesterol in determining risk of first myocardial infarction Circulation 1998; 97: 2007-2011.
2. Lagrand WK, Visser CA, Hermens WT et al. C-reactive protein as a cardiovascular risk factor: more than an epiphenomenon? Circulation. 1999; 100: 96-102
3. Ridker PM, Rifai N, Stampfer MJ, et al. Plasma concentration of interleukin-6 and the risk of future myocardial infarction among apparently healthy men. Circulation. 2000; 101: 1767-1772
4. Mayr M, Kiechl S, Willeit J, Wick G, Xu Q. Infections, immunity, and atherosclerosis: associations of antibodies to Chlamydia pneumoniae, Helicobacter pylori, and cytomegalovirus with immune reactions to heat-shock protein 60 and carotid or femoral atherosclerosis. Circulation 2002; 102: 833-839
5. Mattila KJ, Valtonen VV, Nieminen MS, Asikainen S. Role of infection as a risk factor for atherosclerosis, myocardial infarction, and stroke. Clin Infect Dis1998; 26: 719-734
6. Salomon DH, Karlson EW, Rimm EB et al. Cardiovascular morbidity and mortality in women diagnosed with rheumatoid arthritis. Circulation 2003; 107: 1303--1307
7. Salmon JE, Roman MJ. Accelerated atherosclerosis in systemic lupus erythematosus: implications for patient management. Curr Opin Rheumatol 2002; 13: 341-344.
8. Ross R. Atherosclerosis: an inflammatory disease. N Engl J Med 1999; 340: 115-126.
9. Bataille R, Klein B. C-reactive protein levels as a direct indicator of interleukin-6 levels in humans in vivo. Arthritis Rheum 1992; 35: 982-984
10. Nijstein MWN, De Groot ER, Ten Duis HJ, et al. Serum levels of interleukin 6 and acute phase response. Lancet 1987; 2: 921
11. Marinkovic S, Jahreis GP, Wong GG, Baumann H. IL-6 modulates the synthesis of a specific set of acute phase plasma proteins in vivo. J Immunol 1989; 142: 808-812
12. Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest 2003; 111: 1805-1812
13. Pepys MB, Rowe IF, Baltz MI. C-reactive protein: binding to lipids and lipoproteins. Int Rev Exp Pathol 1985; 27: 83-111
14. Chang MK, Binder CJ, Torzewski M, Witztum JL. C-reactive protein binds to both oxidized LDL and apoptotic cells through recognition of a common ligand: phosphorylcholine of oxidized phospholipids. Proc Natl Acad Sci USA 2002; 99:13043-13048.
15. Bhakdi S, Torzewski M, Klouche M, Hemmes M. Complement and atherogenesis. Binding of CRP to degraded, nonoxidized LDL enhances complement activation. Arterioscler Thromb Vasc Biol 1999;19: 2348-2354
16. Zwaka TP, Hombach V, Torzewski J. C-reactive protein mediated low density lipoprotein uptake by macrophages: implications for atherosclerosis. Circulation 2001; 103: 1194-1197
17. Cermak J, Key NS, Bach RR, et al. C-reactive protein induces human peripheral blood monocytes to synthesize tissue factor. Blood. 1993; 82: 513-520.
18. Verma S, Wang CH, Li SH, et al. A self-fulfilling prophecy: C-reactive protein attenuates nitric oxide production and inhibits angiogenesis. Circulation. 2002; 106: 913-919
19. Pasceri V, Willerson JT, Yeh ET. Direct proinflammatory effect of C-reactive protein on human endothelial cells. Circulation. 2000; 102: 2165-2168
20. Pasceri V, Chang J, Willerson JT, et al. Modulation of C-reactive protein-mediated monocyte chemoattractant protein-1 induction in human endothelial cells by anti-atherosclerosis drugs. Circulation 2001; 103: 2531-2534
21. Wang CH, Li SH, Weisel R, et al. C-reactive protein upregulates angiotensin type 1 receptors in vascular smooth muscle cells. Circulation 2003; 107; 1783-1789
22. Panichi V, Migliori M, De Pietro S. C-reactive protein in patients with chronic renal diseases. Ren Fail 2001; 23 :551-562.
23. Stenvinkel P, Heimbürger O, Paultre F, et al. Strong association between malnutrition, inflammation, and atherosclerosis in chronic renal faliure. Kidney Int 1999, 55: 1899-1911
24. Panichi V, Migliori M, De Pietro S, et al- C-reactive protein and interleukin-6 levels are related to renal function in predialytic chronic renal failure. Nephron 2002; 91:594-600
25. Ortega O, Rodriguez I, Gallar P, et al. Significance of high C-reactive protein levels in pre-dialysis patients. Nephrol Dial Transplant 2002, 17: 1105-109
26. Shlipak MG, Fried LF, Crump C, et al. Elevations of inflammatory and procoagulant biomarkers in elderly persons with renal insufficiency. Circulation 2003, 107: 87-93
27. Zimmermann J, Herrlinger S, Pruy A, Metzger T, Wanner C. Inflammation enhances cardiovascular risk and mortality in hemodialysis patients. Kidney Int 1999, 55:648-58
28. Iseki K, Tozawa M, Yoshi S, Fukiyama K. Serum C-reactive protein (CRP) and risk of death in chronic dialysis patients. Nephrol Dial Transplant 1999, 14: 1956-60
29. Yeun JY, Levine RA, Martadilak V, Kaysen GA. C-reactive protein predicts all-cause and cardiovascular mortality in hemodialysis patients. Am J Kidney Dis 2000, 35: 469-476
30. Stenvinkel P, Wanner C, Metzger T, et al. Inflammation and outcome in end-stage renal failure: Does female gender constitute a survival advantage? Kidney Int 2002, 62: 1791-1798
31. Bayes B, Pastor MC, Bonal J, et al. Homocysteine, C-reactive protein, lipid peroxidation and mortality in hemodialysis patients. Nephrol Dial Transplant 2003, 18: 106-112
32. Wang AYM, Woo J, Lam CWK, et al. Is a single time-point C-reactive protein predictive of outcome in peritoneal dialysis patients? J Am Soc Nephrol 2003; 14: 1871-1879
33. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular diseaseapplication to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation 2003; 107: 499 - 511
34. Qureshi AR, Alvestrand A, Divino-Filho JC, et al. Inflammation, malnutrition, and cardiac disease as predictors of mortality in hemodialysis patients. J Am Soc Nephrol 2002; 13: S28-S36
35. Ayus JC, Sheikh-Hamad D. Silent infection in clotted hemodialysis access grafts. J Am Soc Nephrol 1998; 9: 1314-1321
36. Spittle M, Craig R, Adhikarla L, et al. Relationship between antibodies to periodontal pathogens and C-reactive protein levels in hemodialysis patients. J Am Soc Nephrol 2000; 11: 299A
37. Memoli B, Postiglione L, Cianciaruso B, et al. Role of different membranes in the release of interleukin-6 soluble receptor in uremic patients. Kidney Int 2000; 54: 417-424
38. Schouten WEM, Grooteman MPC, van Houte AJ, et al. Effects of dialyser and dialysate on the acute phase response in clinical bicarbonate dialysis. Nephrol Dial Transplant 2000; 15: 379-384
39. Tielemans C, Husson C, Schurmans T, et al. Effects of ultrapure and non-sterile dialysate on the inflammatory response during in vitro hemodialysis. Kidney Int 1996; 49: 236-243
40. Libetta C, De Nicola L, Rampino T, et al. Inflammatory effects of peritoneal dialysis: evidence of systemic monocyte activation. Kidney Int 1996; 49: 506-511
41. Hession C, Decker JM, SherblomAP, et al: Uromodulin (Tamm-Horsfall glycoprotein): A renal ligand for lymphokines. Science 1987; 237:1479-1484
42. Bolton CH, Downs LG, Victory JG, et al: Endothelial dysfunction in chronic renal failure: Roles of lipoprotein oxidation and pro-inflammatory cytokines. Nephrol Dial Transplant 2001; 16:1189-1197
43. Pecoits-Filho R, Heimbürger O MD, Peter Barany P, et al. Associations between circulating inflammatory markers and residual renal function in CRF patients. Am J Kidney Dis 2003; 41: 1212-1218
44. Chung SH, Heimbürger O, Stenvinkel P, et al. Association between residual renal function, inflammation and patient survival in new peritoneal dialysis patients. Nephrol Dial Transplant 2003; 18: 590-597
45. Stam F, van Guldener C, Schalkwijk CG, et al. Impaired renal function is associated with markers of endothelial dysfunction and increased inflammatory activity. Nephrol Dial Transplant 2003; 18: 892-898
46. Papagianni A, Kalovoulos M, Kirmizis D, et al. Carotid atherosclerosis is associated with inflammation and endothelial cell adhesion molecules in chronic haemodialysis patients. Nephrol Dial Transplant 2003; 18: 113-119
47. Park CW, Shin YS, Kim CM, et al. Increased C-reactive protein following hemodialysis predicts cardiac hypertrophy in chronic hemodialysis patients. Am J Kidney Dis 2002; 40: 1230-1239
48. Niebauer J, Volk H-D, Kemp M, et al: Endotoxin and immune activation in chronic heart failure: A prospective cohort study. Lancet 1999; 353:1838-1842
49. Aukrust P, Ueland T, Lien E, et al. Cytokine network in congestive heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol. 1999; 83: 376-382
50. Munger MA, Johnson B, Amber IJ, et al. Circulating concentrations of proinflammatory cytokines in mild or moderate heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol. 1996; 77: 723-727
51. Wang TJ, Larson MG, Levy D, et al. C-reactive protein is associated with subclinical epicardial coronary calcification in men and women. Circulation 2002;106:1189-1191
52. Mohamed-Ali V, Goodrick S, Rawesh A, et al. Subcutaneous adipose tissue releases interleukin-6, but not tumor necrosis factor-alpha, in vivo. J Clin Endocrinol Metab. 1997;82:4196-4200
53. Visser M, Bouter LM, McQuillan GM, et al. Elevated C-reactive protein levels in overweight and obese adults. JAMA 1999; 282: 2131-2135
54. Heinrich PC, Castell JV, Andus T. Interleukin-6 and the acute phase response. Biochem J. 1990;265:621-636
55. Ouchi N, Kihara S, Funahashi T, et al. Reciprocal association of C-reactive protein with adiponectin in blood stream and adipose tissue. Circulation 2003; 107: 671-677
56. Festa A, D'Agostino R, Howard G, et al. Chronic subclinical inflammation as part of the insulin resistance syndrome. The Insulin Resistance Atherosclerosis Study (IRAS). Circulation 2000; 102: 42-47
57. Tracey McLaughlin T, Abbasi F, Lamendola C, et al. Differentiation between obesity and insulin resistance in the association with C-reactive protein. Circulation 2002; 106; 2908-2913
58. Fliser D, Pacini G, Engelleiter R, et al. Insulin resistance and hyperinsulinemia are already present in patients with incipient renal disease. Kidney Int 1998; 53: 1342-1347
59. Girndt M, Ulrich C, Kaul H, et al. Uremia associated immune defect: The IL-10-CRP axis. Kidney Int 2003; 84 (supl 84): S76-S79
60. Brunet P, Capo C, Dellacasagrande J, et al. IL-10 synthesis and secretion by peripheral blood mononuclear cells in haemodialysis patients. Nephrol Dial Transplant. 1998;13: 1745-1751
61. Girndt M, Kohler H, Schiedhelm-Weick E, at al. Production of interleukin-6, tumor necrosis factor alpha and interleukin-10 in vitro correlates with the clinical immune defect in chronic hemodialysis patients. Kidney Int. 1995; 47:559-565
62. Girndt M, Sester U, Kaul H, Köhler H. Production of proinflammatory and regulatory monokines in hemodialysis patients shown at a single cell level. J Am Soc Nephrol 9:1689-1696, 1998
63. Heidenreich S, Schmidt M, Bachmann J, Harrach B. Apoptosis of monocytes cultured from long-term hemodialysis patients. Kidney Int. 1996; 49:792-799
64. Carracedo J, Ramirez R, Madueno JA et al. Cell apoptosis and hemodialysis-induced inflammation. Kidney Int 2002; 61(supl80):89-93
65. Willheim M, Thien R, Schrattbauer K, et al. Regulatory effects of 1alpha,25-dihydroxyvitamin D3 on the cytokine production of human peripheral blood lymphocytes. J Clin Endocrinol Metab. 1999; 84: 3739-3744
66. Riancho JA, Zarrabeitia MT, de Francisco AL, Amado JA. Vitamin D therapy modulates cytokine secretion in patients with renal failure. Nephron 1993; 65: 364-368
67. Stenvinkel P, Barany P. Anaemia, rHuEPO resistance, and cardiovascular disease in end-stage renal failure; links to inflammation and oxidative stress. Nephrol Dial Transplant. 2002;17(supl 5):S32-S37
68. Himmelfarb J, Stenvinkel P, Ikizler A, Hakim RM. The elephant in uremia: oxidant stress as a unifying concept of cardiovascular disease in uremia. Kidney Int 2002; 62: 1524-1538
69. Mezzano D, Pais EO, Aranda E, et al. Inflammation, not hyperhomocysteinemia, is related to oxidative stress and hemostatic and endothelial dysfunction in uremia. Kidney Int. 2001; 60:1844-1850
70. Spittle MA, Hoenich NA, Handelman GJ, et al. Oxidative stress and inflammation in hemodialysis patients. Am J Kidney Dis. 2001; 38:1408-1413
71. Ikizler TA, Morrow JD, Roberts LJ, et al. Plasma F2-isoprostane levels are elevated in chronic hemodialysis patients. Clin Nephrol 2002; 58:190-197
72. Kalousova M, Zima T, Tesar V, et al. Relationship between advanced glycoxidation end products, inflammatory markers/acute-phase reactants, and some autoantibodies in chronic hemodialysis patients. Kidney Int 2003; 63 (supl 84): S62-S64
73. Pickup JC, Chusney GD, Thomas SM, et al. Plasma interleukin-6, tumor necrosis factor alpha and blood cytokine production in type 2 diabetes. Life Sci 2000; 67: 291-300.
74. Kado S, Nagase T, Nagata N. Circulating levels of interleukin-6, its soluble receptor and interleukin-6/interleukin-6 receptor complexes in patients with type 2 diabetes mellitus. Acta Diabetol 1999; 36: 67-72
75. Hocher B, Ziebig R, Altermann C, et al. Different impact of biomarkers as mortality predictors among diabetic and nondiabetic patients undergoing hemodialysis. J Am Soc Nephrol 2003; 14: 2329-2337
76. Davies SJ, Phillips L, Naish PF, RussellGI. Quantifying comorbidity in peritoneal dialysis patients and its relationship to other predictors of survival. Nephrol Dial Transplant 2002; 17: 1085-1092
77. Miskulin DC, Meyer KB, Martin AA, et al. Comorbidity and its change predict survival in incident dialysis patients. Am J Kidney Dis 2003; 41: 149-161
78. Van Manen JG, Korevaar JC, Dekker FW, et al. How to adjust for comorbidity in survival in ESRD patients: a comparison of different indices. Am J Kidney Dis 2002; 40: 82-89
79. Owen WF. C-reactive protein as an outcome predictor for maintenance hemodialysis patients. Kidney Int 1998; 54: 627-633
BIBLIOGRAFÍA: