
|
Paneles de Discussión
Paneais de Discussio |
PROGRESIÓN DE LA NEFROPATÍA IgALuis Carreras, Francesc Moreso y Rafael Poveda.Servicio de Nefrología. Hospital Universitario de Bellvitge. Barcelona. España4661lcb@comb.esIntroducción: La nefropatía por depósito de IgA (nIgA) es la más frecuente de las nefropatías primitivas1 aunque su incidencia varía en distintas regiones del mundo 2. En Europa se acepta que su frecuencia es de entre 15-40 nuevos casos por millón y por año3, 4, mientras en USA oscila entre 2-125. Referida al total de biopsias practicadas, parece ser más alta en Asia y sur de Europa, 20-40%, que en USA, donde se estima en un 2-10%6, probablemente por una política más restrictiva en la práctica de biopsias. Pese a que en las iniciales descripciones se definía como un proceso benigno, todos los autores coinciden en la frecuencia de su progresión hacia la insuficiencia renal7, aceptando comúnmente el mecanismo de daño glomerular: 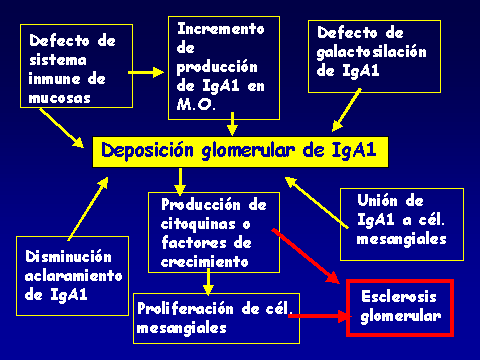 Aunque son diversos los factores de riesgo que se han visto involucrados en la evolución hacia la insuficiencia renal crónica (IRC), sólo sexo masculino, hipertensión arterial (HTA) y severa proteinuria se consideran, de modo indiscutible, como marcadores de mal pronóstico8. Más recientemente, se ha intentado añadir a estos marcadores determinados aspectos genéticos9 entre los que cabe destacar la relación con el polimorfismo del gen del enzima de conversión de la angiotensina (ECA)10, 11 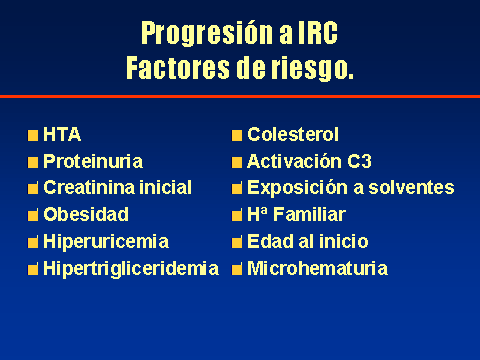 El estudio de su progresión se hace tanto más necesario cuanto que se carece, por el momento, de un tratamiento eficaz. En este sentido, indicadores clínicos, índices de laboratorio, datos anatomopatológicos, respuesta a la terapia y polimorfismo genético se han intentado convertir en predictores de la progresión12, 13. También en nuestro Servicio es la nefropatía primitiva de mayor incidencia: Alrededor de 10,5 nuevos casos por millón y por año. Un 16,02 % del total de las biopsias practicadas presentaban depósito mesangial de IgA, excluyendo la nefropatía lúpica, lo que unido a su alarmante evolución hacia la insuficiencia renal la convierte en objeto de estudio preferente. Además, su variable presentación clínica, la diversidad de lesiones anatomopatológicas8 que acompañan la presencia de depósito mesangial de IgA, sus diferentes formas de evolución14, 15, la recidiva postrasplante renal16 y su asociación con otros procesos17 hacen de esta entidad no sólo un problema de interpretación sino uno de los mayores retos de la Nefrología. Material y Métodos: Desde 1974 hasta la actualidad, han sido diagnosticados en nuestro Servicio, mediante biopsia renal, 309 pacientes: 79 mujeres y 230 varones, con edades comprendidas entre los 15 y los 78 años, con un promedio de 38,82 ± 15,96 a., los cuales han tenido un periodo de seguimiento de 5,95 ± 6.02 a.  Han supuesto el 16,02 % del total de las biopsias practicadas sobre riñón nativo. 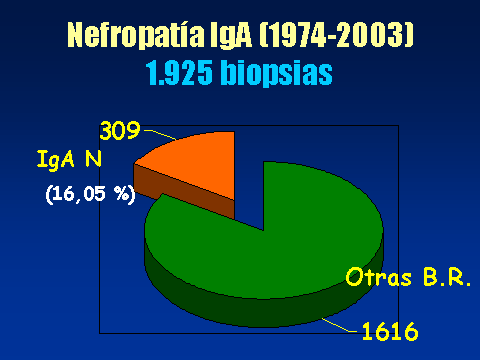 Fueron considerados factores de riesgo para la progresión hacia la insuficiencia renal: Sexo, edad, TA, creatinina inicial, colesterol total, urato, albúmina plasmática, proteinuria de 24 h, daño intersticial, IgA plasmática y codeposición de IgG en la biopsia renal a los que se aplicaron análisis univariantes (t de student) y multivariante.  Se midió el volumen intersticial cortical mediante la técnica de "point counting" 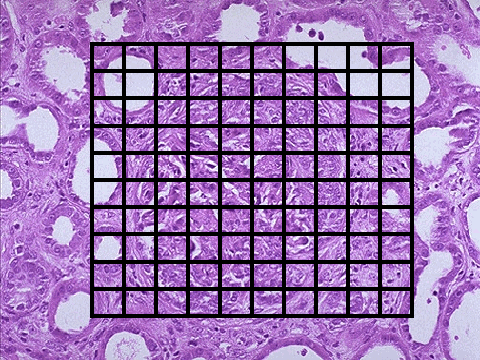 Hemos subdividido a los pacientes afectos de nIgA en cuatro grupos: Idiopáticos, afectos de Púrpura de Schonlein Henoch (PSH) que cursaban con nefropatía, hepatópatas crónicos y asociados a otras enfermedades concomitantes cuya participación en la patogenia de la nIgA no es descartable18, 19, 20: La nIgA se ha relacionado con anormalidades en la producción de IgA inducida por estimulación de sus epitelios secretores, intestinales o respiratorios y por componentes IgA de la dieta pero, también la IgA producida en médula ósea o los factores IgA reumatoides pueden verse involucrados en otros procesos, lo que sugiere un origen no mucoso de la inmunoglobulina. La relación de la nIgA con adenovirus, alteraciones del complemento, TNF, niveles de IL-6 o la respuesta al tratamiento de la enfermedad asociada parecen reafirmarlo. Por ello, creemos operativo prestar atención a este cuarto grupo formado por asociación con neoplasias, enfermedades sistémicas, alteraciones epiteliales o infecciosas:  Además, ante la posibilidad de que pudiera haber factores genéticos que afectaran al SRAA, se estudió el polimorfismo del gen del ECA, mediante reacción en cadena de la polimerasa (PCR) en un grupo de 89 pacientes, 68 varones y 21 mujeres, con edades comprendidas entre los 18 y los 78 años, con un promedio de 40,08 ± 14,69 a.  Disponemos de tres grupos según el polimorfismo del gen del ECA: delección-delección (DD), inserción-delección (ID) e inserción-inserción, (II). Todos los valores se expresaron como números absolutos para las variables cualitativas y como la media ± desviación estándar para las variables cuantitativas. El análisis estadístico entre los tres grupos y las variables cualitativas (sexo, clasificación, status, etc) se ha realizado mediante chi cuadrado. El análisis respecto a variables cuantitativas (edad, creatinina, urea, etc) se ha llevado a cabo mediante ANOVA (análisis de la varianza). Se ha considerado p significativa aquella <0.05 "two-tailed" La progresión de la insuficiencia renal se valoró como la pendiente de la recta inverso de la creatinina sérica versus tiempo, estimada mediante el método de los mínimos cuadrados  Resultados Aunque gran número de pacientes fueron diagnosticados a partir del hallazgo de microhematuria detectada en controles rutinarios o bien acudieron a su médico ante la presencia de macrohematuria, otros presentaron diferentes formas de inicio: 48 debutaron con síndrome nefrótico, 29 como una glomerulonefritis aguda, en 18 se observó insuficiencia renal rápidamente progresiva (IRRP), 28 reunieron criterios de hipertensión arterial maligna y 55 diagnosticados de PSH con afectación renal fueron motivo de ingreso hospitalario. Los pacientes que presentaron una IRRP demostraron en su biopsia depósito mesangial de IgA y presencia de semilunas en diverso porcentaje de afectación glomerular, aunque la detección de ANCA resultó siempre negativa. 142 pac (42 %) evolucionaron hacia la IRC, de los que 64 se hallaban en programa de hemodiálisis periódica o habían sido trasplantados, a los 5,95 años de seguimiento medio.. 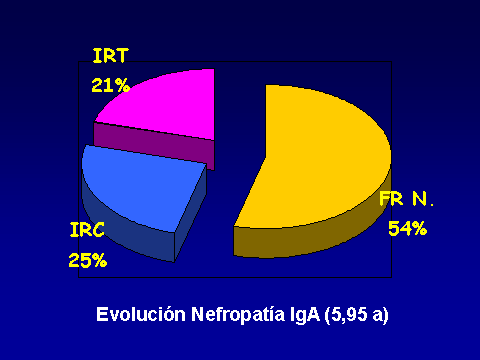 El depósito de IgA acompañaba diferentes formas anatomopatológicas: En once casos había reacción extracapilar; cuatro presentaban lesiones mínimas; otros cuatro glomerulopatía membranosa; dos presentaron patrón lineal, uno de los cuales evolucionó como síndrome de Goodpasture, con antiGBM IgA positivos e IgG negativos21 y uno ofrecía el aspecto histológico de glomerulonefritis membranoproliferativa. La evolución de los cuatro subgrupos de nIgA fue similar, con parecidos porcentajes de progresión hacia la IRC pero debemos tener en cuenta el evidente sesgo existente en los afectos de PSH y de hepatopatía crónica dado que sólo atendimos a aquellos que cursaban con afectación renal de los que algunos no pudieron ser biopsiados por los transtornos de coagulación propios de dicha hepatopatía.. Los pacientes que debutaron con síndrome nefrótico evolucionaron hacia la insuficiencia renal en un 60% de los casos. Mientras que entre los que presentaron hipertensión maligna, sólo el 10,71 % mantenían función renal normal a los casi seis años de seguimiento. Coincidiendo con lo descrito en la progresión de cualquier nefropatía, en análisis univariante eran numerosos los factores que podían considerarse como predictivos de mal pronóstico: 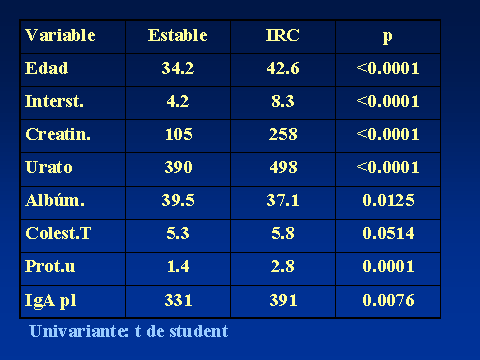 Pero, sólo extensión del daño intersticial, creatinina, proteinuria e hipertesión arterial iniciales lo reafirmaban en el multivariante: 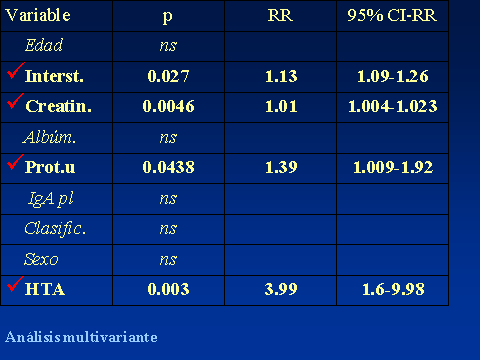 La distribución por genotipos (DD, ID e II fue similar tanto en la población control de nuestro laboratorio como en los diferentes tipos de nIgA (idiopática, PSH, asociada a hepatopatía crónica o relacionada con otros procesos) En análisis univariante (Anova y Scheffe para las comparaciones individuales entre grupos) del polimorfismo del gen del ECA frente a edad, volumen intersticial medido con el 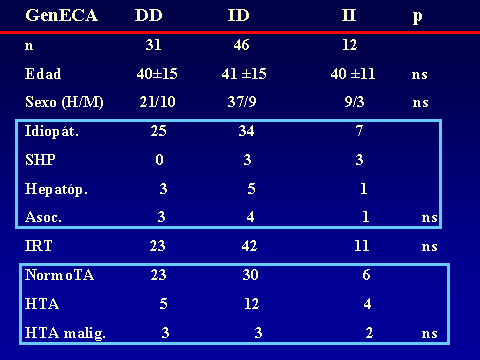 método de counter point, creatinina inicial, albúmina e IgA plasmáticas, colesterol total, urato, proteinuria e HTA, no se hallaron resultados significativos: 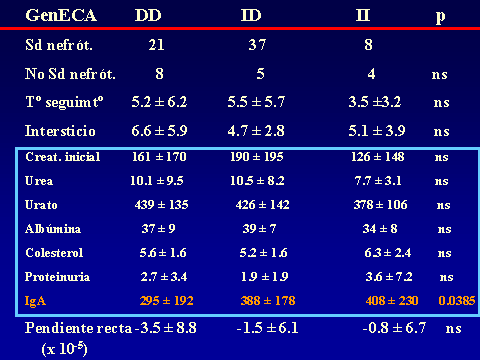 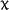 2 de gen del ECA versus sexo, subgrupos de nIgA, Sd nefrótico, TA y presencia de IRC no fue significativo 2 de gen del ECA versus sexo, subgrupos de nIgA, Sd nefrótico, TA y presencia de IRC no fue significativo
En nuestra serie, y en contra de lo señalado, no hallamos asociación del alelo D con hipertensión arterial Aunque de manera no significativa, el sexo femenino parece efectuar un papel protector entre los pacientes con alelo II o ID, de los que sólo una paciente presentó IRC Solamente se halla una relación válida entre el polimorfismo del gen y los niveles séricos de IgA lo que resulta, por el momento, de difícil interpretación. La pendiente de la recta inverso creatinina versus tiempo para valorar la progresión de la nefropatía IgA hacia la insuficiencia renal resultó ser cuatro veces más negativa en el grupo DD que en el II, aunque no alcanzó significación estadística. 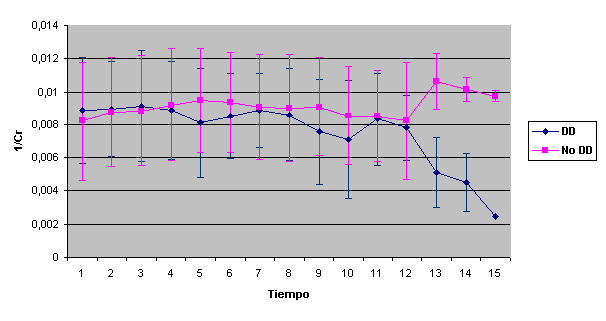 También se agruparon los pacientes DD contra los no DD (la pendiente en este nuevo grupo es de –1.3 ± 3.8 * 10 –5) y tampoco alcanzó nivel significativo. La amplitud de la SD resulta excesivamente amplia, lo que obliga a estudiar más casos para obtener signidficación 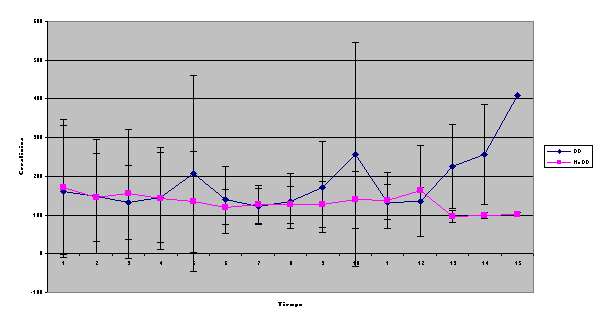 Dado que la pendiente de la recta no alcanza nivel significativo, hemos analizado también la supervivencia en cada grupo mediante el método de Kaplan-Meier comparando los grupos mediante el análisis de log-rank, lo que permite tener un resultado significativo (p= 0.0390) 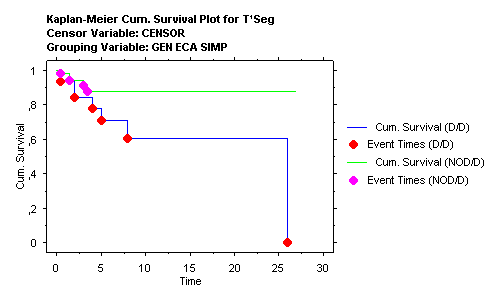 Discusión: La elevada frecuencia, su mal pronóstico, las diferentes formas clínicas de presentación, sus variaciones en las formas anatomopatológicas y la ausencia de un tratamiento eficaz, incluso su recidiva posttrasplante renal, hacen de la nIgA uno de los mayores problemas actuales de la Nefrología. Además de la mayor afectación y severidad en el sexo masculino, resulta obvio que valores iniciales de creatinina, grado de proteinuria, presencia de hipertensión arterial y extensión del daño intersticial22 resultan marcadores de mal pronóstico, siendo la presencia de hipertensión maligna o de síndrome nefrótico en el inicio los más acusados. Pacientes con creatinina superior a 150 m mol/l y proteinuria superior a 1 g/24 h presentaban una supervivencia de la función renal del 21 %, mientras que entre los que no alcanzaban estos valores era del 99 %23 La presencia de semilunas en los que presentaron IRRP reafirma el caracter de vasculitis de la afectación renal. En contra de lo descrito13, 22, 24 no hallamos positividad en los ANCA IgG ni, tampoco, en las contadas ocasiones que pudimos practicar ANCA IgA. Creemos importante señalar, sin embargo, la aparición de un síndrome de Goodpasture, con anticuerpos antiGBM IgA, negativos para IgG, en un proceso iniciado como PSH21 lo que podría justificar algunas de las hemorragias pulmonares descritas en el curso de PSH. El SRAA está involucrado en la pérdida de la función renal en diferentes procesos por su participación en el control de la tensión arterial; eritropoyesis, dada su unión a la producción de eritropoyetina endógena en los fibroblastos peritubulares renales o como se deduce de la anemización observada en tratamientos con IECA ó ARA II y por su relación con los mediadores de inflamación, ya que incrementa la producción de endotelina lo que induce la proliferación células musculares. Los genes que codifican ECA y angiotensinógeno parecen estar asociados a hiperfuncionamiento del SRAA. La elevada actividad de angiotensinógeno II y el descenso de niveles de bradiquinina van en detrimento de la respuesta glomerular a la injuria, acentuando la pérdida de función renal. En nuestro estudio el gen del ECA no parece tener relación con la menor incidencia observada en el sexo femenino, ni se observan variaciones en los subgrupos de nIgA y su presencia entre quienes presentaban síndrome nefrótico, HTA e IRC no fue significativa. En contra de lo señalado, no hallamos asociación del alelo D con hipertensión arterial. Aunque de manera no significativa, el sexo femenino parece efectuar un papel protector entre los pacientes con alelo II o ID, de los que una sola paciente presentó IRC. La pendiente de la recta del inverso de la creatinina sérica resultó ser más acusada (-3,5 ± 8,8 x10-53,5 en el grupo con genotipo DD que en el resto (–1.3 ± 3.8 x 10 –5). Aunque la aparición de IRC no sea significativa en ninguno de los tres grupos, parece existir una mayor rapidez de progresión en los portadores de genotipo DD. En conclusión, pese a ignorar si los pacientes iniciaron su proceso, como tantos otros, con una aparentemente inofensiva microhematuria y con posterioridad dieron lugar a los cuadros clínicos por los que fueron diagnosticados, debemos admitir que sexo masculino, extensión de daño intersticial, grado de proteinuria e hipertensión arterial están involucrados en la progresión hacia la IRC, siendo aquellos que presentan hipertensión maligna y síndrome nefrótico los de peor pronóstico, mientras que la posesión del haplotipo DD del gen del ECA parece indicar una mayor aceleración en la pérdida de la función renal. BIBLIOGRAFIA: 1.- D’Amico G. The commonest glomerulonephritis in the world: IgA nephropathy. Q. J. Med 1987;245:709-727 2.- Colin C. Geddes, Virpi Rauta, Carola Gronhagen-Riska et al. A tricontinental view of IgA nephropathy. Nephrol Dial Transplant 2003, 18: 1541-154 3.- Simon P, Ramee MP, Autuly V et al. Epidemiology of primary glomerular diseases in a French region: variations according to period and age. Kidney Int 1994;46: 1192-1198 4.- Stratta P, Segoloni GP, Canavese C et al. Incidence of biopsy proven primary glomerulonephritis in an Italian provice. Am J. Kidney Dis 1996;27: 631-639 5.- Wyatt RJ, Julian BA, Bachler RW et al. Epidemiology of IgA nephropathy in central and eastern Kentucky for the period 1975 through 1994: Central Kentucky Region of Southeastern United States IgA nephropathy DATABANK Project. J. Am Soc Nephrol 1998;9:853-858 6.- Donadio JV, Grande JP. IgA nephropathy. N Engl J Med 2002;347;10:738-748 7.- Radford MG, Donadio JV, Bergsthral EJ, Grande JP. Predicting reanl outcome in IgA nephropathy. J Am Soc Nephrol 1997;8:199-207 8.- Floege J, Feehally J. IgA nephropathy: Recent Developments. J Am Soc Nephrol 2000; 11: 2395-2403 9.- Waga I, Yamamoto J, Sasai H et al Altered mRNA expression in renal biopsy tissue from patients with IgA nephropathy. Kidney Int. 2003 Oct;64(4):1253-126 10.-Syrjanen J, Huang XH, Mustonen J et al. Angiotensin-converting enzyme insertion/deletion polymorphism and prognosis of IgA nephropathy. Nephron. 2000;86(2):115-121. 11.- Narita I, Goto S, Saito N et al. Interaction between ACE and ADD1 gene polymorphisms in the progression of IgA nephropathy in Japanese patients. Hypertension. 2003;42(3):304-309. 12.- Floege J, Feehally J. IgA nephropathy recentes developments. J Am Soc Nephrol 2000;11(12): 2395-2403 13.- Donadio JV, Grande JP. IgA nephropathy. N Engl J Med 2002;5,347(10):738-748 14.-Ferrario F, Rastaldi MP, Napodano P. Morphological features in IgA nephropathy. An Med Interne 1999; 150(2): 108- 116 15.- Ramírez SB, Rosen S, Niles J et al. IgG antineutrophil cytoplasmic antibodies in IgA nephropathy: a clinical variant? Am J Kidney Dis 1998; 31(2):341-344 16.- Martin SJ, Audrain MA, Baranger T et al. Recurrence of immunoglobulin A nephropathy with immunoglobulin A antineutrophil cytoplasmic antibodies following renal transplantation. Am J Kidney Dis 1997; 29(1):125-131 17.- Mustonen J, Svrjanen J, Rantala I et al.Clinical course and treatment of IgA nephropathy. 18.- Strobel ES, Fritschka E. Renal diseases in ankylosing spondylitis: review of the literature illustrated by case reports.Clin Rheumatol 1998;17(6):524-530 19.- Stokes MB, Alpers CE. Combined membranous nephropathy and IgA nephropathy. Am J Kidney Dis 1998;32(4):649-56 20.- Ahuja TS, Funtanilla M, de Groot JJ et al. IgA nephropathy in psoriasis. Am J Nephrol 1998;18(5):425-9 21.- Carreras L,Poveda R, Bas J et al. Goodpasture syndrome during the course of a Henoch-Schönlein Purpura (HSP). Am J Kidney Dis 2002;39; 5, Electronic pages 22.-Allmaras E, Nowack R, Andrassy K et al. Rapidly progressive IgA nephropathy with anti-myeloperoxidase antibodies benefits for immnunosuppression. Clin Nephrol 1997;48(5):269-273 23.- Rauta V, Finne P, Fagerudd J et al. Factors associated with progression of IgA nephropathy are related to renal function--a model for estimating risk of progression in mild disease.Clin Nephrol. 2002;58(2):85-94 24.- Fidder HH, Apter S, Langevitz P et al. Positive antineutrophil cytoplasmic antibodies-associated vasculitis presenting with hemoptisis and a mediastinal mass. Chest 1999;115(5): 1473-1475 |