
|
Paneles de Discussión
Paneais de Discussio |
CAMBIO DE PROTAGONISMO DEL HUESO ADINAMICO EN LA INSUFICIENCIA RENAL CRONICA EN LOS ULTIMOS 20 AÑOS.Xavier de las CuevasHospital de Terrassa. Barcelona. SpainXCuevas@csdt.es
El/los criterios utilizados para el diagnostico del hueso adinámico o de bajo remodelaje óseo continúan siendo los mismos y se podrían resumir 1,2,3:
2.-Un numero disminuido de osteoblastos con un numero normal o descendido de osteoclastos. 3.-Un defecto en la formación de matriz ósea y de la mineralizacion sin un grosor de osteoide aumentado y ausencia de fibrosis. 4.- Presencia de "minimodeling" 4  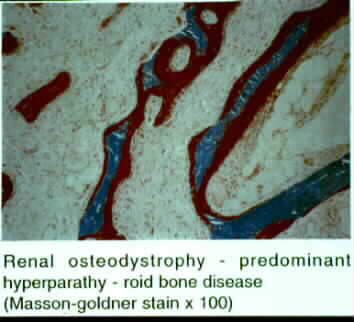 Las otras formas histologicas - histomorfometricas óseas de la ODR son:
2.-La osteomalacia o de bajo remodelaje oseo. 3.- La forma mixta. 4.- Y las formas menores o de hueso prácticamente normal que son objetivados cuando la insuficiencia renal es muy ligera o moderada.
En estos últimos años lo que se ha podido comprobar es que el hueso adinámico que era muy infrecuente en los primeros estudios ha incrementado su presencia en forma variable según los estudios consultados tanto en los pacientes en diálisis como en la etapa de predialisis1, 5, 6, 7, 8, 9. Este incremento proporcional del hueso adinámico ha sido muy llamativo y basta recordar la experiencia de Malluche 2 en que hace la primera descripción en 1984 para posteriormente representar el 20% de su serie de 1991. En las series actuales representa una incidencia que oscila entre 30 al 60% en diálisis y de 10 a 40% en predialisi 6,10,11,12,13 . Un comentario aparte que merece ser expuesto es que la indicación de la biopsia ósea en la practica asistencial ha perdido protagonismo en la actualidad a consecuencia de ser una exploración cruenta y que la información que proporciona comporta habitualmente pocos cambios terapéuticos debido al mejor conocimiento y relación entre los hallazgos histologicos y la clínica y los resultados de laboratorio(PTH-i,...) 9 Este salto cualitativo del hueso adinámico en este periodo de tiempo, creo que es debido a cambios en la población a estudio y a los métodos de tratamiento de esta población con insuficiencia renal crónica. Las posibles causas-mecanismos patogenéticos implicados en el hueso adinámico descritos son 6, 10, 14, 2, 5, 9, 15, 11, 16, 7, 17, 18, 19, 20, 21 : genero, edad avanzada, diabetes, raza blanca, la técnica de diálisis (a pesar de estudios contradictorios parece que la diálisis peritoneal se acompaña de una mayor proporción de adinámicos), el mayor aporte de calcio tanto externo a través de los quelantes del fósforo que llevan calcio como las diferentes concentraciones del calcio en el baño de diálisis, los derivados de la vitamina D3 en el tratamiento del HPTs con observaciones que también sugieren una acción directa del calcitriol suprimiendo la actividad osteoblastica, la acidosis metabólica por su acción inhibitoria sobre la función celular osteoblastica y paratiroidea, la hipermagnesiemia, el tiempo de diálisis, el aluminio, el stronium, antecedentes de paratiroidectomia , nefrectomia bilateral, portador de injertos no funcionante, baja ingesta proteica en especial en personas mayores con un descenso del fósforo y de la PTH, los niveles sericos de calcio, fósforo y PTH, el papel de factores locales o sistemicos de citokinas, factores de crecimiento o la glicosilacion avanzada de proteínas que puede modificar la matiz proteica inhibiendo la actividad osteoblastica y también la secreción hormonal paratiroidea a la respuesta hipocalcemica , una "down regulation" de los receptores de la PTH de los osteoblastos en los pacientes con una insuficiencia renal crónica terminal y otras. Todos estos posibles causas-mecanismos implicados pueden resumirse en que el hueso adinámico podría ser la consecuencia de un relativo-absoluto hipoparatiroidismo y/o una disfunción del osteoblasto 3,12 y mas recientemente 4 el estrés dinámico externo regulado por la ley de Woff. De los posibles factores de riesgo descritos si que merece un comentario individual es el aluminio y su cambio de protagonismo en los últimos años. El aluminio depositado en el frente de calcificación del hueso trabecular 22 se le implico como uno de las causas principales del hueso adinámico 8 en lo que se llamo la "osteopatia aluminica fracturante" y que era la consecuencia de dializar con niveles elevados de aluminio en los líquidos de diálisis y la utizacion de quelantes del fósforo de hidróxido de aluminio 2. Fue alrededor del inicio de la década de los 90 cuando aparecieron las primeras publicaciones especialmente de Europa en que el aluminio no explicaba la presencia del hueso adinámico y que se ha visto posteriormente confirmado por los numerosos trabajos publicados describiendose actualmente como hueso adinamico idiopatico 1,4,12,14,23,24 Con respecto al punto de vista clínico el hueso adinámico y muy especialmente en los pacientes en tratamiento sustitutivo renal ha variado su protagonismo en los últimos años y a pesar de que respecto a la población general y a los otros pacientes en hemodiálisis (otras formas histologicas óseas) se han descrito un incremento en la riesgo de presentar fracturas de cuello de fémur 25 y vertebrales 26 , pero clínicamente es prácticamente asimptomatico. Quedaría el interrogante de si este incremento de fracturas es consecuencia del hueso adinámico por si mismo o que su presencia es mas frecuente en pacientes de edad mas avanzada y diabéticos con la posible consecuencia de tener mayor probabilidad de presentar caídas espontaneas o también de tener una mayor osteopenia que no siempre es consecuencia de la presencia de adinamia 4 En la actualidad el hueso adinámico continua siendo un hallazgo patológico por lo que diversos autores siguen aconsejando evitar el hipoparatiroidismo indicando maniobras terapéuticas par favorecer un cierto grado de HPTs como dializar con calcio de cuba mas bajos y otros 27. Pero lo que el hueso adinámico, a mi entender, está adquiriendo un protagonismo relevante en la practica clínica es como posible expresión de que su presencia puede implicar un incremento del riesgo en la morbi-mortalidad de estos pacientes a través de que estos pacientes presentan un metabolismos calcio-fosforo con niveles mas bajos de PTH 28,29,una mayor tendencia a la hipercalcemia y de depósitos extraoseos de calcio 30,31,y una mayor proporción de efectos secundarios al tratamiento con quelantes de fósforo y derivados de la vitD3 32. Por este motivo y para mejorar el remodelaje óseo junto al fenómeno de la resistencia ósea a la PTH se ha recomendado que los pacientes especialmente en diálisis tengan niveles de PTH de entre 2-4 veces por encima de la normalidad 33,34 y si era necesario indicar bajos niveles de calcio para provocar mediante estímulos hipocalcemicos el mejorar la relativo hipoparatiroidismo en especial de los pacientes diabéticos 35. Esta recomendación se hacia con la determinación de PTH "intacta (IRMA assay) pero con las nuevas publicaciones en que demuestra que también se determinan fragmentos de hormona como (PTH 7-84) que tienen acción inhibitoria , tienen que revalorarse en función de la metodología en que se ha determinado la PTH. 34 En resumen El hueso adinámico de los pacientes con insuficiencia renal crónica que con los mismos criterios histologicos que fueron descritos ha experimentado cambios importantes en los últimos años con un incremento significativo hasta representar en algunas series la lesión histomorfometrica mas prevalente en los pacientes tanto en predialisis como en diálisis. Actualmente continua siendo una entidad nosologica patológica pero su importancia mas que por el significado clínico óseo que representa, y esta adquiriendo importancia como un factor de riesgo cardiovascular por las implicaciones que conlleva el metabolismo fosfo-calcio y las calcificaciones extraoseas. Al mismo tiempo el mejor conocimiento de los posibles factores implicados en su fisiopatologia ha hecho que se tenga que hacer una revisión critica del tratamiento del HPTS de estos pacientes para promocionar tratamientos con menos efectos secundarios que los actuales y que la indicación y retirada de los fármacos sea mas precisa a la necesidad individual de la cada paciente 36. En este sentido la nuevas Vitaminas D3 con menos efectos hipercalcemicos , nuevos quelantes del fósforo sin contenido en calcio 37,38, la futura introducción de calciomimeticos 39 y muy especialmente el cambio conceptual del medico en la individualización y adecuación de la diálisis a cada paciente hace que el futuro sea mejor que el pasado y presente.36,40,11,41 . Bibliografia:
|