
|
Paneles de Discussión
Paneais de Discussio |
"PAPEL CARDIOVASCULAR DEL FÓSFORO"Elvira FernándezServei de Nefrologia. Hospital Universitari Arnau de Vilanova. Lleida, Spainefernandez@arnau.scs.esLa mortalidad de los pacientes en tratamiento renal sustitutivo no ha mejorado en la última década a pesar de los avances tecnológicos y del seguimiento generalizado de las guías de práctica clínica. La mitad aproximadamente de estos pacientes mueren por enfermedad cardiovascular y tienen de 10 a 30 veces mayor riesgo que la población general corregido por edad y sexo1. Estas cifras no sorprenden si tenemos en cuenta el perfil de pacientes que inician tratamiento renal sustitutivo. Según el Registro de enfermos renales de Cataluña el 20,6% de los pacientes que iniciaron diálisis en el año 2001 eran diabéticos, con una media de edad de 64 años y con elevada frecuencia de patologías asociadas como la hipertensión arterial, la diabetes, la cardiopatía isquémica y la enfermedad vascular periférica2.
Lo que realmente "sorprendió" a los nefrólogos fue el estudio de Block et al. realizado en 12.000 pacientes en hemodiálisis en USA, en el que emergen como factores de riesgo de mortalidad: un fósforo plasmático superior a 6.5 mg/dL y un producto CaXP superior a 72 mg2/dL2 3. Afinando más estos datos Levin et al. puntualizan que los pacientes con fósforo plasmático. > a 6.5 mg/dL tienen un riesgo de coronariopatía un 41% más elevado comparado con los que tienen un fósforo plasmático inferior4. En nuestro país existe una población de pacientes en hemodiálisis con menor proporción de diabéticos, sin el factor raza y con dosis de diálisis superiores que las de USA. Por ello, analizamos la mortalidad cardiovascular de nuestra población de diálisis durante un periodo de seguimiento de 6 años, incluyendo como variables factores relacionados con el metabolismo mineral, y de riesgo CV tradicionales y asociados a la IRC . Constatamos, que en nuestra área geográfica, la influencia del metabolismo fosfo-cálcico cobra aún mayor relevancia que en la población USA: un producto Ca X P superior a 52 mg2/dL2 tiene mayor riesgo de mortalidad, tomando como referencia un producto CaXP < a 52 (figura 1) . 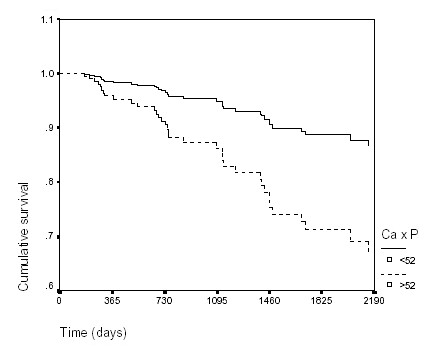 Figura 1: Supervivencia cardiovascular durante un periodo de seguimiento de 6 años de los pacientes con producto CaXP > e < a 52 mg2/dL2 . Ajustada para las variables incluidas en el análisis de Cox: edad, sexo, diabetes, tabaquismo, tiempo en hemodiálisis, horas de hemodiálisis /semana, Tensión arterial prediálisis, historia de hipertensión, diabetes, anticuerpos Virus hepatitis C, albumina, PTH (<12 pmol/L, entre 12 y 50 pmol/L y > 50 pmol/L).
Mecanismos por los que el elevado fósforo plasmático provoca enfermedad cardiovascular Cada vez es mayor la evidencia de que existe un nexo de unión entre enfermedad CV y metabolismo mineral. Estudios epidemiológicos muestran una asociación entre osteoporosis y mortalidad CV6,7. Nuevas técnicas de imagen no invasivas (EBCT) relacionan el contenido de calcio en las coronarias y la mortalidad en la población general y en la de diálisis. Raggi et al.8 encuentran que la extensión de la calcificación coronaria en adultos en hemodiálisis se asocia a concentraciones mas elevadas de calcio y fósforo séricos. Una muestra evidente de esta relación es que los ratones Knock-out para la osteoprotegerina desarrollan calcificaciones vasculares masivas, osteoporosis y mueren prematuramente9. Además la evidencia de que la calcificación vascular es un proceso activo de osteogénesis en la pared del vaso, refuerza esta relación entre tejido óseo y vascular. Entre los factores inductores del cambio fenotípico de las células de músculo liso vascular en osteoblastos de nuevo aparece el fósforo cómo el principal culpable. Jono et al.10, demostraron en células de músculo liso vascular en cultivo, que la concentración de fósforo incrementa de una manera dosis dependiente la expresión de proteínas propias del hueso cómo la osteocalcina y la cbfa-1. Además experimentos realizados en ratas sometidas a nefrectomía subtotal demuestran que los animales sometidos a una dieta alta en fósforo, comparados con los que recibían una dieta baja en fósforo, desarrollaban mayor fibrosis cardiaca y engrosamiento de la pared de la microvasculatura miocárdica11. Por tanto el fósforo es arteriotóxico a través de varias vías:
b) favorece la calcificación vascular elevando el CaXP; c) estimula el desarrollo del hiperparatiroidismo secundario. La parathormona (PTH) ejerce un efecto favorecedor de la fibrosis sobre el corazón y la pared del vaso12; d) Favorece de una manera directa la fibrosis cardiaca y la hipertrofia de la pared arterial11. Estas alteraciones provocan anomalías estructurales y funcionales de los vasos y el corazón. Quizás la consecuencia más evidente para el nefrólogo es la isquemia sobre los territorios afectos. Sin embargo, la evidencia actual implica las anomalías en la distensibilidad como un importante mediador de los eventos CV en la IRC. Cuando en animales de experimentación se sustituye la aorta por un tubo rígido se observa Insuficiencia cardiaca congestiva, hipertensión, hipertrofia ventricular izquierda, insuficiencia cardiaca y muerte13. Los nefrólogos clínicos estamos familiarizados con la imagen de Aortas masivamente calcificadas que probablemente sitúan al paciente en unas condiciones similares a la provocada en estos animales de experimentación. El aumento en la TAS, el descenso de la TAD y la PP reflejan la rigidez arterial y a su vez son potentes predictores de mortalidad cardiovascular en la IRC. Un reciente estudio epidemiológico en 37.000 pacientes en HD14 demuestra que una presión del pulso elevada es un factor de riesgo de mortalidad y que la concentración de fósforo plasmático, se asocia a la presión del pulso. También, Foley et al.15 encuentran en 433 pacientes incidentes en diálisis que la presión del pulso y el P pl. se asocian con HVI y dilatación del VI y ambos factores fueron predictores de mortalidad (2 años de seguimiento) Su papel patogénico se inicia de forma "silente" y "precoz" en la IRC Lo que justifica el adjetivo de "silente" es que un nivel sérico de fósforo dentro de la normalidad no descarta que exista balance positivo de dicho elemento Aproximadamente cuando el paciente tiene unos 60 ml/mn de Aclaramiento de creatinina, desciende el nivel de vitamina D, se incrementa la PTH y lo más importante: desciende la capacidad de excreción de fósforo y calcio por el riñón. Si el ingreso en el organismo de ambos elementos permanece constante, el balance es positivo y la PTH estimulada intenta compensar favoreciendo su eliminación urinaria (figura 2). Decimos que se inicia precozmente, porque es al inicio del estadío 3 de la enfermedad renal crónica (30-59 ml/mn/1.73 m2 de Filtrado Glomerular) cuando la sobrecarga de fósforo empieza a estimular la función paratiroidea (figura 2). Ya antes del inicio de diálisis la prevalencia de calcificaciones vasculares es superior a la de la población general. Desconocemos si el fósforo induce la calcificación vascular en estadios iniciales de IRC pero lo que si es seguro es que está poniendo en marcha la cadena de eventos que la van a favorecer. 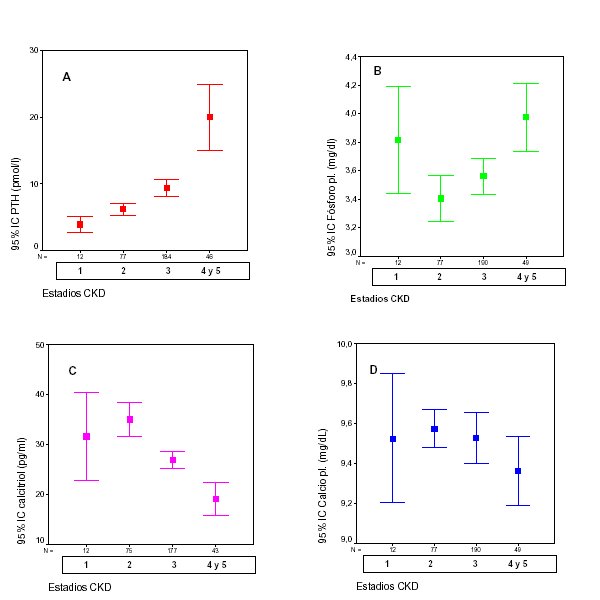 Figura 2: Niveles de PTH (A), fósforo (B), calcitriol (C) y calcio plasmáticos (D) y evolución de la fosfaturia (E) en los diferentes estadios de CKD.
Pacientes procedentes del Hospital de Galdakao y Arnau de Vilanova de Lleida ¿Cómo controlarlo? Estas recientes evidencias epidemiológicas y moleculares obligan a los nefrólogos a contemplar las alteraciones del metabolismo mineral teniendo en cuenta prioritariamente su repercusión en la enfermedad CV. Ello requiere un cambio en la política de tratamiento porque los intereses del hueso y del vaso no van siempre el mismo sentido. PE: aportar calcio y/o vitamina D puede frenar el hiperparatiroidismo secundario pero favorece las calcificaciones vasculares en presencia de un fósforo elevado. Lo que si puede establecerse como un interés común del hueso, de la glándula paratiroidea, del vaso e incluso del riñón (ya que el fósforo es nefrotóxico y contribuye a la progresión de la IRC) es evitar la hiperfosforemia. Además, teniendo en cuenta que el daño sobre los diferentes órganos y tejidos es en gran medida irreversible, debe actuarse de una manera preventiva. El problema comienza cuando queremos trasladar lo que hemos aprendido a nivel molecular y epidemiológico a la arena clínica. Es decir, ante un paciente concreto: ¿cuando y cómo actuar? El control del metabolismo fosfo-cálcico estricto durante la progresión de la IRC presenta muchas dificultades. La mayoría de los pacientes acuden a la consulta en fases avanzadas de IRC. Por tanto, solo podemos actuar preventivamente en aquellos pacientes que tienen una patología renal de larga evolución y que han sido remitidos a la Consulta de Nefrología al inicio de su enfermedad. En los pacientes en los que podamos hacer prevención debe valorarse de una manera individualizada el riesgo de los diferentes tipos de osteodistrofia. Si se prevé que la evolución natural va a ser el desarrollo de hiperparatiroidismo debe actuarse en estadios iniciales de IRC para evitar la sobrecarga de fósforo mediante dietas adecuadas. Para valorar la sobrecarga de fósforo precozmente debemos tener en cuenta no sólo su nivel sérico en un momento puntual del seguimiento sino los valores previos y sobre todo el valor de PTH de la misma determinación analítica. Ya que la colaboración del paciente para disminuir la ingesta proteica es imprescindible, el paciente debe ser asesorado del riesgo de este elemento. Además el nefrólogo debe perder el miedo al riesgo de desnutrición ya que debido a los hábitos culturales de las sociedades del "primer mundo" , el nivel de nuestra ingesta proteica habitual está muy por encima de las necesidades nutricionales (0,8 g/Kg/día). Desde el punto de vista del seguimiento del paciente, a la luz de la evidencia actual, debería añadirse la valoración de las calcificaciones vasculares con las técnicas de imagen a las que tengamos acceso. Todo ello, es un proceso complejo que requiere el control del especialista. No obstante las cifras del estudio INESIR, realizado en 406 pacientes que inician diálisis en 5 hospitales públicos de nuestro país, nos recuerdan que incluso en los servicios de Nefrología este control no es idóneo. Un 60% de los pacientes controlados menos de 6 meses por un nefrólogo tienen un fósforo plasmático > a 6 mg/dL frente a un 42% en los controlados mas de 6 meses (datos no publicados). Es decir, existe una proporción importante de pacientes en los que el especialista no ha conseguido un control adecuado. Los datos anteriormente expuestos prueban el importante papel del fósforo fósforo en la elevada mortalidad CV de los pacientes con IRC. Sin embargo, muchas de las medidas para controlarlo están todavía bajo investigación. No existen quelantes del fósforo a nivel intestinal que puedan utilizarse en estadios iniciales de IRC. En la actualidad la medida más inocua es la dieta y los profesionales que las manejan son un bien escaso en nuestros hospitales. Por último, es necesario también eliminar los factores favorecedores: políticas de tratamiento con elevadas dosis de compuestos de calcio y vitamina D que han respondido en ocasiones a intereses comerciales. En el horizonte inmediato, el "modulador del sensor de calcio" AMG 073 nos ofrece la posibilidad de "frenar" el hiperparatiroidismo disminuyendo simultáneamente el producto CaXP. 1. Longenecker JC, Coresh J, Powe NR, Levey AS, Fink N, Martín A, Klag MJ: Traditional cardiovascular disease risk factors in diálisis patients compared with the general population: the CHOICE study. J Am Soc Nephrol 13: 1918-1927; 2002 2. Registre de malalts renals de Catalunya. Informe estadístic 2001 3. Block GA, Hulbert-Shearon TE, Levin NW, Port FK: Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic hemodialysis patients: A national study. Am J Kidney Dis 31(4):607-617, 1998 4. Levin NW, Hoenich NA: Consequences of hyperphosphatemia and elevated levels of the calcium-phosphorus product in dialysis patients. Curr Opin Nephrol Hypertens 10(5):563-568, 2001 5. Marco MP, Craver L, Betriu A, Belart M, Fibla J, Fernández E. Higher impact of mineral metabolism on cardiovascular mortality in a European hemodialysis population. Kidney int Suppl 85:111-114; 2003 6. Taal MW, Roe S, Masud T, Green D, Porter ©, Cassidy MJD. Total hip bone mass predicts survival in chronic hemodialysis patients. Kidney Int 63: 1116-1120; 2003-06-30 7. Von der Recke P, Hansen MA, Hassager ©: The association between low bone mass at the menopause and cardiovascular mortality. Am J Med 106: 273-278; 1999 8. Raggi P, Boulay A, Chasan-Tabar S, Amin NS, Dillon MA, Burke SK, Chertow GM: Cardiac calcification in adult hemodialysis patients. J Am Coll Cardiol 39: 695-701; 2002 9. Bucay N, Saroray I, Dunstan CR, Morony S, Tarpley J, Capparelli C, Scully S, Tan HL, Xu W, Lacey DL, Boyle WJ, Simonet WS: Osteoprotegerin-deficient mice developed early onset osteoporosis and arterial calcification. Genes Dev 12: 1260-1268; 1998 10. Jono S, McKee MD, Murry CE, Shioi A, Nishizawa Y, Mori K, Morii H, Giacelli CM,: Phosphate regulation of vascular smooth muscle cell calcificatio. Circ Res 87: 10-17; 2000 11. Amann K, Törning J, Kugel B, Gross ML, Tyralla K, El-Shakmak A, Szabo A, Ritz E. Hyperphosphatemia aggravates cardiac fibrosis and microvascular disease in experimental uremia 12. Amann K, Ritz E, Wiest G. Et al. A role of parathyroid hormone for the activation of cardiac fibroblasts in uremia. J Am Soc Nephrol 4: 1814-1819; 1994 13. Block G, Port FK. Calcium phosphate metabolism and cardiovascular disease in patients with chronic kidney disase. Sem Dial 16: 140-147; 2003 14. Klassen PS, Lowrie EG, Reddan DN, DeLong ER, Coladonato JA, Szczech LA, Lazarus JM, Owen WF. Association between pulse pressure and mortality in patients undergoing maintenance hemodialysis. JAMA 287: 1548-1555; 2002 15. Foley RN, Parfrey PS, Harnett JD, Kent GM, Martin CJ, Murray DC, Barre PE. Clinical and echocardiographic disease in patients starting end stage renal disease therapy. Kidney Int 47: 186-192; 1995 |