Abstract : Since its discovery in 1923, the parathyroid hormone (PTH), was thought to be the sole hormone capable of stimulating bone resorption, renal tubular calcium reabsorption, calcitriol synthesis, and urinary excretion of phosphate. However, in 1987, the PTHrP (PTH-related peptide), was demonstrated to share most of the biological actions of PTH through the activation of the same receptor. This receptor was cloned in 1992 and named PTH/PTHrP receptor or PTH-R1. Both, PTH and PTHrP bind with great affinity to PTH-R1 and stimulate a signal transduction system involving different G-proteins, phospholipase C, and adenylate cyclase. A third member of the PTH family, the TIP-39 (tuberoinfundibular peptide), binds and activates another PTH receptor (PTH-R2).
There is evidence for other PTH receptors, a PTH-R3, probably specific for PTHrP in keratinocytes, kidney, and placenta, and a PTH-R4 specific for C-terminal PTH fragments. Activating mutations in the PTH-R1 gene cause Jansen type metaphyseal chondrodysplasia, whereas inactivating mutations are responsible for Blomstrand type rare chondrodysplasia and enchondromatosis.
The renal and bone PTH-R1 expression is upregulated in vitamin D deficient rats and by endotoxin, interleukin-2, dexamethasone, T3, and TGF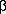 . On the contrary, PTH, PTHrP, angiotensin-II, IGF-1, PGE2, vitamin D, and chronic renal failure decrease its expression. In conclusions, the biological implications of the identification and cloning of different PTH receptors are at their beginning. The almost ubiquitous distribution of PTHrP and PTH-R1, the numerous PTHrP and PTH fragments, let us suppose the existence of other PTH-related receptors, and a great complexity of its potential actions on bone and mineral metabolism.
. On the contrary, PTH, PTHrP, angiotensin-II, IGF-1, PGE2, vitamin D, and chronic renal failure decrease its expression. In conclusions, the biological implications of the identification and cloning of different PTH receptors are at their beginning. The almost ubiquitous distribution of PTHrP and PTH-R1, the numerous PTHrP and PTH fragments, let us suppose the existence of other PTH-related receptors, and a great complexity of its potential actions on bone and mineral metabolism.
Key words: Parathyroid hormone, Parathyroid hormone-related peptide, Parathyroid Hormone receptor, Renal osteodystrophy, Review.
Resumen
Desde su descubrimiento en el año 1923, la hormona paratiroidea (PTH) era la única capaz de estimular la resorción ósea, la reabsorción tubular de calcio, la eliminación renal de fósforo y la síntesis de calcitriol. Sin embargo, en el 1987 se identificó el PTHrP (PTH-related peptide), el cual ejerce la mayoría de las funciones biológicas de la PTH a través del mismo receptor. Ese receptor, PTH/PTHrP o PTH-R1, fue clonado en el 1992. Las dos moléculas, PTH y PTHrP se ligan al él con gran afinidad y estimulan un sistema de transducción que implica la activación de diferentes proteínas G, la fosfolipase C y la adenilciclasa. Un tercer miembro de la familia PTH, el TIP-39 (tuberoinfundibular peptide), se liga y activa otro receptor de la PTH, el PTH-R2.
También, hay evidencias de la existencia de otros receptores de la PTH (PTH-R3, PTH-R4). Las mutaciones activadoras del PTH-R1 provocan la condrodisplasia metáfisaria de tipo Jansen y las mutaciones inactivadoras son responsables de otra condrodisplasia rara, la enfermedad de Blomstrand y de ciertas encondromatosis.
La expresión del PTH-R1 aumenta en el riñón y el hueso de ratas deficientes en vitamina D y en respuesta a las endotoxinas, la interleuquina-2, la dexametasona, la T3 y el 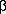 . Al contrario, la PTH, el PTHrP, la angiotensina-II, el IGF-1, la PGE2, la vitamina D y la insufficiencia renal crónica la disminuyen. En conclusión, las implicaciones biológicas del clonaje de los receptores de la PTH son innumerables. El hecho que el PTHrP y el PTH-R1 sean ubicuos y el hecho que hay varios fragmentos circulantes del PTHrP y de la PTH, supone la existencia de otros receptores específicos de esos fragmentos y por supuesto que la acción de esas moléculas sobre el metabolismo mineral y óseo es mucho más compleja de lo imaginado.
. Al contrario, la PTH, el PTHrP, la angiotensina-II, el IGF-1, la PGE2, la vitamina D y la insufficiencia renal crónica la disminuyen. En conclusión, las implicaciones biológicas del clonaje de los receptores de la PTH son innumerables. El hecho que el PTHrP y el PTH-R1 sean ubicuos y el hecho que hay varios fragmentos circulantes del PTHrP y de la PTH, supone la existencia de otros receptores específicos de esos fragmentos y por supuesto que la acción de esas moléculas sobre el metabolismo mineral y óseo es mucho más compleja de lo imaginado.
Palabras claves : Hormona paratiroidea, péptido relacionado a la PTH o PTHrP, Receptor de la hormona paratiroidea, Osteodistrofia renal, Revisión.
Introducción
La hormona paratiroidea (PTH) se fija y activa el receptor de type 1 (PTH-R1), el cual fue identificado y clonado por el equipo de H. Juppner en Boston en el año 1990 [1, 2]. Este es el principal receptor que utilisa la PTH para ejercer sus principales acciones biológicas, es decir la estimulación de la resorción ósea y del remodelaje óseo, la reabsorción tubular de calcio, la eliminación renal de fósforo y la síntesis de calcitriol [3]. La fisiología simplista de esos años comenzó a complicarse a partir del año 1987 cuando un groupo de investigadores de la universidad de Yale identificó el PTHrP, una proteina semejante a la PTH, resposable de los episodios hipercalcémicos observados en ciertos enfermos cancerosos [4, 5]. El efecto hipercalcémico es debido a que el PTHrP también se fija y activa el mismo PTH-R1 en el riñón y el hueso [6]. Además, recientement se ha sugerido que el PTHrP es mucho mas importante que la PTH en el desarrollo óseo embrionario [7].
Un tercer miembro de la familia de la PTH y del PTHrP existe desde hace poco, el TIP-39 (tuberoinfundibular peptide), es un neuropéptido el cual activa otro receptor de la PTH, el PTH-R2 [8, 9]. La expresión de este último predomina en el páncreas y en el hipotálamo. Por el momento, las funciones fisiológicas del TIP-39 no se conocen con precisión, pero se le atribuye una función de inhibidor natural de la PTH, sobretodo al fragmento TIP (7-39) el cual se fija al PTH-R1 sin activarlo y bloquea la acción de la PTH.
La existencia del PTH-R2 y son activación al ligarse con el TIP-39 podría explicar el doble effecto, estimulador e inhibidor, de la PTH sobre la proliferación celular. De hecho, el TIP-39 inhibe la proliferación de las células HEK293 transfectadas con el PTH-R2 [10]. Además, la administracion intracerebroventricular de TIP-39 reduce significantemente la concentración plasmática de vasopresina (ADH) en animales deshidratados, lo que sugiere un effecto central de esta molécula en la osmoregulación y baroregulación de la secreción de la ADH [11].
También, se ha propuesto que el TIP-39 podría ser un neuromodulador de la sensibilidad al dolor [12]. Finalemente, los ARN mensajeros del TIP-39 y del PTH-R2 se han encontrado en la paredes de los vasos sanguíneos renales, donde el TIP-39, como otros péptidos que se ligan al PTH-R2, tienen la facultad de vasodilatar esos vasos independientemente del PTH-R1. Esos resultados sugieren que TIP-39 y PTHrP podrían simultaneamente coordinar la regulación de la hemodinámica renal [13].
Hay evidencias en favor de la existencia de otros receptores de la PTH, un tipo tres (PTH-R3), probablemente específico del PTHrP en los queratinocitos, en el riñón y en la placenta [7], y un tipo cuatro (PTH-R4) específico para los fragmentos C terminales de la PTH [14].
El PTH-R1 ha sido el más estudiado de los tres receptores hasta ahora identificados. Se trata de una molécula de la familia de los receptores ligados a las proteinas G, los cuales tienen como características estructurales principales, siete regiones en forma de hélice, las cuales atraviesan la membrana celular, una región extracelular donde vienen a fijarse los agonistas y una región intracelular que sirve para transmitir el mensaje por medio de las proteínas G.
Las dos moléculas, PTH y PTHrP se ligan con gran afinidad al PTH-R1 y estimulan un sistema de transducción que implica la activación de diferentes proteínas G, la fosfolipasa C y la adenilciclasa [2, 15]. El uso diferencial de esas vías de transducción depende del asamblaje del PTH-R1 con la proteína NHERF (sodium-hydrogen exchanger regulatory factor). En caso de la activación de la vía fosfolipasa, la proteína NHERF es la única responsable de l'unión del PTH-R1 con la fosfolipasa C beta, lo que quiere decir que la presencia o la ausencia de expresión de NHERF determina en parte las acciones tisulares específicas de la PTH y del PTHrP [16].
El ARN mensajero y la proteína del PTH-R1 son casí ubicuos, pero su expresión principal se encuentra en el riñón, el hígado, el hueso, el pulmón, los testículos y la piel [17, 18]. En el riñón, el ARN mensajero se localiza en la corteza y en la zona externa de la medular externa, no observándose expressión en la médula interna. En las zonas positivas, las células con PTH-R1 son los podocitos glomerulares, las células del túbulo contorneado proximal y las del túbulo contorneado distal [19]. En el hueso, los estudios de hibridación in situ, han mostrado que el PTH-R1 es únicamente presente en los condrocitos pre-hipertróficos del cartílago de crecimiento. La PTH como el PTHrP regulan en ese sitio la diferenciación y la apoptosis celular y el desarrollo normal del hueso endocondral en compañía de otras proteínas como el Ihh (indian hedgehog) [20-23].
Enfermedades determinadas genéticamente
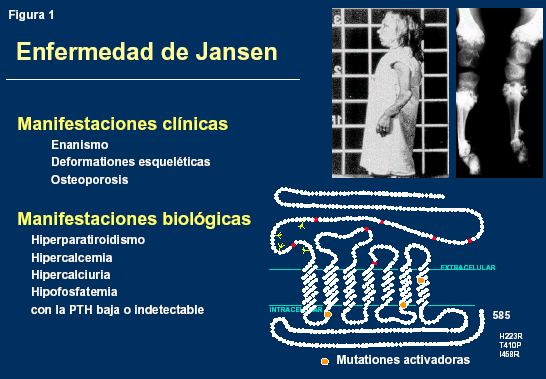
Varias mutaciones en el PTH-R1 han permitido aclarar el origen de ciertas enfermedades genéticas [24]. Las mutaciones activadoras del PTH-R1 provocan la condrodisplasia metafisaria de tipo Jansen (fig. 1) [25] y las mutaciones inactivadoras son responsables de otra condrodisplasia rara, la enfermedad de Blomstrand (fig. 2) [26] y de ciertas encondromatosis [27].
La condrodisplasia metafisaria de Jansen es un enanismo con deformaciones esqueléticas y osteopórosis. Biológicamente, los enfermos presentan signos de hiperparatiroidismo con hipercalcemia, hipofósforemia, hipercalciuria y paradójicamente una concentración de PTH casi indetectable en el suero. Las mutaciones ocurren generalmente en las regiones trans-membranales y activan constitutivamente y continuamente el PTH-R1. Esta activación constante se manifiesta en un retardo de maduración de los condrocitos pre-hipertróficos, una falta de apoptosis y la persistencia de células inmaduras dentro del hueso ya formado o mineralizado, dando así lugar a las deformaciones óseas y la corta estatura.
El mismo escenario se reproduce en los animales donde se superexpresa el PTHrP específicamente en los condrocitos, gracias al promotor del gen del colágeno de tipo II, y cuando se introduce el PTH-R1 mutado de la enfermedad de Jansen el cual está constantemente activado. En los dos casos se retarda la diferenciación de los condrocitos y la mineralización ósea, se suspende el fenómeno de apoptosis y se observan islotes de condrocitos inmaduros dentro del hueso mineralizado [25, 28].
Al contrario, en la enfermedad de Blomstrand y en la encondromatosis, las mutaciones ocurren en el sexto dominio trans-membrana o en el sector extracelular e inactivan completamente el PTH-R1 [24, 29]. Los fetos mueren in útero, osificados y probablemente de insuficiencia cardíaca, puesto que en el modelo animal de knock-out del PTH-R1, los cardiomiocitos sufren una masiva y abrupta apoptosis entre los dias 11 y 12 de la vida embrionaria [30].
De hecho, esas mutaciones aceleran el proceso de maduración de los condrocitos pre-hipertróficos y el proceso de osificación endocondral. Los modelos animales han confirmado también esos cuadros clínicos. Así los ratones knock-out para los genes del PTH-R1 o de la proteína PTH-rP muestran el mismo fenotipo óseo que los enfermos con la condrodisplasia de Blomstrand. Lo que significa que en ausencia de PTHrP o del PTH-R1 los condrocitos no pueden proliferar normalmente e impident el crecimiento óseo longitudinal normal. Los condrocitos se diferencian mas rápido, comienzan a producir los componentes de la matriz extracelular precozmente, facilitan la mineralización ósea, y mueren de apoptosis prematura.
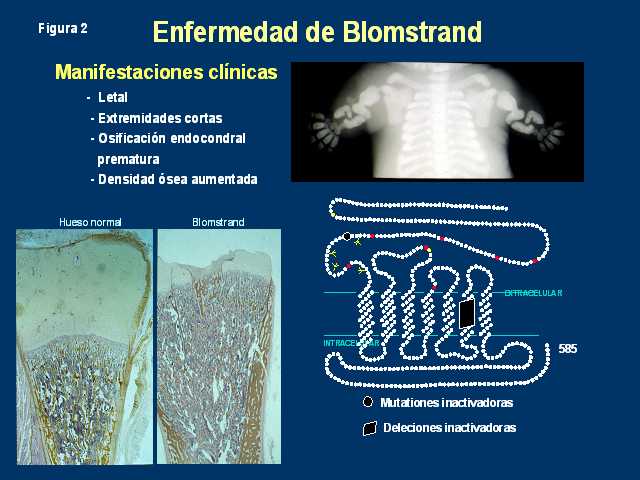
Además, es posible que algunos polimorfismos en el gen PTH-R1 puedan determinar la sensibilidad del riñón y del hueso a la acción catabólica o anabólica de la PTH [31, 32].
Enfermedades adquiridas
Varias situaciones clínicas se associan con una alteración funcional del PTH-R1, altéración que puede ser secundaria a la disminución de la expresión del ARNm/proteína o a un defecto en las vías de transducción del señal intracelular. Asi, la expresión del ARNm del PTH-R1 y de su proteína es regulada, por lo menos en los principales órganos sensibles a la acción de la PTH, por numerosos factores.
Por un lado, las endotoxinas, la interleuquina-2, la dexametasona, la T3, el FGF-2 (fibroblast growth factor-2) y el 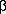 (transforming growth factor-beta) estimulan positivamente la expressión del PTH-R1 [33, 34]. El hecho que la dexametasona lo regule de manera positiva en las celulas óseas es uno de los mecanismos por los cuales el tratamiento con esteroides de enfermedades immunológicas y de transplantes de órganos se complica con perdida ósea. Igualmente, en los animales con déficit en vitamina D y sin insuficiencia renal, es común encontrar un PTH-R1 aumentado en el hueso y en el riñón [35].
Por otro lado, la PTH, el PTHrP, la angiotensina-II, el IGF-1 (insulin growth factor-1), la PGE2 (prostaglandin E2), la vitamina D, la insufficiencia renal aguda (IRA) y crónica disminuyen la expresión del PTH-R1.
(transforming growth factor-beta) estimulan positivamente la expressión del PTH-R1 [33, 34]. El hecho que la dexametasona lo regule de manera positiva en las celulas óseas es uno de los mecanismos por los cuales el tratamiento con esteroides de enfermedades immunológicas y de transplantes de órganos se complica con perdida ósea. Igualmente, en los animales con déficit en vitamina D y sin insuficiencia renal, es común encontrar un PTH-R1 aumentado en el hueso y en el riñón [35].
Por otro lado, la PTH, el PTHrP, la angiotensina-II, el IGF-1 (insulin growth factor-1), la PGE2 (prostaglandin E2), la vitamina D, la insufficiencia renal aguda (IRA) y crónica disminuyen la expresión del PTH-R1.
En la insuficiencia renal aguda, Soifer et cols., demostraron que el PTH-R1 disminuye en las células del túbulo contorneado próximal algunas horas después de una isquemia provocada, probablemente como consecuencia de un aumento en la producción de PTHrP. Lo cual hace pensar que el sistema PTH/PTHrP y su receptor podrían estar implicados el el proceso de reparación o agravación de la IRA [36]. El mismo sistema, actuando de manera paracrina o autocrina, y donde un exceso de producción de PTHrP provoca une disminución del PTH-R1 en las células vasculares, ha sido implicado en la fisiopatología de la hipertensión arterial en las ratas SHR (spontaneously hypertensive rats) [37]. Igualemente, el PTHrP y su receptor parecen jugar un papel pro-inflammatorio en las lesiones ateromatosas y en la inestabilidad de las placas atheromatosas en las arterias carótidas [38]. En la piel, el PTHrP es también un potente inhibidor de la proliferación de células escamosas. Por esta razon, ciertos estudios recientes sugieren la aplicacion local de PTHrP como tratamiento de la psoriasis [39].
De manera similar, en caso de insuficiencia renal crónica, el PTH-R1 diminuye progresivamente en el riñón paralelamente con la disminución de la filtración glomerular [40, 41]. En el hueso, la disminución del PTH-R1 se asocia con una reducción de la altura de la zona ocupada por los condrocitos pre-hipertróficos, como lo han demostrado los estudios de hibridación in situ [42]. Estas alteraciones son en parte responsables de la resistencia del hueso a la acción hipercalcémica de la PTH y del retardo de crecimiento longitudinal en los niños urémicos [40-43].
El nivel de expresión del PTH-R1 juega también un papel importante en la instauración de la enfermed ósea adinámica (ABD) observada en ciertos enfermos urémicos. En un trabajo reciente, Picton et cols. demuestran, en un grupo de 13 enfermos dializados, une disminución de mas de 70% de la expresión del PTH-R1 en las células óseas. Esta disminución se observa en todos los tipos de osteopatías urémicas, pero es mucho más importante en el hueso de los enfermos con una ABD [44].
En caso de acidosis metabólica la repuesta a la acción de la PTH aumenta y se acompaña de una hiperresorpción y perdida ósea. Ese fenómeno es debido a una aumentación de la expresión del PTH-R1 en los osteoblastos [45].
En cuanto a los receptores de los fragmentos C-terminales de la PTH. El equipo cadaniense de d'Amour mostró recientemente que en los animales tiroparatiroidectomizados, el efecto hipercalcémico de la PTH (1-84) es bloqueado completamente cuando se administra conjuntamente con una concentración equimolar de PTH (7-84) ou con una mezcla de fragmentos C-terminales de la PTH [46]. Igualmente, Bringhurst et cols. Demuestran, en un modelo de celulas osteoblásticas de animales knock-out para el gen del PTH-R1, que la fijación del fragmento (19-84) de la PTH no puede desplazarse con cantidades crecientes del fragmento activo (1-34) de la PTH, lo que sugiere la existencia de un receptor específico de ese fragmento C-terminal de la PTH en las células óseas [14].
Conclusión
Las implicaciones biológicas de la identificacion y el clonaje de los receptores de la familia PTH son innumerables (tabla 1). La distribución casi general y ubicua del PTHrP y del PTH-R1 así como de los diferentes fragmentos de esas moléculas, nos invitan a créer en la existencia de otros receptores y que la acción de esas moléculas sobre el sistema mineral y óseo es mucho más compleja que lo que pensábamos.
IMPLICACIONES BIOLOGICAS DEL RECEPTOR PTH-R1
Mutaciones genéticas activadoras del PTH-R1
- Condrodisplasia de Jansen
|
Mutationes genéticas inactivadoras del PTH-R1
- Condrodisplasia de Blomstrand
- Encondromatosis (Enfermedad de Ollier y Maffucci)
|
| Polimorfismos genéticos determinando la sensibilidad renal y ósea a la PTH |
Alteración en la regulación del PTH-R1
- Corticoesteroides
- Insuficiencia renal crónica
- Insuficiencia renal aguda
- Enfermedad ósea adinámica
- Hipertensión arterial espontánea en ratas (SHR)
|
Acción de la PTH, el PTHrP o el TIP-39 sobre otros receptores de la PTH
- Receptor específico de los fragmentos C-terminales de la PTH
- Tratamiento tópico de la psoriasis con PTHrP
|
Bibliografía
1. Jüppner H, Abou-Samra A, Freeman M, et al.: A G protein-linked receptor for parathyroid hormone and parathyroid hormone-related peptide. Science 1991;254:1024-6
2. Abou-Samra A, Jüppner H, Force T, et al.: Expression cloning of a common receptor for parathyroid hormone and parathyroid hormone-related peptide from rat osteoblast-like cells: a single receptor stimulates intracellular accumulation of both cAMP and inositol trisphosphates and increases intracellular free calcium. Proc Natl Acad Sci USA 1992;89:2732-6
3. Ureña P, Abou-Samra A, Jüppner H, et al.: Mode d'action de l'hormone parathyroïdienne (PTH) et du peptide apparanté à la PTH (PTHrP) au niveau des organes cibles. Annales d'Endocrinologie 1994;55:133-41
4. Strewler G: The physiology of parathyroid hormone-related protein. N Engl J Med 2000;342:177-85
5. Burtis W, Wu T, Bunch C, et al.: Identification of a novel 17,000-Dalton parathyroid hormone-like adenylate cyclase-stimulating protein from a tumor associated with humoral hypercalcemia of malignancy. J Biol Chem 1987;262:7151-6
6. Orloff J, Wu T, Stewart A: Parathyroid hormone-like proteins: biochemical responses and receptor interactions. Endocrine Reviews 1989;10:476-95
7. Orloff J, Kats Y, Ureña P, et al.: Further evidence for a novel receptor for amino-terminal parathyroid hormone-related protein on keratinocytes and squamous carcinoma cell lines. Endocrinology 1995;136:3016-23
8. Usdin T, Gruber C, Bonner T: Identification and functional expression of a receptor selectively recognizing parathyroid hormone, the PTH2 receptor. J Biol Chem 1995;270:15455-8
9. Usdin T: Evidence for a parathyroid hormone-2 receptor selective ligand in the hypothalamus. Endocrinology 1997;138:831-4
10. Misiano P, Scott BB, Scheideler MA, Garnier M: PTH2 receptor-mediated inhibitory effect of parathyroid hormone and TIP39 on cell proliferation. Eur J Pharmacol 2003;468:159-66
11. Sugimura Y, Murase T, Ishizaki S, et al.: Centrally administered tuberoinfundibular peptide of 39 residues inhibits arginine vasopressin release in conscious rats. Endocrinology 2003;144:2791-6
12. Usdin TB, Dobolyi A, Ueda H, Palkovits M: Emerging functions for tuberoinfundibular peptide of 39 residues. Trends Endocrinol Metab 2003;14:14-9
13. Eichinger A, Fiaschi-Taesch N, Massfelder T, et al.: Transcript expression of the tuberoinfundibular peptide (TIP)39/PTH2 receptor system and non-PTH1 receptor-mediated tonic effects of TIP39 and other PTH2 receptor ligands in renal vessels. Endocrinology 2002;143:3036-43
14. Divieti P, John M, Jüppner H, Bringhurst F: Human PTH-(7-84) inhibits bone resorption in vitro via actions independent of the type I PTH/PTHrP receptor. Endocrinology 2002;143:171-6
15. Jüppner H: Functional properties of the PTH/PTHrP receptor. Bone 1995;17:39S-42S
16. Mahon MJ, Donowitz M, Yun CC, Segre GV: Na(+)/H(+ ) exchanger regulatory factor 2 directs parathyroid hormone 1 receptor signalling. Nature 2002;417:858-61
17. Ureña P, Kong X, Abou-Samra A, et al.: Parathyroid hormone (PTH) /PTH-related peptide (PTHrP) receptor mRNA are widely distributed in rat tissues. Endocrinology 1993;133:617-23
18. Ureña P, Lee K, Weaver D, et al.: PTH/PTHrP receptor mRNA expression as assessed by Northern blot and in situ hybridization. J Bone Miner Res 1992;7:S118
19. Lee K, Brown D, Ureña P, et al.: Localization of parathyroid hormone/parathyroid hormone-related peptide receptor mRNA in kidney. Am J Physiol 1996;270:F186-F91
20. Vortkamp A, Lee K, Lanske B, et al.: Regulation of rate of cartilage differentiation by indian hedgehog and PTH-related protein. Science 1996;273:613-21
21. Lanske B, Karaplis A, Lee K, et al.: PTH/PTHrP receptor in early development and indian hedgehog-regulated bone growth. Science 1996;273:663-6
22. Lee K, Deeds J, Bond A, et al.: In situ localization of PTH/PTHrP receptor mRNA in the bone of fetal and young rats. Bone 1993;14:341-5
23. Lee K, Deeds J, Segre G: Expression of parathyroid hormone-related peptide and its receptor messenger ribonucleic acids during fetal development of rats. Endocrinology 1995;136:453-63
24. Silve C: Récepteur PTH/PTHrP et maladies génétiques. Médecine/Sciences 1999;15:1310-2
25. Schipani E, Kruse K, Jüppner H: A constitutively active mutant PTH-PTHrP receptor in Jansen-type metaphyseal chondrodysplasia. Science 1995;268:98-100
26. Zhang P, Jobert A, Couvineau A, Silve C: A homozygous inactivating mutation in the parathyroid hormone/parathyroid hormone-related peptide receptor causing Blomstrand chondrodysplasia. J Clin Endocrinol Metab 1998;83:3365-8
27. Hopyan S, Gokgoz N, Poon R, et al.: A mutant PTH/PTHrP type I receptor in enchondromatosis. Nature Genetics 2002;30:306-10
28. Weir E, Philbrick W, Amling M, et al.: Targeted overexpression of parathyroid hormone-related peptide in chondrocytes causes chondrodysplasia and delayed endochondral bone formation. Proc Natl Acad Sci 1996;93:10240-5
29. Jüppner H, Gardella T, Lee C, et al.: Mapping of the ligand binding domain by using mutant PTH/PTHrP receptors. J Bone Miner Res 1993;7:S93
30. Qian J, Colbert MC, Witte D, et al.: Midgestational lethality in mice lacking the parathyroid hormone (PTH)/PTH-related peptide receptor is associated with abrupt cardiomyocyte death. Endocrinology 2003;144:1053-61
31. Heishi M, Tazawa H, Matsuo T, et al.: A novel Van91 I polymorphism in the 1st intron of the parathyroid hormone (PTH)/PTH-related peptide (PTHrP) receptor gene and its effect on the urinary cAMP response to PTH. Biological and Pharmaceutical Bulletin 2000;23:386-9
32. Minagawa M, Yasuda T, Watanabe T, et al.: Association between AAAG repeat polymorphism in the P3 promoter of the human parathyroid hormone (PTH)/PTH-related peptide receptor gene and adult height, urinary pyridinoline excretion, and promoter activity. J Clin Endocrinol Metab 2002;87:1791-6
33. Mannstadt M, Drüeke T: Récepteurs de l'hormone parathyroïdienne: du clonage aux implications physiologiques, physiopathologiques et cliniques. Néphrologie 1997;18:5-10
34. Ureña P, Iida-Klein A, Kong X, et al.: Regulation of the parathyroid hormone (PTH)/PTH-related peptide receptor mRNA by glucocorticoids and PTH in ROS 17/2.8 cells and OK cells. Endocrinology 1994;134:451-6
35. Turner G, Coureau C, RiszkRabin M, et al.: Parathyroid hormone (PTH)/PTH-related protein receptor messenger ribonucleic acid expression and PTH response in a rat model of secondary hyperparathyroidism associated with vitamin D deficiency. Endocrinology 1995;136:3751-8
36. Soifer N, VanWhy S, Ganz M, et al.: Expression of parathyroid hormone-related protein in the rat glomerulus and tubule during recovery from renal ischemia. J Clin Invest 1993;92:2850-7
37. Massfelder T, Taesch N, Fritsch S, et al.: Type 1 parathyroid hormone receptor expression level modulates renal tone and plasma renin activity in spontaneously hypertensive rat. J Am Soc Nephrol 2002;13:639-48
38. Martin-Ventura JL, Ortego M, Esbrit P, et al.: Possible role of parathyroid hormone-related protein as a proinflammatory cytokine in atherosclerosis. Stroke 2003;34:1783-9
39. Holick MF, Chimeh FN, Ray S: Topical PTH (1-34) is a novel, safe and effective treatment for psoriasis: a randomized self-controlled trial and an open trial. Br J Dermatol 2003;149:370-6
40. Ureña P, Mannstadt M, Hruby M, et al.: Down-regulation of the PTH/PTHrP receptor in uremia. J Bone Min Metab 1994;12:S87-S90
41. Ureña P, Kubrusly M, Mannstadt M, et al.: The renal PTH/PTHrP receptor is downregulated in rats with chronic renal failure. Kidney Int 1994;45:605-11
42. Ureña P, Ferreira A, Morieux C, Drüeke T, deVernejoul M: PTH/PTHrP receptor mRNA is down-regulated in epiphyseal cartilage growth plate of uraemic rats. Nephrol Dial Transplant 1996;11:2008-16
43. Ureña P, Mannstadt M, Hruby M, et al.: Parathyroidectomy does not prevent the renal PTH/PTHrP receptor down-regulation in uremic rats. Kidney Int1995;47:1797-805
44. Picton M, Moore P, Mawer E, et al.: Down-regulation of human osteoblast PTH/PTHrP receptor mRNA in end-stage renal failure. Kidney Int 2000;58:1440-9
45. Disthabanchong S, Martin KJ, McConkey CL, Gonzalez EA: Metabolic acidosis up-regulates PTH/PTHrP receptors in UMR 106-01 osteoblast-like cells. Kidney Int 2002;62:1171-7
46. Nguyen-Yamamoto L, Rousseau L, Brossard J, Lepage R, D'Amour P: Synthetic carboxy-terminal fragments of parathyroid hormone (PTH) decrease ionized calcium concentration in rats by acting on a receptor different from the PTH/PTHrP-related peptide receptor. Endocrinology 2001;142:1386-92
