INTRODUCCIÓN
El meningioma es un tumor que procede de las células meningoepiteliales aracnoideas.
En la mayor parte de los casos es un tumor sólido que presenta una clara fijación
a la duramadre y que radiológicamente se identifica como una lesión extraaxial.
Un pequeño porcentaje de meningiomas (2-3 %) está constituido por tumores con
degeneración quística central y con crecimiento en la profundidad de los surcos
de manera que aparecen radiológicamente como tumores intraparenquimatosos con
«necrosis» central. En la mayor parte de estos casos el diagnóstico clínico-radiológico
es el de tumor glial de alto grado/glioblastoma o metástasis. El estudio anatomopatológico
permite establecer el diagnóstico correcto.
PACIENTE Y MÉTODOS
Mujer de 70 años de edad con antecedentes de hipertensión arterial que sufrió
cuadro de instauración brusca de hemiparesia izquierda.
En la exploración neurológica se objetivó una pérdida de fuerza en el hemicuerpo
izquierdo grado III-IV/V de predominio proximal.
Pruebas complementarias:
- Analítica sanguínea normal.
- Electrocardiograma: un hemibloqueo anterior de la rama izquierda y signos
de hipertrofia ventricular izquierda.
- Rx de torax: signos de crecimiento del ventrículo izquierdo y elongación
aórtica.
- Tomografía axial computadorizada (TC) cerebral (Figuras
1 y 2): proceso expansivo intraparenquimatoso,
de 2,5 X 2 cm, hipodenso y bien delimitado en la región postrolándica del
lóbulo parietal derecho. La lesión estaba rodeada por un edema perilesional
de grado moderado y causaba una amputación parcial del asta occipital y del
ventrículo lateral ipsolaterales, sin desplazamiento de la línea media. Tras
la inyección del contraste se produjo una captación intensa del mismo por
un nódulo situado en el interior de la lesión hipodensa, así como en anillo
perilesional. No se realizó angiografía. El diagnóstico radiológico fue de
glioma o proceso metastásico. La paciente fue intervenida mediante craneotomía
parasagital derecha extirpándose la tumoración.
Evolución:
Tras la intervención la paciente se recuperó de su cuadro neurológico, superó
con éxito un episodio de tromboembolismo pulmonar y sobrevivió sin otra patología,
a parte de su hipertensión, 7 años más falleciendo por una insuficiencia cardiaca.
MATERIAL Y MÉTODOS
La pieza quirúrgica se remitió en fresco, fijándose posteriormente en formol.
El estudio anatomopatológico se realizó mediante técnicas histológicas convencionales,
tinciones de hematoxilina-eosina, Masson-Fontana y reticulina, y técnicas de
inmunohistoquímica sobre material fijado en formol e incluido en parafina según
la técnica de peroxidasa-antiperoxidasa para demostración de proteína glial
fibrilar ácida (GFAP), proteína S100, antígeno epitelial de membrana (EMA),
vimentina, Ki-67 y CD34.
RESULTADOS
Estudio anatomopatólogico:
- Examen macroscópico: Se recibió en fresco una pieza de resección
quirúrgica de forma ovalada, consistencia elástica y color grisáceo, con tendencia
a la nodulación, de unos diámetros máximos de 2,5 X 1,5 X 1 cm. La lesión
descrita estaba rodeada por un pequeño fragmento de corteza y sustancia blanca
cerebrales. Al corte, el nódulo descrito tenía una formación quística en su
interior de contenido líquido amarillento, sucio, de un diámetro de 2 mm.
La pieza se incluyó en su totalidad para estudio microscópico.
- Examen microscópico: Los cortes histológicos (Figura
3) correspondían a parénquima cerebral revestido por leptomeninge en relación
con la cual se apreciaba una tumoración nodular, lobulada y circunscrita con
un patrón de crecimiento variable. Existían zonas de celularidad moderada
con células poligonales de contornos mal definidos (aspecto sincitial) y núcleos
redondeados, ovoides, con ligera variación de tamaño, cromatina fina, nucléolo
pequeño y solitario, y frecuentes invaginaciones núcleo-citoplasmáticas (pseudoinclusiones
intranucleares) (Figuras 4 y 5).
En estas zonas las células tenían tendencia a formas remolinos (Figura
6). Todo el tumor mostraba un marcado componente vascular con capilares
y venas de pequeño cañibre (Figura 7).
Focalmente se observaba un patrón de vasos alargados y ramificados con cierto
aspecto en «asta de ciervo» (Figuras 8
y 9) que coincidía con una celularidad
compacta y células con características nucleares similares y ligera hipercromasia,
pero mayor índice mitótico (2 mitosis por campo de gran aumento) (Figuras
10 y 11) y menor cantidad de citoplasma.
En estas últimas zonas la tinción de reticulina ponía de relieve fibras que
rodeaban pequeños grupos de células o células de forma individual (Figura
12). Sin embargo, en otras áreas las fibras reticulínicas se localizaban
en los septos y alrededor de los vasos (Figura
13), siendo escasas en el seno del tumor.
Existían áreas de edema intercelular e hialinización estromal (Figura
14), así como frecuentes signos de hemorragia reciente y antigua (depósitos
intracelulares de hemosiderina negativos con la técnica de Masson-Fontana
) (Figura 15). El tejido cerebral circundante
presentaba un ligero edema y una intensa gliosis reactiva (Figura
16) sin evidencia de infiltración tumoral.
Las técnicas de inmunohistoquímica para detección de GFAP demostraban negatividad
en las células de la lesión meníngea (Figura
17) y positividad citoplásmica intensa en las células gliales reactivas
de la corteza cerebral cercana al tumor (Figura
18) y. A su vez, las células tumorales presentaban débil positividad de
membrana para EMA (Figura 19) y vimentina,
mientras que eran negativas para proteína S100. El antígeno de proliferación
celular Ki-67 (Figura 20) fue positivo
en el núcleo de menos de un 10 % de las celulas tumorales.
Con estos hallazgos se efectuó el diagnóstico de meningioma intensamente vascularizado
con rasgos sincitiales y abundantes signos degenerativos que focalmente presentaba
características atípicas y aspectos sugestivos de diferenciación hemangiopericitaria.
La revisión posterior del estudio neurorradiológico completo permitió detectar
una mínima zona de adherencia del tumor a la duramadre.
DISCUSIÓN
Los meningiomas son tumores benignos que representan el 13 al 18 % de los tumores
intracraneales y que se originan a partir de las células aracnoideas que forman
la superficie externa de la leptomeninge. Las células que componen estas neoplasias
tienen un origen embriológico desde el mesodermo y la cresta neural, por lo
que son capaces de diferenciarse hacia elementos epiteliales y mesenquimales
(1).
En la mayoría de los casos, son tumores sólidos con una clara fijación a la
duramadre y que radiológicamente se identifican como extraaxiales. Sin embargo,
con el comienzo de la utilización de la TC se observó que los meningiomas podían
tener un patrón radiológico variable atribuible a unas zonas proliferativas,
componente necrótico y áreas edematosas y quísticas (2).
El componente quístico es muy frecuente en los gliomas, pero tan sólo se observa
en un 2-3 % de meningiomas (3). Además,
en algunas ocasiones los meningiomas crecen en la profundidad de los surcos
de manera que aparecen radiológicamente como tumores «intraparenquimatosos»
con necrosis central. Por ello, en la mayor parte de los casos, el diagnóstico
clínico-radiológico es de tumor glial de alto grado/glioblastoma o metástasis,
aunque también se pueden sugerir diagnósticos como los de cisticercosis y abceso
cerebrales (3, 5-10).
Los estudio con TC revelan siempre masas intracraneales de localización y morfología
variables. El componente sólido es iso o hipodenso y con la administración de
contraste se refuerza considerablemente (5).
En la actualidad, la resonancia magnética nuclear ha aumentado la capacidad
diagnóstica en estos tumores porque en algunos casos posibilita detectar -con
mayor nitidez que la TC- la conexión del tumor con la duramadre (6,
9, 11-15).
La angiografía carotidea selectiva con opacificación de la carótida externa
puede ser muy útil para el diagnóstico preoperatorio correcto, ya que los meningiomas
reciben su vascularización a partir de esta vía, a diferencia de los gliomas
que raramente son irrigados por esta arteria (4,
7, 16,
17).
Los quistes asociados a meningiomas puede ser según Nauta de varios tipos: tipo
1 o intramural y central; tipo 2 intramural y periférico; tipo 3 peritumoral
en el parénquima adyacente, y tipo 4 peritumoral entre el tumor y el parénquima
adyacente. Nuestro caso pertenecería al tipo 2 de esta clasificación (3,
5, 17).
La etiopatogenia de los cambios quísticos observados radiológicamente en los
meningiomas no está clara; se han postulado algunos mecanismos como aumento
del espacio subaracnoideo, gliosis reactiva, necrosis isquémica, atrapamiento
y loculación del líquido cefalorraquídeo (LCR), secreción de las células tumorales
o cavitación posthemorrágica tumoral (3).
Los hallazgos histológicos de nuestro caso podrían apoyar esta última hipótesis.
Es importante intentar llegar a un diagnóstico preoperatorio de estos tumores
ya que son de comportamiento benigno en la mayoría de los casos y pueden ser
curados con la extirpación quirúrgica total del tumor (3,
19). Tan sólo se han descrito un 8 %
de meningiomas quísticos malignos (3).
Sin embargo, si el diagnóstico preoperatorio es de glioma o metástasis los enfermos
serán sometidos a tratamientos paliativos (2).
Las biopsias intraoperatorias pueden también ayudar a conseguir un diagnóstico
preoperatorio (6, 12,
20, 21).
Sin embargo, tanto en éstas como en las pequeñas biopsias esteroatáxicas obtenidas
con fines diagnósticos, el patólogo debe hacer el diagnóstico diferencial en
primer lugar con los gliomas y con otros tumores como carcinomas, melanomas
y hemangiopericitomas, así como con lesiones meningoteliales reactivas (22).
Nuestro caso mostraba, focalmente, características sugestivas de hemangiopericitoma,
sin embargo la clara presencia de remolinos celulares e inclusiones intranucleares,
estas últimas presentes incluso en las zonas de diferenciación hemangiopericitaria,
nos llevaron al diagnóstico de meningioma altamente vascularizado de tipo sincitial.
Los hemangiopericitomas meníngeos se consideran actualmente neoplasias similares
a las que se presentan en cualquier otro lugar del organismo. Han sido claramente
segregados de los meningiomas por los datos de inmunohistoquímica, microscopia
electrónica y cultivos celulares, así como por su evolución (22,
23). Por otra parte, no se ha descrito
ningún caso de hemangiopericitoma quístico (24).
La evolución sin recurrencias ni metástasis que experimentó nuestra paciente
refuerza, por otra parte, el diagnóstico de meningioma sobre el de hemangiopericitoma
ya que estos últimos recurren en un 75 % a los 5 años y muestran metástasis
en un 26,5 % de los casos, según las distintas series (25).
Las técnicas de inmunohistoquímica pueden ayudar al diagnóstico en los casos
conflictivos, ya que los meningiomas expresan de forma difusa vimentina. Entre
un 50 y un 80 % de los casos también expresa el antígeno epitelial de membrana
(EMA) en la membrana y ocasionalmente en el citoplasma. En un 5 % se observa
positividad con anticuerpos anticitoqueratina y en un 20 % contra proteína S100
(22, 26).
Este perfil inmunohistoquímico permite diferenciarlos de los gliomas, que no
expresan EMA ni citoqueratina y son positivos con anticuerpos anti S100 y anti
GFAP. Los carcinomas por su parte no expresan vimentina. Por su parte, los hemangiopericitomas
son negativos con anticuerpos frente a EMA.
CONCLUSIÓN
De manera infrecuente el meningioma puede aparecer como un tumor quístico
intraparenquimatoso en los estudios nuerorradiológicos simulando un glioma o
una metástasis. Es importante intentar llegar a su diagnóstico preoperatorio
correcto ya que se trata de una neoplasia potencialmente curable quirúrgicamente.
Los radiólogos deben considerar esta posibilidad en tumores quísticos que se
encuentran en las localizaciones típicas de los meningiomas, incluso aunque
aparentemente sean intraaxiales. Los patólogos deben pensar en este tipo de
tumores tanto en las biopsias intraoperatorias como en las esteroatáxicas en
las que se obtiene escaso material, especialmente cuando -como en nuestro caso-
el meningioma muestra características histológicas, inmunofenotípicas o ambas
no totalmente convencionales.
PALABRAS CLAVE
Meningioma quístico; glioblastoma; metástasis; cerebro; hemangiopericitoma.
BIBLIOGRAFÍA
- Ronald R. Winek, M.D., Ph.D., Bernd W. Scheithauer,
M.D., and Mark R. Wick, M.D. Meningioma, Meningeal Hemangiopericytoma
(Angioblastic Meningioma, Peripheral Hemangiopericytoma, and Acoustic Schwannoma.
A Comparative Inmunohistochemical Study. Am J Surg Pathol 1989; 13:251-261.
- - Barontini F., Sita D., and Mennonna P. A Case
of Cystic Meningioma Mimicking an Astrocytoma. J Neurol 1982; 227:165-169.
- Mena I.X., Noboa C.A., Leone-Stay G., Vascónez J.V.,
and Cardenas-Mera B. Meningiomas Quísticos: Formas Inusuales de Neoplasias
Intracraneales. Rev Neurol 1998; 27:50-55.
- Odake G. Cystic Meningioma: Report of Three
Patients. Neurosurgery 1992; 30:935-40.
- El-Fiki M., El-Hanawy Y., and Abdel-Rahman N. Cystic
Meningioma. Acta Neurochir (Wien) 1996; 138:811-17.
- Carvalho G.A., Vorkapic P., Biewener G., and Samii
M. Cystic Meningiomas Resembling Glial Tumors. Surg Neurol 1997;
47:284-89.
- El Abbassi Skalli A., Chikhaoui N., Hajjam M., and
Kadiri R. J. Neuroradiol 1998; 25:275-80.
- Shimizu K., Furuhata S., Sasai S., Tominaga S., and
Takamiya Y. Intracerebral Cystic Meningioma- Case Report. Neurol
Med Chir (Tokyo) 1999; 39:530-3.
- Qasho R., and Epimanio R.O. Cystic Meningioma.
Neuroradiological (MRI, CT) and Macroscopic Intraoperative Appearance. A case
Report. Neurosurg Rev 1998; 21:155-7.
- Leblanc R. Cystic Meningiomas: A Review (letter,
comment). Neurosurgery 1995; 37:845-6.
- De Jesus O., Rifkinson N., and Negron B. Cystic
Meningiomas: A Review. Neurosurgery 1995; 36:489-92.
- Takara K., Cho k., Mori k., and Maeda M. Intraventricular
Cystic, Atipical Meningioma. Neurol . Med Chir (Tokyo) 1997; 37:856-60.
- Ferranto l., Acqui M., Lunardi P., Qasho R., and
Fortuna A. MRI in the Diagnosis of Cystic Meningiomas: Surgical Implications.
Acta Neurochir (Wien) 1997; 139:8-11.
- Watanaba A., Ishii R., Taka K., Suzuki Y.,Hirano
K., Okamura H., Kamada M., and Shiraba T. Magnetic Resonance Imaging
and Histology of a Large Cystic Meningioma- Case Report. Neurol Med
Chir (Tokyo) 1995; 35:87-91.
- Wasenko J.J., Hochhauser L., Stopa E.G., and Winfield
J.A. Cystic Meningiomas: MR Characteristics and Surgical Correlations.
Am J Neuroradidol 1994; 15:1959-65.
- Pompili A., Occhipinti E., Mastrotefano R., Raus
L., Cecconi L., Squillaci E., and Riccio A. Cystic Appearance of Meningiomas:
Considerations on a Series of 12 Patients. J Neurosurg Sci 1990; 34:41-9.
- Fortuna A., Ferrante L., Oliveira M.A., Acqui M.,
Gugliani G, Giamundo G., and Mastronardi L. Cystic Meningioma.
Acta Neurochir 1998; 90:23-30.
- Worthington C, Caron JL, Melanson D and Leblanc R.
Meningioma cysts. Neurology 1985; 35:1720-4.
- Aranjo J.F., Oliveira M.A., Sperlescu A., and Balbo
R.J. Cystic Meningioma. Arch Neuropsiquiatr 1993; 51:525-8.
- Sridhar K., Ravi R., Ramamurthi B., and Vasudevan
M.C. Cystic Meningiomas. Surg Neurol 1995; 43:235-9.
- Radhakrishnan V.V., Saraswathy A., Nair S., and Rout
D. Intracranial Cystic Meningioma. Indian J Cancer 1991; 28:
213-7.
- Scheithauer B.W. Tumor of the Meninges: Proposed
Modifications of the World Health Organization Classification. Acta
Neuropathol 1990; 80: 343-354.
- Moss T.H. Inmunohistochemical Characteristics
of Haemangiopericytic Meningiomas: Comparison with Typical Meningiomas, Heamangioblastomas
and Haemangiopericytomas from Extracranial Sites. Neuropathol Appl
Neurobiol 1987; 13:467-80.
- Barton L., Guthrie, M.D., Michael J. Ebersold, M.D.,
Bernd W. Scheithauer, M.D., and Edward G. Shaw, M.D. Meningeal Hemangiopericytoma.
Histopathological Features, Treatment, and Long-Term Follow-up of 44 Cases.
Neurosurgery 1989; 25:514-22.
- Mena H., Ribas J.J., Pezeshpour G., Parisi J.E.,
and Cowan D. Central Nervous System Hemangiopericytoma. J Neuropathol
Exp Neurol 1989; 48: 358.
- Andreas Artlich, M.D., and Dietmar Schmidt, M.D.
Inmunohistochemical Profile of Meningiomas and Their Histological Subtypes.
Hum Pathol 21: 843-9.
FIGURAS

Figura 1. Tomografía axial computadorizada sin contraste.
Imagen quística intraparenquimatosa en lóbulo parietal derecho, sin
aparente relación con la duramadre. Edema perilesional de grado moderado
y amputación parcial del asta occipital y del ventrículo lateral ipsolaterales,
sin desplazamiento de la línea media.
|

Figura 2. Tomografía axial computadorizada con contraste.
Captación intensa en un nódulo situado en el interior de la lesión hipodensa,
así como en anillo perilesional.
|
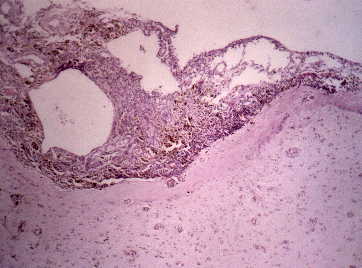
Figura 3. Meningioma quístico: interfase entre el parénquima
cerebral y la tumoración, que se origina en las membranas meníngeas
y no infiltra la corteza cerebral. (H&E, X40.)
|
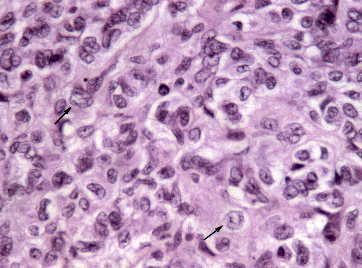
Figura 4. Meningioma quístico: células poligonales de contorno
citoplásmico mal definido. Núcleos con frecuentes pseudoinclusiones.
(flecha). (H&E, X400.)
|
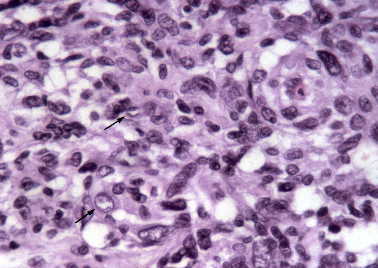
Figura 5. Meningioma quístico: núcleos redondos u ovoides
con frecuentes pseudoinclusiones nucleares (flecha). (H&E, X400.)
|
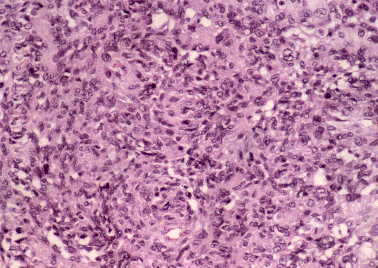
Figura 6. Meningioma quístico: aspecto sincitial. Varios
remolinos celulares. (H&E, X200.)
|
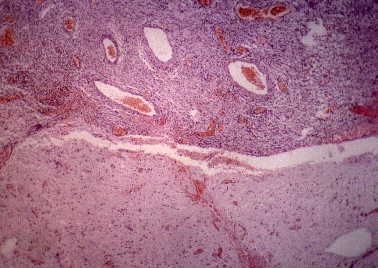
Figura 7. Meningioma quístico: abundantes vasos capilares
y venosos. Separación nítida entre el tumor y el parénquima cerebral.
(H&E, X40.)
|
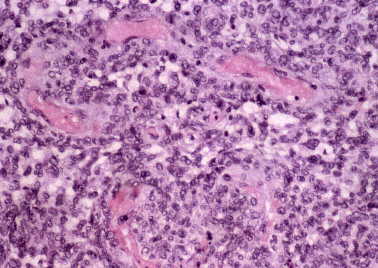
Figura 8. Meningioma quístico: zonas de diferenciación hemangiopericitaria.
Vasos alargados. Mayor densidad celular. (H&E, X100.)
|
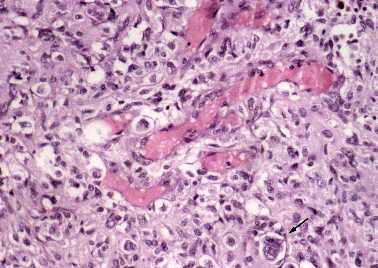
Figura 9. Meningioma quístico: vasos alargados de tipo hemangiopericitoma.
Celularidad con núcleos más irregulares y aumentados de tamaño, con
evidente atipia (flecha). (H&E, X100.)
|
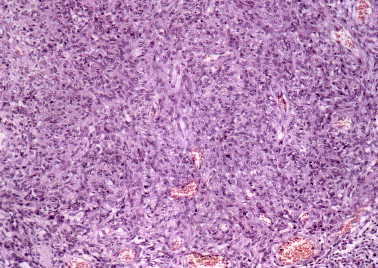
Figura 10. Areas densamente celulares, con vasos irregulares
y alargados (derecha de la imagen). Zona de diferenciación hemangiopericitaria.
(H&E, X40.)
|
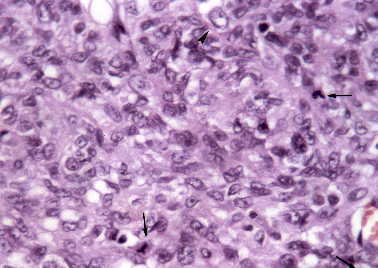
Figura 11. Meningioma quístico: áreas de diferenciación hemangiopericitaria.
Tres mitosis en este campo (flecha). Inclusiones intranucleares (cabeza
de flecha). (H&E, X400.)
|
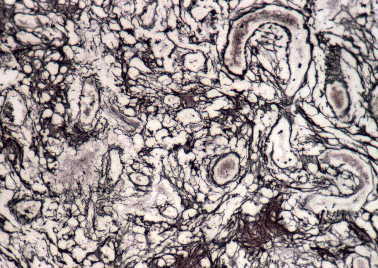
Figura 12. Meningioma quístico: abundantes fibras reticulínicas
rodean pequeños grupos de células y células individuales. Varios vasos
alargados (margen derecho). Zona de diferenciación hemangiopericitaria.
(Reticulina, X200.)
|
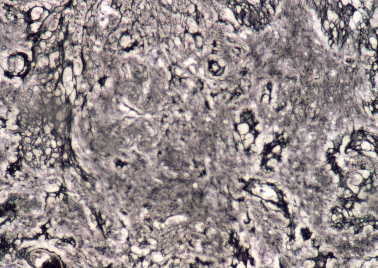
Figura 13. Meningioma quístico: área con fibras reticulínicas
perivasculares y escasas en el seno del tumor. (Reticulina, X200.)
|
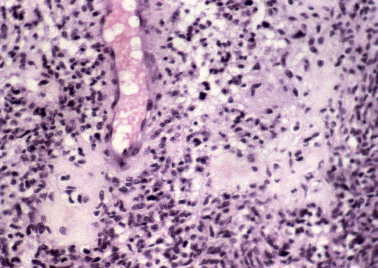
Figura 14. Meningioma quístico: zona de hialinización estromal.
(H&E, X200.)
|
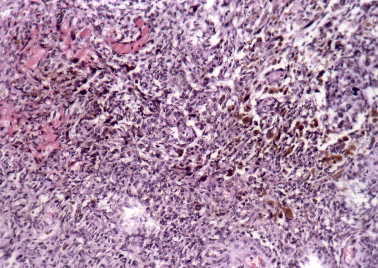
Figura 15. Meningioma quístico: zonas de hemorragia reciente
(margen superior izquierdo) y antigua; depósitos de hemosiderina intracelulares.
(H&E, X100.)
|
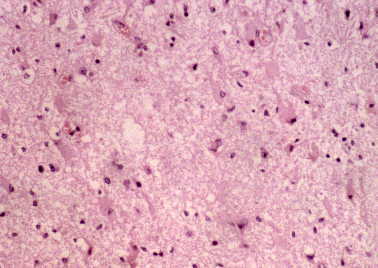
Figura 16. Meningioma quístico: edema y gliosis reactiva
en el parénquima cerebral cercano al tumor. (H&E, X200.)
|

Figura 17. Meningioma quístico: tinción de las células gliales
de la corteza cerebral con GFAP. El tumor no se tiñe (mitad superior
de la imagen). (GFAP, X40.)
|
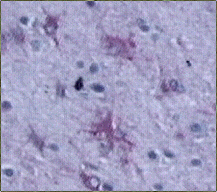
Figura 18. Meningioma quístico: imagen a mayor aumento de
la gliosis reactiva con positividad para GFAP en el parénquima cerebral
adyacente al tumor. (GFAP, X100.)
|
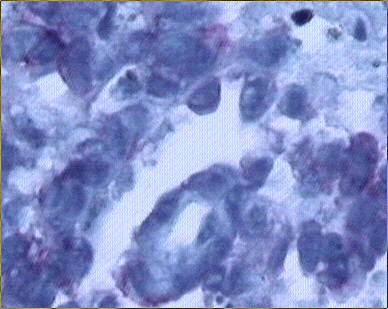
Figura 19. Meningioma quístico: positividad débil para EMA
en las membranas citoplásmicas de las células tumorales. (EMA, X100.)
|
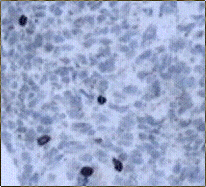
Figura 20. Meningioma quístico: menos del 10 % de las células
tumorales presentaban positividad nuclear para el antígeno de proliferación
Ki-67. (Ki-67, X100.)
|



















