Ramon Bosch Príncep, Tomás Álvaro Naranjo, Rafel Balanzá Roure, Mª Teresa Salvadó Usach, Salomé Martínez González, a Enric Contreras Barbeta, b Josep Gumà Padrò, c Mª Ángeles Martínez Lanao
Servicio de Patología. a Servicio de Hematología. Hospital de Tortosa Verge de la Cinta.
b Servicio de Oncología. c Servicio de Anatomía Patológica. Hospital Sant Joan de Reus.
Correspondencia: Dr. R. Bosch. Servicio de Patología. Hospital
de Tortosa Verge de la Cinta.
Esplanetes 44-58. 43517-Tortosa. Teléfono: 977 519104. Fax:
977 519104 – 977 519111 e-mail: htvcap@tinet.fut.es
El virus de Epstein-Barr (VEB) es un agente etiopatogénico ampliamente reconocido en muchas enfermedades humanas: mononucleosis infecciosa, carcinoma nasofaríngeo, linfoma de Burkitt endémico, linfomas en inmunodeprimidos y linfomas de células T periféricos.3 El VEB ha sido implicado también en la patogénesis de la EH4 y parece jugar un papel importante en el desarrollo de esta neoplasia, ya que su genoma se encuentra integrado de forma clonal en las células de Reed-Sternberg y sus variantes.5 A pesar de ello, la expresión del VEB en las EH varía ampliamente. Puede ser detectado en cerca del 100% en determinados grupos de pacientes con EH procedentes de algunos países en vías de desarrollo6 y países orientales,7-9 así como en el 100% de las EH de pacientes infectados por VIH10 mientras que en Europa y Norteamérica se detecta entre un 26% y un 50% de las EH en pacientes inmunocompetentes.11-15
La expresión de VEB en la EH,11-15 sobre material histológico, ha sido estudiada en pocas ocasiones en España.10,16-19 El objetivo del presente estudio es determinar la proporción de EH que expresa VEB en las comarcas de Tarragona.
Estudios histopatológicos e inmunohistoquímicos
Todas las muestras habían sido fijadas en formol al 10% y/o
B5 e incluidas en parafina siguiendo el procedimiento rutinario.
Las secciones utilizadas fueron cortadas a 2 micras de espesor, teñidas
con hematoxilina-eosina. Se revisaron todos los diagnósticos histológicos
para obtener su correcta tipificación y subclasificación
siguiendo los criterios actuales de la REAL Clasificación20
y para ello se realizaron estudios inmunohistoquímicos para CD45,
CD20 (L26), CD79a, CD3, CD45RO (UCHL-1), CD15, CD30 (Ki1), EMA y ALK. Los
anticuerpos primarios fueron adquiridos a Dakopatts (CD45, CD79a, CD3,
CD45RO, CD15, CD30, EMA y ALK) y Novocastra (CD20).
Determinación inmunohistoquímica de VEB (LMP1)
La determinación inmunohistoquímica de la expresión
del VEB se realizó mediante la técnica que detecta la Proteína
Latente de Membrana (LMP) del VEB mediante el uso de una mezcla de 4 anticuerpos
monoclonales contra la LMP (CS 1-4, M0897) (Dakopatts, Copenhagen, Dinamarca).
El sistema de amplificación y visualización utilizado fue
EnVisionTM (Dakopatts, Copenhagen, Dinamarca). Se usó
un control positivo.
Hibridación in situ para detección de VEB (EBER-1)
Paralelamente, se realizó la técnica de hibridación
in situ para EBER-1 sobre material parafinado. Esta técnica es una
prueba no isotópica de hibridación in situ que detecta los
RNAs pequeños asociados al VEB (EBER-1). Brevemente, las secciones
de 2 micras de tejido fijado en formol e incluido en parafina fueron montadas
sobre portas gelatinados. Los EBER-1 fueron detectados usando sondas de
oligonucleótidos marcados con fluoroisotiocianato (Y017, Dakopatts,
Copenhagen, Dinamarca) siguiendo las instrucciones del fabricante. Se usó
un control positivo.
Identificación de casos con expresión de VEB
La expresión del VEB se consideró positiva cuando se
identificó tinción específica, en la membrana de las
células de Reed-Sternberg o sus variantes, para la técnica
inmunohistoquímica de LMP y/o cuando se observó positividad
en el núcleo de las mismas para la técnica de EBER-1. Se
consideraron negativos aquellos casos en los que la positividad de la técnica
de EBER-1 se concentraba únicamente en linfocitos aislados y reactivos
(11casos) y no se observaba positividad en las células de Reed-Sternberg
o sus variantes.
Estudio estadístico
El estudio estadístico fue realizado mediante la prueba Chi-cuadrado
y la prueba t de Student. Se consideró significativa una P <
0,05.
Hallazgos histológicos
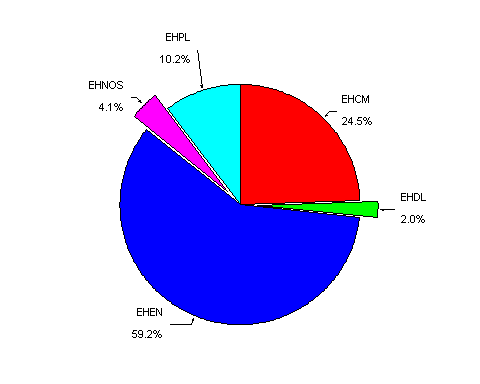
Siguiendo los criterios de la REAL clasificación, 29 casos (59,2%)
fueron diagnosticados de EH Esclerosis nodular (EN), 12 (24,5%) celularidad
mixta (CM), 1 (2%) depleción linfocítica (DL), 5 (10,2%)
predominio linfocítico (PL) y 2 (4,1%) EH sin poderse subtipificar
(NOS) (Figura 3). La esclerosis nodular es el
subtipo predominante en este estudio tanto en hombres como en mujeres,
si bien, sobre el total de EH, en hombres representa un 50% (15/30) y en
mujeres el 74% (14/19). La CM representa únicamente el 10% de las
EH en mujeres (2/19), mientras que en hombres representa el 33% (10/30).
Cuatro de los cinco casos de PL afectaron a hombres y constituyen en este
grupo el 13,3% de las EH (tabla 1).
Expresión del VEB
En conjunto se ha observado una expresión de VEB (EBER-1
y/o LMP-1 positivos) en un 40,8% de las EH (20/49). La edad media de los
pacientes con EH VEB+ era de 47,3 a. (DE: 23,11 a.), mientras que la edad
media de los pacientes VEB- era de 40,5 a. (DE:17,2 a.). En los pacientes
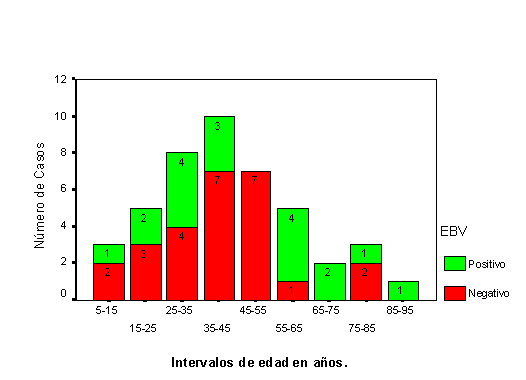
con edades inferiores a 25 años el VEB se expresaba en un 37% de
las EH (3/8), en los pacientes de entre 25 y 55 años el VEB se expresaba
en un 28% de las EH (7/25) y entre los pacientes de más de 55 años
se expresaba en un 72% (8/11) (tabla 2). Al agrupar
los casos en mayores de 55 años y menores de 55 años se observó
diferencia significativa en la expresión de VEB (c
2 =6,14, P=0,013). Al desglosar el grupo de los 25 a los 55
años destaca que entre los 25 a los 45 años se expresa en
un 38,9% (7/18) mientras que en la década siguiente (de 45-55a.)
no se expresa en ningún caso (0/7) (figura
4).
Un 40% (12/30) de las EH diagnosticadas en hombres y un 42,1% (8/19) de las EH diagnosticadas en mujeres expresaban VEB no observándose diferencias significativas al comparar ambas proporciones (tabla 1). Tampoco se observaba una diferencia significativa por sexos en la edad media de los pacientes VEB+ (48 a. en hombres y 47a. en mujeres).
Por subtipos histológicos, se observa que la CM es el grupo que con mayor frecuencia presenta expresión de VEB (58,3%, 7/12) mientras que EN sólo muestra esta asociación en un 37,9% (11/29), no existiendo diferencias significativas entre estas dos proporciones (c 2 =1,43, n.s). Ninguna de las 5 EH PL ha mostrado positividad para EBV. El único caso de DL presentaba positividad para VEB (tabla 3).
La técnica de EBER-1 detectó 20/49 casos positivos, mientras que la técnica de LMP-1 mostró positividad en 19 de éstos 20 casos detectados por EBER-1, siendo el resto negativos (tabla 3).
La expresión aislada de VEB en linfocitos pequeños no
tumorales se apreció en un 31% de nuestros casos con células
tumorales negativas. Esta positividad se observó únicamente
en la técnica de hibridación in situ para EBER-1 que es altamente
sensible y que pone de manifiesto linfocitos reactivos con infección
latente por el virus. La expresión de LMP estaba restringida a células
tumorales.
La EH representa aproximadamente entre el 20 y el 30% de todos los linfomas22 y en España entre el 26 y el 30%.23 En las comarcas de Tarragona, la EH constituye el 24% de todos los procesos linfoproliferativos (excluyendo LLC y mieloma)2 y muestra una incidencia ajustada a la edad de 2,5 casos/100.000 habitantes,24 similar a la de USA y Reino Unido que presentan tasas ajustadas a la edad de 2,4 y 2,2 casos por 100.000 habitantes.11 La evolución de la incidencia de la EH en Cataluña muestra una tendencia decreciente significativa del 7,5% en las mujeres que no se observa en los hombres, situación similar observada en el resto de registros del cáncer europeos y norteamericanos.25
En Cataluña, la EH representa el 0,8% de todas las neoplasias malignas en los hombres y el 0,3% en las mujeres. La EH, en nuestro estudio, predomina en hombres (61%), constituyendo las mujeres el 39% del total de casos. Esta mayor afectación de los varones se corresponde con las proporciones halladas en España19 y en todo el mundo.12
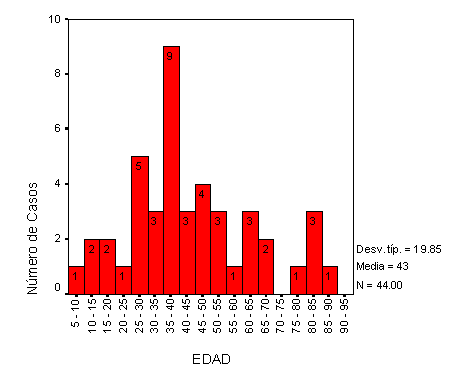
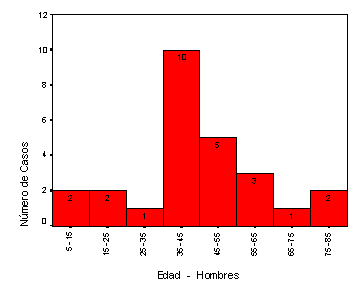
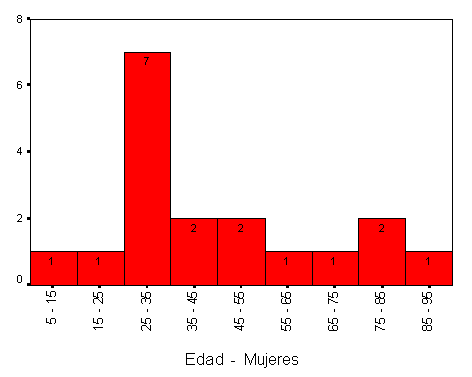
La máxima incidencia de EH, en nuestro estudio, se concentra entre los 25 y 55 años, presentando la EH infanto-juvenil y la del adulto-maduro y anciano una incidencia inferior. El pico de máxima incidencia en hombres se sitúa entre 35 y 40 años y en cambio, en el sexo femenino, la máxima incidencia se presenta una década antes, entre los 25 y 30 años, diagnosticándose en este periodo aproximadamente un tercio del total de las EH para este sexo. La edad media en el momento del diagnóstico para el sexo femenino es de 42 años, muy similar a la edad media de los varones que es 44 años; estos datos son similares a los obtenidos en estudios realizados en España (38,5 años en el hombre y 37,5 años en la mujer)19 y en Cataluña25 (41 años en mujeres y 40 años en los hombres).
La EN fue el subtipo histológico más frecuente (59%). CM fue el subgrupo siguiente (24,5%), seguido de PL (10,2%) y desapareciendo casi por completo el grupo de la DL (un solo caso) tras revisión histológica y utilización de criterios actuales siguiendo la clasificación REAL.20 Comparado con otros estudios realizados en nuestro país 19,23 y estudios de países vecinos11-14, nuestro estudio muestra una distribución por tipos histológicos similar con un predominio de EN (40-53%) seguido por CM (23-33%) y por PL (6,5-9%). La DL es un subtipo que en los estudios más recientes19,23 ha visto cómo su proporción ha disminuido de forma considerable respecto a estudios más antiguos.26 Este fenómeno es probablemente debido a que muchos casos antes clasificados como DL se ha visto que corresponden, tras marcaje inmunohistoquímico, a otro tipo de linfoma no hodkiniano, más frecuentemente del tipo anaplásico de células grandes.
La asociación entre la EH y el VEB ha sido demostrada en estudios previos de carácter epidemiológico, serológico y de biología molecular.1,5,21 Esta asociación es mayor en los países subdesarrollados que en los países desarrollados. En los países desarrollados, a pesar de poseer una mayor incidencia de EH, esta asociación con el VEB es menor. En un estudio español, el 51 % de las EH mostraban asociación con el VEB.19 Nuestros resultados confirman que esta asociación, en nuestra área geográfica, se corresponde con un 40,8%, datos similares a los obtenidos en la serie con más número de casos publicados y de carácter internacional (40%).12
La expresión de VEB en nuestro estudio es similar para ambos sexos, siendo incluso algo superior en el sexo femenino, aunque sin llegar a ser significativa la diferencia. Este hecho contrasta con los hallazgos en algunos estudios que muestran una expresión mayor en el sexo masculino, no significativa en algunas publicaciones19 y significativa en otras.1,12
La expresión de VEB ha sido detectada en todos los subtipos histológicos menos en los PL lo que apoya la idea que la EH PL es una entidad clínico-patológica distinta con diferente patogénesis.1,27 Si bien se observa una mayor expresión en el subtipo histológico CM (58,3%), no se observa diferencia significativa con el subtipo EN (37,9%) en nuestro estudio. En la mayor parte de estudios existe una mayor expresión en el grupo CM (70,4%) y una menor expresión en EN (23,2%).12,19
La expresión de VEB se produjo en una proporción variable pero próxima al 40% hasta la edad de los 45 años. En la década de los 45 a los 55 años, ninguna de las 7 EH diagnosticadas en este intervalo de edad mostraba expresión de VEB. Las EH diagnosticadas en pacientes de más de 55 años expresaban en un 72% VEB, observándose diferencias significativas con la expresión en pacientes menores de 55 años. El hecho de que la EH exprese VEB en una proporción mayor en los pacientes de edad superior a los 55-60 años es un hecho claramente referido y con expresión estadística significativa en la bibliografía11,12,19 al igual que ocurre en nuestro estudio.
El presente estudio muestra que la expresión de VEB en las EH
diagnosticadas en las regiones sanitarias de Tortosa y Reus, es similar
a la de España19 y a la de los países desarrollados.
Si bien factores geográficos, ambientales y genéticos
pueden jugar un papel importante en el desarrollo de la EH,3,12
el VEB parece jugar un papel fundamental en el desarrollo de aproximadamente
un 40% de las EH en nuestra área geográfica, siendo esta
proporción significativamente mayor en EH diagnosticadas a pacientes
mayores de 55 años, no existiendo diferencias en la expresión
por sexo y siendo mayor, aunque no de forma significativa, la expresión
en el tipo histológico CM.

|
|
|||
| Subtipo Histológico |
|
|
|
| PL |
|
|
|
| EN |
|
|
|
| CM |
|
|
|
| DL |
|
|
|
| NOS |
|
|
|
| Total (%) |
|
|
|
|
|
|||
| Edad (años) |
|
|
|
| <25 |
|
|
|
| 25-55 |
|
|
|
| 55 |
|
|
|
| Desconocida |
|
|
|
| Total (%) |
|
|
|
|
|
|||
| Subtipo Histológico |
|
|
|
| PL |
|
|
|
| EN |
|
|
|
| CM |
|
|
|
| DL |
|
|
|
| NOS |
|
|
|
| Total |
|
|
|