|
|
Autores: Dr. Wilberto J. Bouza Molina; Dr. Luis Zarrabeitía Oviedo Institución: INSTITUTO DE NEUROLOGIA Y NEUROCIRUGIA. La Habana. Cuba.Email: alonsof@infomed.sld.cuResumen Introducción Objetivos Material y Métodos Resultados Discusión Conclusiones Bibliografía Enviar Comentarios RESUMEN Los adultos y niños con lesiones estructurales expansivas o atróficas intracerebrales pueden presentarse con epilepsia refractaria al tratamiento médico. En el presente estudio se revisan 27 pacientes con edades comprendidas entre los 2 y 48 años, ingresados en nuestro centro con el diagnóstico de epilepsia refractaria y la demostración imagenológica de una lesión estructural, en el período comprendido de 1987 a 1996. El trabajo consiste en el estudio de los resultados alcanzados con la cirugía de la epilepsia, utilizando las siguientes variables: edad, duración de la epilepsia, semiología de las crisis, drogas anticomiciales y dosis empleadas, correlación electroencefalógrafica, neuropsicológica e imagenológica con el tratamiento quirúrgico realizado, el diagnóstico histológico y el control de las crisis, en un período de observación como mínimo de 6 meses después de la cirugía. Las lesiones encontradas fueron: gliomas de bajo grado, angiomas cavernosos, malformación arteriovenosa trombosada y atrofias con gliosis corticales. La cirugía consistió en la excéresis de la lesión (total o parcial) en asociación o no con la ablación del foco epileptogénico. Demostramos que la resección completa de la lesión epileptogénica y siempre que sea posible la realización de una corticotomía asociada, para eliminar el área epileptogénica, son los dos procedimientos que ofrecen mayores beneficios en el tratamiento quirúrgico de la epilepsia secundaria a lesiones estructurales. INTRODUCCIÓN La cirugía de la epilepsia data de más de dos milenios, la primera intervención fue la trepanación craneana. Sin embargo, no existen huellas en los cráneos prehistóricos europeos y andinos precolombinos que puedan explicar el porqué los hombres primitivos pensaron que la cabeza era la que producía las convulsiones, ni tampoco la razón de estas trepanaciones. Los trabajos de Broca (1876) nos hablan de supervivencia postquirúrgica, al observar áreas en estos cráneos con pérdida de sustancia que mostraban signos de cicatrización, lo cual indica que estos pacientes sobrevivieron. Desde entonces se considera aquellos cirujanos como precursores de la cirugía para el tratamiento de la epilepsia (1). Cantón en 1875 fue el primero en observar la actividad eléctrica de la corteza cerebral, también en esa época H. Jackson analiza la organización funcional de la corteza cerebral, observando la progresión de las manifestaciones clínicas de las crisis convulsivas. Fortuitamente en ese tiempo se introdujeron la anestesia y la asepsia, preparándose así el campo para las operaciones corticales de la epilepsia. La primera etapa en la era moderna de la cirugía de la epilepsia se acepta que comienza en 1886 cuando Sir Víctor Horsley trató tres pacientes por crisis refractarias al tratamiento médico con el propósito de curar epilepsias postraumáticas que se manifestaban por ataques jacksonianos y usualmente de origen central, utilizándose así por primera vez la cirugía resectiva con este fin en lesiones extratemporales (resección de una lesión cicatrizal cortical del lóbulo frontal como primer caso). En 1883, Jackson describe crisis de origen temporal y en 1898 el propio Jackson y Colman incriminan el origen uncinado de estas crisis (1, 2, 3). Con estos antecedentes comprendemos como a partir de los nuevos conceptos desarrollados por H. Jackson sobre la identificación de tejido cerebral epileptogénico "invisible" basado en la observación semiológica de la crisis y su confirmación por David Ferrier a partir de sus trabajos experimentales en monos, ambos estuviesen presentes como testigos durante la primera cirugía de Horsley (2). Desde entonces el trabajo conjunto de neurólogos, neurocirujanos y electrofisiólogos para este tipo de cirugía se ha utilizado de manera rutinaria. Hasta ese momento solo se podían localizar zonas epileptogénicas cercanas a neocorteza primaria o cuando había visibles lesiones estructurales en la cirugía, lo cual provocó cierto desinterés, señalado en la literatura germana de la época por Foester, Krause y Gachs, reportándose además la asociación de esta cirugía con parálisis residuales de pobre recuperación. La segunda etapa comienza con la introducción del electroencefalograma (E.E.G.) en 1929, la electrocorticografía ( E.Co.G.) en 1935 por Foester, su desarrollo en la década de 1940 y 1950 (1) y los entusiastas trabajos de Penfield, Falconer y Jasper al realizar por primera vez la resección del lóbulo temporal y el hipocampo, debido a la asociación de esclerosis temporo mesial y epilepsia. El fracaso de esta cirugía en muchos centros hizo que ocurriera un nuevo descenso y desinterés por estos procederes en las tres décadas siguientes, excluyendo algunos centros que mantuvieron su línea de trabajo y entre los que se pueden citar el hospital Maudsley de Londres y el Instituto de Neurología en Montreal, que hacían especial énfasis en el E.E.G. ictal e interictal, monitoreo intra y extracraneal, semiología de las crisis, lesiones estructurales y avance en las neuroimagen (4). La tercera etapa comienza en la pasada década de 1980 con la introducción de sofisticadas técnicas de monitoreo por computación, el reconocimiento del inadecuado control de las crisis con medicamentos de un gran número de pacientes, el deterioro intelectual de los mismos por el daño epiléptico en sí y por el uso de drogas anticomiciales, además de la posibilidad del monitoreo sanguíneo de las mismas, avances en la Tomografía Computarizada de alta resolución, el desarrollo de la Resonancia Magnética Nuclear que revela lesiones epilectogénicas pequeñas e insospechadas en el pasado, la introducción de la imagenología funcional y la introducción a la cirugía de avanzadas tecnologías como el aspirador ultrasónico, el láser, la cirugía exterotáxica, etc. Esto motivó el esfuerzo y la concentración de numerosos especialistas en centros de nueva creación, dedicados a la cirugía de la epilepsia por todo el mundo, ocasionando tal diversidad de opiniones acerca del tratamiento quirúrgico de la epilepsia como quizás no se encuentre en ninguna otra rama de la medicina. Es así que en 1986, en el Centenario de los trabajos de Horsley se realiza la Primera Conferencia Internacional para el tratamiento quirúrgico de la epilepsia, en Palm Desert California, lo cual favoreció un acercamiento entre estos centros, resolviéndose así muchas controversias y motivando un explosivo interés por este tipo de tratamiento. La Segunda Conferencia Internacional en Palm Desert se realizó en 1992 (2), donde se evaluaron los resultados de los seis años anteriores y el rápido progreso de la cirugía de la epilepsia en ese tiempo, creándose además el plan a seguir en la Década del Cerebro, esfuerzo al que Cuba no ha sido ajeno, retomando el tema en conferencias, simposios y talleres organizados en el país con participación de personalidades internacionales como Jerome Engel, en su visita a la ciudad de La Habana a comienzos de 1995. El interés por la cirugía se acrecienta si conocemos que el 80 por ciento de los pacientes epilépticos presentan crisis parciales, sabiendo que al menos el 20 por ciento de estos no tienen un adecuado control farmacológico y sumándole a ello el 10 al 15 por ciento de pacientes con epilepsias secundariamente generalizadas que no responden a las drogas antiepilépticas (2). Los expertos consideran que un tercio de estos casos son susceptibles de cirugía. Se conoce que aproximadamente quince millones de pacientes epilépticos no tienen un control adecuado de sus crisis y su calidad de vida esta afectada por las mismas o los efectos colaterales de las drogas antiepilépticas (3). En Estados Unidos se estima por cálculos conservadores que existen entre sesenta mil y ciento veinte mil candidatos a la cirugía (5), según datos de NIH (2). Cada año se suman quinientos nuevos candidatos, sin embargo hasta 1990 sólo se hacían mil quinientas operaciones anuales. En Gran Bretaña hay entre 750 y 1500 casos de epilepsia por año tributarios de cirugía, mientras solo se realizaban 150 operaciones por año (6). En Australia hay aproximadamente 1500 pacientes con pobre control de las crisis, estimándose que el 30 por ciento de ellos sean candidatos a cirugía, sin que las operaciones realizadas por año rebasen el 10 por ciento de esta cifra (7). En Cuba la prevalencia de la enfermedad es de 4 a 6 por cada 1000 habitantes (8). Esto puede significar que en Cuba haya aproximadamente 60 000 epilépticos y de ellos hasta un 20 por ciento (12 000) sufren epilepsia refractaria. Si los expertos consideran que un tercio de los casos refractarios son susceptibles de beneficiarse con la cirugía esto equivale a que en Cuba existen aproximadamente 2 400 candidatos a cirugía. Como puede apreciarse se trata de un problema de salud de amplia demanda, lo cual motivó a nuestro grupo de trabajo en el Instituto de Neurología y Neurocirugía a prestar atención y contribuir al desarrollo de esta línea de investigación, de donde se desprende el presente trabajo con el análisis de los primeros pacientes tratados con los nuevos conceptos de la cirugía de la epilepsia específicamente ante la presencia de lesiones estructurales intracerebrales. OBJETIVOS Generales Introducción y aplicación en nuestro medio un sistema de trabajo encaminado al diagnóstico y tratamiento de los pacientes con epilepsia refractaria.
Específicos
MATERIAL Y METODO Realizamos un estudio retrospectivo consecutivo de 27 pacientes con edades entre los 2 y 48 años ingresados en las salas de neurocirugía y pediatría, desde 1987 a 1996, en el Instituto de Neurología y Neurocirugía con el diagnóstico de epilepsia refractaria. Estos casos tuvieron, al menos durante 5 meses, tratamiento con drogas antiepilépticas de primera línea a dosis sanguíneas terapéuticas, en algunas oportunidades se presentaron intoxicaciones médicas por el uso de estas drogas, en otros casos se desarrolló alergia a medicamento, incapacidad laboral por los efectos del mismo y por estas razones podían ser incluidos bajo el término de Epilepsia Refractaria. Se partió de la premisa de haberse encontrado una lesión estructural ya fuera expansiva o atrófica del sistema nervioso central por tomografía. Un total de 13 niños comprendidos entre los 2 y 15 años y 14 adultos entre los 16 y 48 años fueron sometidos a procedimiento quirúrgico con el propósito de tratar la lesión, casi siempre de tipo oncológico y la epilepsia, presente por algún tiempo como único síntoma de su enfermedad. A todos los adultos y niños mayores de 10 años se les realizaron estudios neuropsicológicos por el departamento de neuropsicología del centro, aplicándose el test de Weshler a la mayoría de los casos. Los estudios electroencefalográficos cuantitativos de superficie con mapeos funcional cerebral fueron realizados también por el servicio de electroencefalografía de nuestro Instituto, con montajes múltiples (longitudinales y transversal) y análisis computarizados. Los estudios imagenológicos se basaron fundamentalmente en la Tomografía Axial Computarizada simple y contrastada con cortes axiales y coronales. La RMN y estudios funcionales como el SPECT se realizaron en casos esporádicos, debido a las dificultades de nuestro servicio para realizar dicho proceder. La angiografía cerebral se realizó en solo dos casos en los que se sospechó lesión vascular. No se realizaron pruebas de activación con tiopental, ni tampoco test de Wada, este último por no poseer los recursos necesarios. La E.Co.G. se utilizó durante la resección quirúrgica de 10 casos utilizándose el equipo (modelo 5, Grass, Quincy, Wass) de 16 canales con electrodos semiflexibles y puntas conductoras de oro y platino. La estimulación cortical se realizó en cuatro pacientes con estimulador bipolar a una separación de 5 mm con ondas de pulsos de 60 Hz en 1 m/sec y una intensidad desde 2 hasta 30 mA. La fase II del estudio encabezada por electrodos profundos no fue realizada por no contar con los medios necesarios. La cirugía se realizó con visión binocular microscópica (microscopio Leica). El procedimiento se realizó en la mayor parte de los casos bajo anestesia general y en 4 enfermos con sedación ligera (Fentanil 0,5 a 1 c.c) y anestesia local (lidocaina 0,25% y epinefrina(1:200 000). La preparación preoperatoria consistió primero que todo en la explicación a la familia de las características y peculiaridades de la cirugía, empleo de esteroides 24 horas antes (Dexametazona 0,75 mg/kg de peso o Betametazona a razón de 1 mg/kg de peso), disminución de la dosis de anticomiciales, y la profilaxis con antibiótico (Rocefin). Después de la apertura de la duramadre y la exposición de la superficie del cerebro, en los casos en que se utilizó la electrocorticografía, se procedió a la colocación del equipo, realizándose el registro de superficie donde se procedería a trabajar. Luego de identificada la lesión y de haberse determinado la zona de corteza con anomalías eléctricas, se realizó al mapeo y marcaje de la región apoyado en la estimulación cortical (en los casos en que se realizó). Este proceder nos sirvió como guía para la resección de la lesión y de la corteza vecina para el tratamiento de la epilepsia. Posteriormente, y con la referencia anatómica de las arterias y venas, girus y surcos, se procedió a la excéresis de la lesión con el uso de técnicas microquirúrgicas. En caso de ser necesaria la realización de lobectomías, estas se hicieron por las técnicas convencionales en dependencia del lóbulo en que se realizara y del hemisferio en que nos encontráramos. Los bordes de resección fueron biopsiados. La excéresis se extendió por lo general hasta la exclusión macroscópica de la lesión siempre que fue posible, la resección de la corteza perilesional se guió por los resultados de la E.Co.G. y el mapeo funcional realizado por la estimulación cortical. Luego se procedió a la realización de la E.Co.G. post resección para identificar zonas residuales de descarga y proceder a su excéresis, siempre que la región lo permitía. Se procedió posteriormente a la hemostasia absoluta del campo quirúrgico, cierre de duramadre y reposición ósea con sutura de piel. Siempre se dejó por 24 horas un drenaje epidural. El postoperatorio llevó el mantenimiento de la terapéutica anticomicial preoperatoria, uso de depletantes cerebrales y antibióticos por ciclo de al menos 7 días. En los casos en que se realizó la resección temporocortical anterior utilizamos la técnica de Penfield descrita en 1952 y modificada por Rasmussen (38). La resección se hizo por coagulación bipolar de la aracnoides y la píamadre a lo largo del giro temporal superior entre los ramos operculares (M3) de la arteria cerebral media. La perforación y apertura de la leptomeninges fue hecha con la punta del coagulador bipolar. Luego de ello se realizó la aspiración subpial de la corteza. La píaracnoides fue coagulada y dividida con microcirugía, los ramos arteriales temporales fueron identificados, coagulados y divididos en la fisura Silviana. La corteza de T1 se aspiró con succión débil, dejando intacta la pía temporal mesial sobre M2. Luego que las dos capas de la pía habían sido cortadas y separadas se procedió al corte del giro temporal superior. En bloque se resecó la superficie con una incisión hasta el polo, a lo largo de del giro temporal superior y de la fisura colateral inferiormente. En el hemisferio dominante con un largo de 4.5 cm de la fisura silviana y extendida a nivel del surco precentral pero no más allá, en el no dominante la resección se llevó hasta 5 cm. La incisión posterior fue por lo general a lo largo de una arteria o vena y se inclinó hacia la base de la fosa media en 45 grados. El borde anterior fue seguido a lo largo del borde anteroinferior del uncus, las venas puentes del polo temporal al seno esfeno parietal fueron coaguladas y cortadas. Después de la exposición de la superficie de la ínsula se hizo la incisión circunferencial anterior y posterior a través de la sustancia blanca hasta la superficie mesial del temporal con inclinación de 45 grados para evitar la radiación óptica, con el borde posterior a lo largo del girus fusiforme y por delante del uncus para luego trabajar la sustancia blanca de la vecindad del cuerno temporal y la amígdala. Resección extratemporalLos tipos de resección utilizada fueron:
Lobectomía frontal total: En el hemisferio no dominante comenzó a partir del borde frontal del giro precental, identificando previamente los giros pre y postcentral por estimulación cortical. La resección se hizo en dos tiempos. La resección en bloque de los tres giros frontales horizontales sobre la superficie lateral fue seguida por la resección de la parte anterior del giro cingulado a lo largo del cuerpo calloso, la corteza orbitaria posterior y el giro subcallosal, los cuales se resecaron solos. En el lóbulo dominante la resección fue por delante de la mitad del giro horizontal medio o preferiblemente identificando el surco frontal inferior por la anatomía arterial y venosa. Los 2.5 cm posteriores del giro frontal inferior fueron respetados. Resección frontal para mediana: Fue la extensión de la remoción desde la cresta frontal interna hasta el surco precental. Es esencial que la ablación del tejido se extienda al menos hasta la mitad del segundo giro frontal y preferiblemente recto al surco inferior para eliminar la oclusión de las arterías y venas. El giro cingulado fue también resecado evitando en lo posible el daño arterial. Resección parietal: Solo es posible después de una identificación meticulosa del giro postcentral. En el lado dominante los 2,5 a 3 cm posteriores a este giro pudieron ser resecados sin mucho déficit. En el hemisferio no dominante el resto del lóbulo parietal posterior al surco postcentral se pudo remover. En el lado dominante la resección estuvo limitada al giro parietal superior. Todas las piezas quirúrgicas fueron examinadas por el departamento de Anatomía Patológica de nuestro Instituto. Todos los pacientes recibieron drogas antiepilépticas al menos por algún tiempo en el período postquirúrgico, pasándose a monoterapia, por lo general la de primera línea, según el caso. En los casos en que las dosis fueron reducidas nos basamos en criterios clínicos como: más de 2 años sin crisis o solo auras esporádicas y en algunas oportunidades antes de este tiempo por la franca mejoría del trazado E. E. G. y de dificultades en la adquisición del medicamento La cirugía en pacientes despiertos fue utilizada en aquellos que bajo excelente relación médico/paciente se sintieron confiados y mostraron interés por cooperar con la cirugía, además que tuvieran lesiones en el hemisferio dominante o en áreas funcionales corticales primarias como corteza motora, sensorial, visual, audición y lenguaje y apoyados además en la imposibilidad de realizar mapeo funcional preoperatorio con el uso de electrodos profundos . El seguimiento postquirúrgico se realizó al menos por 6 meses por un grupo multidisciplinario de especialistas, determinándose el estado clínico y electroencefalográfico al mes, los 6 meses y al año. Se realizaron además estudios neuropsicológicos al mes, a los 6 meses y al año, dosificación del anticomicial a los 7 días postoperatorios, 3 meses y el año ante la sospecha de intoxicación o intolerancia a la droga. El seguimiento oncológico de la lesión se hizo bajo criterios oncológicos generales establecidos para los gliomas, excéresis lo mayor posible y según la variedad histológica modalidades terapéuticas coadyuvantes como la radioterapia. La reintervención quirúrgica se basó en criterios oncológicos, tratamiento de complicaciones quirúrgicas, sin realizarse ningún proceder específico para mejorar el fallo de la operación para el control de la epilepsia. Para establecer los resultados se tomaron y compararon variables como: edad, sexo, elementos clínicos asociados, características de la epilepsia, control bajo tratamiento médico, estudios neuropsicológicos, E. E. G., estudios imagenológicos, modalidad quirúrgica y estado postquirúrgico, los que fueron tomados de las historias clínicas, citas con el paciente y sus familiares. Para la clasificación de los resultados se utilizó la escala de Engel modificada (4). ESCALA DE ENGEL MODIFICADAGrupo I: Libre de crisis. A-Completamente libre de crisis después de la cirugía. B-Solo auras después de la cirugía. C-Algunas crisis después de la cirugía pero libre de ellas al menos por dos años. D-Solo crisis a la supresión del medicamento. Grupo II: Rara ocurrencia de crisis. A-Inicialmente libre de crisis pero raras ahora. B-Raras crisis después de la cirugía. C-Crisis ahora pero raras al menos por dos años. D-Solo crisis nocturnas. Grupo III: Meritoria mejoría de las crisis. A-Meritoria reducción de las crisis ( más del 90% ). B-Prolongado intervalo sin crisis pero menor de dos años. Grupo IV: No mejoría de las crisis. A-Significativa reducción de las crisis ( entre el 50 y 90% ). B-Poco cambio aparente ( reducción de menos del 50% ). C-Peor. Se excluyen las crisis postquirúrgicas tempranas ( primera semana ). El estadígrafo utilizado fue la prueba de la probabilidad exacta de Fisher, comparando los grupos extremos. RESULTADOS Se sometieron 27 pacientes a cirugía de la epilepsia (13 niños y 14 adultos) desde 1987 a 1996 con el diagnóstico de una lesión estructural y epilepsia refractaria al tratamiento médico. La epilepsia fue la única manifestación de su enfermedad, al menos por 5 meses de su evolución. De los 27 enfermos el 85% tenían tumores intraxiales, de ellos los más frecuentes fueron los gliomas de bajo grado de malignidad con un 52% y los gliomas mixtos con un 26%. Lesiones vasculares de tipo malformativo y las lesiones atróficas se presentaron solo en 4 pacientes. Los datos que se exponen en el presente trabajo fueron recogidos a los 6 meses de la evolución postquirúrgica. TABLA # 1. INCIDENCIA SEGÚN GRUPOS ETÁREOS
La edad de los pacientes operados estuvo entre los 2 y 48 años, con el 52% de ellos agrupados en las dos primeras décadas de vida y un 22% en la cuarta década. Ambos sexos se presentaron de forma similar con 13 pacientes femeninos y 14 masculinos. Veintiséis de ellos fueron diestros y no hubo ambidiestros.TIPOS DE CRISIS CONVULSIVAS QUE SE PRESENTARON EN NUESTRA SERIE Tabla # 2. TIPOS DE CRISIS CONVULSIVAS.
Las crisis generalizadas tónico-clónicas y las secundariamente generalizadas a partir de crisis parciales simples se presentaron en el 70% de los casos. Las crisis parciales simples y parciales complejas se presentaron en el 25% de los casos. Un solo paciente presentó más de un tipo de crisis . LOCALIZACION DE LA LESION/TIPO DE CRISIS Tabla # 3.LOCALIZACION DE LA LESION/TIPO DE CRISIS
T/C G - Tónico-clónica Generalizada PSM - Parcial Simple Motora PSG - Parcial Simple Generalizada PC - Parcial Compleja MÚLTIPLE - Más de un tipo de crisis Encontramos que el 81% de los casos tenían lesiones estructurales localizadas en los lóbulos temporal (7 pacientes) y frontal (7 pacientes) o la combinación de uno de ellos con el lóbulo parietal ipsilateral (8 pacientes). Predominaron las lesiones en el hemisferio izquierdo (63%). En el lóbulo frontal se presentó la mayor variedad de crisis, por otra parte, los pacientes con lesiones restringidas al lóbulo temporal solo presentaron crisis parciales, predominando las crisis parciales complejas (5 enfermos). MANIFESTACIONES CLINICAS ASOCIADAS/TIEMPO/FRECUENCIA/DURACIÓN DE LAS CRISIS. Tabla # 4.MANIFESTACIONES CLINICAS ASOCIADAS EN NUESTRA SERIE
La cefalea en un 42% y las hemiparesias en un 37% fueron las manifestaciones clínicas más frecuentes en nuestra serie, seguidas en orden decreciente por los defectos campimétricos, alteraciones de memorias, afasias y papiledema. Todas ellas aparecieron siempre al menos 5 meses después del comienzo de la epilepsia. La frecuencia y duración de las crisis así como su control con las drogas anticomiciales se determinó individualmente. No encontramos que existiera una relación directa entre estos parámetros y el tipo de crisis, localización de la lesión y su tipo histológico. PROMEDIO ENTRE EL DEBUT DE LA EPILEPSIA Y LA CIRUGÍA El tiempo promedio entre el comienzo de la enfermedad y la cirugía fue de 20 meses. Hay que señalar, no obstante, que las lesiones en la vecindad del área central (frontoparietal) tuvieron un tiempo de evolución mucho más corto, 6 meses para los niños y 3 meses para los adultos.RELACIÓN/TIPO HISTOLOGICO/TOPOGRAFIA TANTO EN NIÑO COMO EN ADULTOS Los tumores fueron el tipo histológico que prevaleció en nuestra serie, presentándose en 11 niños y 12 adultos para un total de 23 enfermos. Además se presentaron dos lesiones atróficas en pacientes adultos, una secundaria a un infarto cerebral y la otra de etiología no precisada. También encontramos dos malformaciones vasculares (una malformación arteriovenosa trombosada y un angioma cavernoso ) entre los niños. En los niños los tumores fueron más frecuentemente extratemporales (9 de 11 casos); en los adultos las lesiones temporales (6 casos ) y las extratemporales (8 casos) se presentaron con una frecuencia similar. En total el 70% de las lesiones tenían una localización extratemporal . CLASIFICACION HISTOLOGICA DE LOS TUMORES . Tabla # 5.CLASIFICACION HISTOLOGICA DE LOS TUMORES.
Fuente: Historias Clínicas. I.N.N.
El astrocitoma de bajo grado se presentó en el 52% de los pacientes (5 niños y 8 adultos ) seguidos por los gliomas mixtos en el 26% de los casos (3 niños y 3 adultos). En un niño el estudio histopatológico reveló la presencia de un tumor neuroepitelial disembrioplástico al igual que un oligodendroglioma y un ependimoma. Otro de los casos fue un adulto portador de un colesteatoma. EXAMENES COMPLEMENTARIOS ELECTROENCEFALOGRAFIA Tabla # 6.HALLAZGOS DEL ELECTROENCEFALOGRAMA PREOPERATORIO
Los estudios electroencefalográficos se realizaron en la totalidad de los casos encontrándose como hallazgos más frecuentes el sufrimiento cerebral focal (22%), el paroxismo focal (30%) seguido por la asociación de sufrimiento y paroxismo focal (15%), sufrimiento cerebral unilateral (15%) y estudios normales con un 15% de presentación. Solo un caso presentó sufrimiento cerebral bilateral. ESTUDIOS NEUROPSICOLOGICOS Gráfico 1.
Se realizaron 20 estudios neuropsicológicos. En 13 pacientes (48%) el estudio contribuyó a la localización de la lesión al demostrar signos de disfunción cortical focal. El 22% de ellos fueron normales y un estudio no fue útil. No se realizaron 7 pruebas neuropsicológicas y fue en aquellos pacientes menores de 9 años. IMAGENOLOGÍA La tomografía axial computarizada (TAC) fue realizada en el 100% de los casos, tanto pre como postquirúrgica, lográndose el diagnóstico de la presencia, localización y extensión de la lesión estructural. Encontramos además que el 13% de las pruebas no contrastadas fallaron en demostrar la lesión, mientras los estudios contrastados sí la demostraban. RESONANCIA MAGNÉTICA NUCLEAR La Resonancia Magnética Nuclear se realizó en 8 pacientes, 5 preoperatorios y 3 postoperatorios. No se hizo el análisis por no coincidir en ningún paciente, a los que se les realizaron los estudios, las imágenes pre y postoperatorias. ANGIOGRAFÍA Se realizó en los 2 pacientes con lesiones vasculares previo al tratamiento quirúrgico. TOMOGRAFÍA POR EMISIÓN SIMPLE DE FOTONES El SPECT se realizó en 8 pacientes. Todos fueron normales y previos a la cirugía. TIPO DE CIRUGÍA EMPLEADA/MÉTODOS UTILIZADOS PARA DETERMINAR EL MARGEN DE RESECCIÓN. Tabla # 7.TIPO DE CIRUGÍA EMPLEADA Y MÉTODO PARA DETERMINAR EL MARGEN DE RESECCIÓN
E. Co. G: Electrocorticografía. Fuente: Historias Clínicas. I.N.N.
Los tipos de cirugía realizados fueron:
En los pacientes que se sometieron a excéresis total sin corticotomía se realizaron: una electrocorticografía, 4 biopsias de los bordes de resección y una estimulación cortical. En los pacientes con excéresis parcial, como único proceder quirúrgico, no se realizó ninguno de los procederes antes mencionados . En los pacientes con excéresis total y topectomía asociada, se realizaron siete electrocorticografías, 3 biopsias de los bordes de resección y también tres estimulaciones corticales. En los casos en que se realizó excéresis parcial más corticotomía se muestrearon 2 E. Co. G., y se tomaron 2 biopsias de los bordes de resección. La estimulación cortical fue realizada siempre en pacientes operados con anestesia local . COMPORTAMIENTO DE LAS CRISIS POSTQUIRÚRGICAS SEGÚN LA ESCALA DE ENGEL En el grupo I se encuentran 10 pacientes (37%); de ellos 7 completamente libre de crisis (IA), 1 con solo auras después de la cirugía (IB), 2 con crisis a la supresión del medicamento. Cinco pacientes estuvieron inicialmente libre de crisis pero estas son raras ahora (IIA). Dos pacientes están con crisis nocturnas solamente para un total de 7 enfermos (26%) en el grupo II de la escala. Cuatro pacientes presentaban una meritoria mejoría del número de crisis (más del 90% de las crisis) y quedan en el grupo IIIA de Engel. Dos casos estuvieron un tiempo libre de crisis pero ahora tienen una razonable reducción del número de crisis (aproximadamente el 90% de ellas) para enmarcarse en el grupo IIIB de la citada escala. En total se encuentran en este grupo 6 enfermos (22%). En el grupo IV se encuentran cuatro pacientes (15%), 3 con una reducción del 60 % de las crisis (IVA) y un paciente con reducción del 30% de los ataques (IVB). TIPO DE CIRUGÍA Y SUS RESULTADOS Tabla # 8TIPO DE CIRUGÍA Y SUS RESULTADOS CON RESPECTO A LA EPILEPSIA POR ESCALA DE ENGEL
En las edades pediátricas se realizaron excéresis parciales en 8 de 13 pacientes, al resto se le realizó excéresis total sin topectomía. En los adultos se realizaron todas las modalidades de tratamiento planteadas (tabla: 7), siendo la corticotomía una condición exclusiva del adulto. La excéresis total sin corticotomía se realizó en 6 pacientes, de ellos 5 niños de los cuales tres estaban ubicados en el grupo I de la escala, uno en el grupo II y el otro en el grupo III, al evaluar los resultados postquirúrgicos con respecto a la mejoría del número de crisis según la escala de Engel. La excéresis parcial se realizó en 11 pacientes, de ellos 8 eran niños, 4 clasificados en el grado II, uno en el III y tres en el grupo IV en su evolución posterior. La excéresis parcial más corticotomía fue realizada en dos adultos, uno en el grupo I y otro en el III de la escala aplicada a los 6 meses posteriores al tratamiento quirúrgico. La excéresis total más corticotomía se realizó en 8 adultos de los ocho pacientes en los que se efectuó el proceder. Estos pacientes, al ser aplicada la escala de evaluación postquirúrgica a los 6 meses, se encontraban de la forma siguiente: cinco pacientes en el grupo I, dos en el II y uno en el III. RELACIÓN ENTRE LA MEJORÍA DE LAS CRISIS Y LOS ESTUDIOS ELECTROENCEFALOGRÁFICO Y NEUROPSICOLÓGICO Tabla # 9.RELACIÓN MEJORÍA DE LA EPILEPSIA Y DE LOS ESTUDIOS ELECTROCORTICOGRÁFICOS Y NEUROPSICOLÓGICOS.
Las mejorías en el estudio neuropsicológico consistieron en una mayor cooperación del paciente al estudio con mejor atención y concentración o mejorías en la memoria verbal y de corto plazo, coeficiente de inteligencia con igual o mejor puntuación. Con respecto a los datos que señalaban mejoría en los estudios E.E.G. se encuentran: mejor organización del trazado de base, mayor simetría y modulación del mismo, disminución de la actividad lenta y cese o disminución de las descargas paroxísticas focales. De los 10 pacientes del grupo I, a 9 se le realizaron estudios neuropsicológicos con mejoría en 6 (66%) de estos. A la totalidad de los pacientes en este grupo se les realizó E.E.G., el 70% de estos tenían mejoría. Tres de los 5 pacientes del grupo II a los que se le realizó estudios neuropsicológicos postquirúrgicos tenían mejoría y 4 de los 7 enfermos evaluados con E.E.G., también tenían mejoría de este. De los cuatro pacientes del grupo III de la escala a los que se le realizó estudios neuropsicológicos 2 tenían mejoría de los mismos y 3 de los 6 E.E.G. realizados también estaban mejor. En el grupo IV no se encontró mejoría en los 2 casos a los que se les realizaron estudios neuropsicológicos y solo un paciente de los 4 con E.E.G. tenía mejoría del estudio. RESULTADOS Y SU RELACIÓN A LOS MÉTODOS PARA DETERMINAR LA EXTENSIÓN DE LA RESECCIÓN. TABLA # 10.RESULTADO Y SU RELACIÓN CON EL MÉTODO PARA DETERMINAR LA EXTENSIÓN DE LA RESECCIÓN.
En el grupo I y II se encuentran los pacientes a los que se le realizó el 90% de los estudios E.Co.G., el 88% de la biopsia de los bordes de resección y el 100% de las estimulaciones corticales . MEJORÍA DE LA EPILEPSIA CON RESPECTO A NIÑOS Y ADULTOS Gráfico 2. Fuente: Historias Clínicas.
I.N.N.
Fuente: Historias Clínicas.
I.N.N.
En el grupo I están fundamentalmente pacientes con lesionectomía total 9 de 10 casos, predominando dentro de este grupo los enfermos adultos a los que se asoció corticotomía. En el grupo II se encuentran 4 excéresis parciales y una total entre los pacientes pediátricos y dos totales con topectomía en adultos. En el grupo III entre los adultos encontramos 2 excéresis parciales, una de ellas con topectomía y 2 con excéresis total, también una de ellas con topectomía. De los dos niños uno tiene realizada una excéresis parcial y otro una total, ambas sin topectomía. En el grupo IV aparecen 3 niños, todos con excéresis parcial únicamente y un adulto con excéresis total sin corticotomía. DROGAS ANTIEPILÉPTICAS EN EL POSTOPERATORIO\RELACIÓN CON LOS GRUPOS DE LA ESCALA DE ENGEL En el grupo I están tres pacientes que se encuentran libres de la medicación, uno con excéresis total y dos con excéresis total más topectomía. En el grupo II solo un paciente está libre de medicación, presenta solo auras esporádicas correspondiendo al grupo de los que fueron sometidos a corticotomía y excéresis total. Todos los pacientes del grupo III y IV se encuentran con medicamentos antiepilépticos. El 85% de los pacientes estaban con monoterapia al momento del estudio y solo el 15% con politerapia, los que correspondían al grupo IV. Las drogas más utilizadas fueron: Fenitoína, Carbamazepina, Valproato de Sodio y Fenobarbital. MORBILIDAD Y MORTALIDAD POSTQUIRÚRGICA Tabla # 11.MORBILIDAD NEUROLÓGICA POSTQUIRÚRGICA
Los defectos neurológicos que más se presentaron fueron: las hemiparesias, de ellas una provocada como efecto directo de la cirugía como daño permanente, y dos alteraciones de la memoria (fundamentalmente verbal), también como daño permanente y como complicación de la cirugía. No tuvimos fallecidos a causa de la cirugía. Como se puede apreciar 3 pacientes (11%) de un total de 27 sufrían en el momento del estudio (6 meses) de daño permanente dependiente de la cirugía. Dos pacientes sufrieron de meningoencefalitis postquirúrgica los que resolvieron con tratamiento médico. Un niño necesitó ser reoperado al mes por un hematoma subdural sin daño secuelar posterior. Otros dos pacientes se operaron entre el primer y tercer año de su evolución, ambos con excéresis parcial de la lesión como el proceder primario empleado e irradiados posteriormente. En estos casos existía la demostración imagenológica de recurrencia tumoral, decidiéndose entonces la toma de muestra por biopsia esterotáxica (a cual demostró cambios histológicos de malignidad) y braquiterapia intersticial. Uno de ellos falleció (niño), a los 18 meses de la primera cirugía, con el diagnóstico de astrocitoma anaplásico. La terapia coadyuvante más empleada para el tratamiento oncológico de la lesión fue la radioterapia de campo. La misma se aplicó al 56% de los casos con tumores. Fueron excluidos de esta opción los pacientes con astrocitomas grado I, tumores neuroepiteliales disembrioplásticos y astrocitomas grado II cuya excéresis fue total, demostrado tanto al momento operatorio como con los estudios imagenológicos postquirúrgicos. DISCUSION En nuestra serie encontramos que un 52 % de los enfermos operados eran menores de 20 años, siendo el más pequeño de 2 años y el mayor de este grupo con 18 años. Nos parece que esta distribución se corresponde con el hecho de que la mayor parte de las epilepsias tienen su debut en este mismo período de la vida (30). Si consideramos además que solo se escogieron enfermos con lesiones estructurales y epilepsia refractaria, pensamos que se justifican los resultados que presentamos, coincidiendo con Drake (31) que en un estudio de resección cortical y epilepsia focal encontró que el 28% de los pacientes operados que tenían un tumor eran menores de 15 años. Vimos además un pequeño pico porcentual en la cuarta década de la vida (22 %) lo cual puede corresponder con la tendencia conocida de que los gliomas de bajo grado de malignidad se encuentran en este período de la vida del adulto y más aún cuando la única manifestación de su enfermedad fue la epilepsia tardía (16). La distribución de los sexos fue homogénea coincidiendo con la mayor parte de la literatura revisada (3,7,14,16). Y como cabría esperar en una serie donde los tumores malignos que predominan en el sexo masculino están excluidos. La manualidad diestra corresponde con la distribución de la misma en la población general. Las crisis generalizadas tónico-clónicas desde su inicio y las secundariamente generalizadas a partir de crisis parciales simples fueron de hecho las modalidades convulsivas con que se expresó la enfermedad en un 70 % de los casos. Lo anterior pensamos se corresponde con la mayoritaria presencia de lesiones extratemporales en nuestra casuística (70%). Es muy probable que las crisis tónico-clónicas generalizadas desde su inicio lo sea solo en apariencia y en realidad tenga un inicio focal no determinado por la clínica, pero que es evidente en el grupo de pacientes de nuestra serie dada la presencia de una lesión estructural definida por la imagenología y el hallazgo de alteraciones focalizadoras en los estudios E.E.G. Partiendo del hecho de que la topografía extratemporal se ve asociada con frecuencia a una mayor variedad de crisis, debido a la multifocalidad del área epileptogénica (39) (tan solo en el lóbulo frontal encontramos 6 tipos de crisis parciales simples), y por otro lado la existencia de vías de propagación rápida ipsi y contralateral que facilitan la generalización, pueden entonces comprenderse los resultados encontrados por nosotros. En la literatura internacional está bien descrito que un mismo síndrome epiléptico de topografía extratemporal puede ser generado por varios tipos de lesiones y a su vez una misma lesión puede provocar varios tipos de crisis (39, 40). Es conocido que del 20 al 40 % de todos los tipos de crisis son crisis parciales complejas (CPC) y según JOVANOVIC, y los resultados de los programas quirúrgicos de la UCLA y la Universidad de Yale (39) entre el 70 y 85 % de la CPC se originan en los lóbulos temporales. Coincidiendo con estos conocimientos bien establecidos, vemos que la totalidad de las CPC en nuestros casos se originaban en los lóbulos temporales. Como podemos ver en nuestra propia serie, crisis generalizadas desde su inicio, generalizadas secundariamente y parciales complejas son las más frecuentes y, de hecho se acepta por muchos autores que son estas las de más difícil control con tratamiento médico (41,42). Incluso se plantea que las crisis parciales secundariamente generalizadas son un factor de pobre pronóstico, a tener en cuenta para el tratamiento quirúrgico de la epilepsia (30,43). La cefalea y la hemiparesia fueron la combinación de síntomas y signos que con más frecuencia se asociaron a la epilepsia en nuestros casos. Habitualmente estos pacientes presentaban una epilepsia crónica, refractaria a los medicamentos, con un tiempo de evolución promedio de 20 meses entre el comienzo de las crisis y el momento de la operación. En muchas ocasiones sus médicos no sospecharon o pensaron que habían excluido la posibilidad de un tumor. Es por ello que con la progresión de la enfermedad subyacente a la epilepsia se suman a las crisis los síntomas y signos que obligan a estudios complementarios que finalmente hicieron el diagnóstico de la lesión estructural epileptogénica (43). Confirmando esta idea podemos ver como en nuestra serie todos los casos con lesiones en la vecindad del área central demoraron mucho menos en llegar a la cirugía (entre 3 y 6 meses solamente) dada su gran expresividad y valor localizador tanto desde el punto de vista de la semiología de las crisis como desde los signos deficitarios locales que se le asocian. Es digno señalar entonces que, la demora en el diagnóstico y en operar a los enfermos entorpecen en su recuperación y el control de la epilepsia, además de propiciar el pobre control sobre lesiones con potencial maligno. Podríamos concluir entonces que en todos los pacientes en los que la clínica sugiera un inicio focal de las crisis y en los que aparezcan dificultades en su manejo medicamentoso deben ser sometidos a la investigación necesaria para definir la presencia de una lesión estructural. Como vemos el 70 % de nuestras casos tenían una lesión extratemporal, lo que pensamos está relacionado, en primer lugar a que el estudio en su mayoría incluye pacientes epilépticos intratables con lesión expansiva intraxial de tipo tumoral y en segundo lugar a que las lesiones no neoplásicas (displasias corticales, microdisgenesias) son menos frecuentes. Todo esto, unido a la pobre resolución de los estudios imagenológicos utilizados, encabezado por el escaso uso de la RMN y las técnicas especiales de diagnóstico por TAC (43) (modelo Oxford de cortes temporales en el eje de ese lóbulo) no nos ayudó a diagnosticar lesiones de etiología no tumoral que ahora escaparon al estudio. Además de reconocer que a pesar de realizarse estos estudios tomográficos sobre el temporal, el diagnóstico de lesiones expansivas es difícil y sobre todo cuando tienen poco tamaño, y sumando a ello que la impresión que uno se lleva al revisar la literatura es que la esclerosis mesial del temporal es frecuente, la casuística que llega a nosotros con este cuadro clínico es poca. Si le sumamos que la serie recogida de niños llega hasta los 2 años como mínimo, grupo de edad donde predominan los tumores de topografía extratemporal, al igual que en el adulto, la serie se hace francamente dominante hacia la topografía extratemporal. La descripción de actividad eléctrica paroxística focal en el E.E.G., así como su asociación con actividad lenta también focal, e incluso unilateral, se describen como hallazgos electroencefalográficos interictales frecuentes en los pacientes con epilepsia asociada a lesiones estructurales intracraneales (44). Incluso se plantea son elementos de gran valor para la demostración E.E.G. de la relación entre la lesión y el área epileptogénica (45). En nuestra serie se recogen estos elementos en 18 pacientes, lo que quiere decir que el 66% de nuestros estudios preoperatorios interictales fueron efectivos en localizar el área epileptogénica, y en todos los casos a demostrar que el foco estaba situado en la cercanía de la lesión. Aunque el por ciento es relativamente bajo con respecto a lo revisado en la literatura internacional (44) donde plantean hasta un 87% de correlación, no creemos sea contradictorio si nos basamos en que nosotros solo realizamos estudios E.E.G. interictales de breve duración, sin monitoreo con video (video E.E.G.), ni seguimiento continuo del mismo al menos por veinticuatro horas, ni tampoco la implantación de electrodos profundos, elementos de inobjetable valor en este tipo de cirugía. Pensamos que la mayor cooperación al estudio, la confianza del médico en retirar la medicación, y provocar crisis en edades adultas hayan influido en que el 57% de los pacientes con signos focalizadores paroxísticos se agrupen en edades adultas. Como vemos, la demostración del área epileptogénica es evidentemente un evento eléctrico en nuestra serie y esta tuvo una demostración del 100% por electroencefalograma preoperatorio para los casos en que se realizó la corticotomía (10 pacientes). La demostración neuropsicológica de daño focalizador y su correlación con la topografía lesional en nuestra serie fue de un 48%, con respecto a un 62% de los resultados que se recogen en la literatura internacional (44). Pensamos que esté relacionado con el poco tiempo con que se aplican los nuevos test de atención y memoria protocolizados en nuestro centro para el paciente tributario de cirugía como tratamiento de la epilepsia. Creemos que a medida que aumente la experiencia se producirá un ascenso en los resultados de este estudio. La TAC jugó un papel fundamental en nuestra serie pues la demostración de una lesión estructural asociada a la epilepsia fue uno de los requisitos para la inclusión del paciente en este estudio. Con mayor definición en los estudios contrastados de hasta un 13% superior al estudio simple. Los estudios funcionales como el SPECT se realizaron en 8 pacientes de nuestra serie sin que en ninguno de ellos se lograran resultados alentadores, lo que pensamos se corresponde a la escasa experiencia de trabajo al respecto en nuestro país. Como podemos apreciar la mayor parte de los procederes auxiliares para determinar el margen de resección corresponde con el grupo de pacientes a los que se les realizó excéresis total, ya fuese asociada o no a la corticotomía (Tabla 7). Lo que se corresponde con una mejor identificación de la lesión y del área epileptogénica por los estudios preoperatorios y transquirúrgicos (E.Co.G.). Lo que representa que el tipo de cirugía y los procederes empleados para determinar el margen de resección dependen y pueden incluso variar en el acto operatorio según el método de localización del área epileptogénica y su relación con áreas corticales funcionales primarias. Sólo en el 37% de nuestros pacientes se logró un registro electrocorticográfico cuyo registro fue lo suficientemente útil como para explorar el área sospechosa de epileptogénesis, lo que se debió a que la mayoría de los pacientes fueron operados bajo anestesia general con gases inhalantes (Oxido Nitroso y Halotane), los que interfieren en la obtención de un adecuado registro (46), además de la pobre preparación de nuestros salones para este proceder lo que facilita la frecuente interferencia de 60 ciclos que registra el equipo, haciendo muy engorroso y prolongado el acto quirúrgico. Solo en el 33% de los enfermos se realizó la biopsia de los bordes de resección debido a la falta de costumbre del cirujano de muestrear la zona quirúrgica, por lo general determinada bajo visión macroscópica e incluso el reconocimiento de que estas muestras de los bordes no necesariamente tienen que ser examinados en el momento de la cirugía. Elemento no solo útil para reconocer la excéresis total, sino también para determinar la modalidad coadyuvante de tratamiento oncológico para las lesiones de tipo tumoral. Si relacionamos estos datos con el comportamiento de las crisis según la escala de Engel y el tipo de cirugía empleada podemos apreciar que la mayoría de los pacientes (17 enfermos) se encuentran en los grupos I y II de la escala, correspondiéndose con los enfermos sometidos a la excéresis total con o sin topectomía asociada, con respecto a los demás procederes empleados, aunque la muestra es muy pequeña para tener un aval estadístico que los diferencie. Esto nos hace pensar que en nuestra serie la mejoría de la epilepsia dependió más de la extensión de la resección lesional que de la identificación del área epileptogénica y su ablación, sin negar que existe una diferencia de aproximadamente un 20% de mejoría en el grupo de pacientes a los que se les realizó este proceder sin que empeorará la condición neurológica de los enfermos. En la literatura internacional se encuentran diversos criterios respecto al uso de la E.Co.G. como método de identificación del área epileptogénica. Por ejemplo, Kirkpatrick (47), Falconer (48), Goldring (15), y otros (20, 24, 49) encontraron que la E.Co.G. no fue un buen predictor para identificar el área epileptogénica e incluso en la relación con los resultados de la cirugía, mientras que Berger (50), Boon (51), Rasmussen (19), y otros (14, 23) encontraron que, el proceder tenía una excelente concordancia con la mejoría de los pacientes operados e incluso con los requerimientos de drogas antiepilépticas postoperatoria, mayormente en niños y en pacientes con estados epilépticos crónicos, así como en los que se hallaron focos múltiples perilesionales. Nosotros coincidimos con este último planteamiento avalado porque el 70% de los pacientes donde se empleó este proceder de forma efectiva se encontraban en el grupo I de la escala de Engel. Respecto a la guía por biopsia de los bordes de resección Goldring (15) y otros autores (18) guían la cirugía por márgenes oncológicos con excelentes resultados en la mejoría de las crisis (86%). Con nuestra pequeña muestra de 9 enfermos en los que se realizó esta guía obtuvimos un 77% de mejoría en los resultados por lo que pensamos constituye un elemento a tener en cuenta al momento de la resección, tanto en la total como en la extensión de la parcial. La estimulación cortical ha sido también empleada para el mapeo cortical intraoperatorio aunque la ausencia de respuesta no indica necesariamente ausencia de función (40). Es una guía bastante segura para el paciente cuya lesión o área epileptogénica se encuentra cercana a una zona cortical primaria .Con un 100% de efectividad en nuestros 4 enfermos. En la mayoría de la literatura revisada (3, 15, 16,17, 27, 50, 51) parece estar bien establecido que la mejoría de la epilepsia postquirúrgica depende por sobre todas las cosas de la extensión de la resección. Aunque es digno señalar que aún se reportan series en las que se le da poco valor a esto(47). En nuestra serie encontramos que el 78% de los pacientes a los que se le realizó excéresis total se encontraban en los grupos I y II de la escala de Engel, lo cual esta en concordancia con los reportes de la literatura internacional donde se recogen rangos de mejoría entre un 80 y un 86 por ciento de mejoría de las crisis para este tipo de cirugía. La técnica estereotáxica parece ser superior a los demás procederes neuroquirúrgicos para localizar lesiones intracraneales con menor morbilidad. La excéresis total por esta técnica en la cirugía de la epilepsia parece ser buena indicación, sobre todo, en los casos con epilepsia controlada y lesión en áreas elocuentes. Su limitante está en el trabajo sobre el área epileptogénica (16, 17). La corticotomía asociada a la excéresis de la lesión (51, 52, 20) parece ser un proceder que ayuda a la mejoría en el control de las crisis siempre y cuando pueda ser empleada (reconocimiento previo del área epileptogénica y demostración de que el área de corteza a resecar no traerá nuevos déficits al paciente). En nuestra serie de 10 pacientes en los que se realizó corticotomía encontramos un 20% de mejor pronóstico que los pacientes con excéresis solamente, sin aval estadístico debido a lo escasez y distribución de la muestra. Incluso su asociación con la excéresis parcial contribuyó a mejorar al enfermo sin que estos casos quedaran libres de crisis, lo que también está bien recogido en la literatura revisada (47, 23). Con esto se demostró además que la excéresis parcial como tratamiento único es desfavorable para el control de la epilepsia con respecto a cualquiera de los restantes procederes empleados, con un nivel de significación de 0.04. Este resultado coincide con el criterio establecido internacionalmente, según reportes de Awad y Rosenfeld (20). Como vemos el 63% de los pacientes sometidos a la cirugía de la epilepsia se encontraban en el grupo I y II de la escala de Engel en los que se recoge una mejoría de más del 90% de las crisis, el 22% de nuestros casos se encontraban en el grupo III y sólo un 15% en el grupo IV. Los resultados se corresponden con los datos reportados por Engel (2) en 1993 de la cirugía lesional y resectiva de un 66.6% libre de crisis y un 21.5% con mejoría de las crisis y los de Hirsch (35) con un 57% libre de crisis sin medicamentos y un 24% libre con medicamentos con un 19% con lesión. Nosotros tenemos un 15% de mal resultado en una serie más pequeña y casi todos con medicamento. La poca realización de corticotomía en niños se debió a que fue el grupo de mayores excéresis parciales, no se usó el criterio de topectomía y excéresis parcial en niños inicialmente y a la pobre contribución de los estudios encefalográficos en localizar el área epileptogénica y el escaso uso de la electrocorticografía. A lo que se suma que sólo realizamos estudios de la fase I del protocolo quirúrgico. Elementos bien resueltos para la mayoría de los centros dedicados a la cirugía de la epilepsia (42, 45, 44, 16). La concordancia entre la mejoría del número de crisis y los resultados neuropsicológicos y electroencefalográficos son bien recogidos en la literatura internacional (44, 47), nosotros encontramos para los pacientes del grupo I una mejoría del 66% en los estudios neuropsicológicos y del 70% en los estudios electroencefalográficos, para descender de forma recíproca en los demás grupos hasta encontrar que no había mejoría neuropsicológica en el grupo IV y sólo un caso con mejoría del E.E.G., lo que coincide con la literatura internacional. Como podemos apreciar en el gráfico II tanto en niños como en adultos la mejoría dependió más de la extensión de la excéresis lesional y en menor medida de la asociación a topectomía que de los grupos etáreos e incluso de la localización del área epileptogénica. Lo que nos hace plantear que fue la lesionectomía la que logró los mejores resultados con respecto al control de las crisis y que este, aparentemente parece poderse incrementar con el uso de la corticotomía asociada . La excéresis parcial si se combina con la topectomía puede mejorar los resultados sin llegar a alcanzar resultados excelentes lo que está en correspondencia con lo revisado en la literatura respecto al tema (3, 15, 16, 51, 52, 50). De los pacientes incluidos en nuestro trabajo solo el 14% está libre de la medicación antiepiléptica los cuales se encuentran en los dos primeros grupos de la escala de Engel. Lo que se debe a que este trabajo recoge la evolución de estos pacientes en los primeros 6 meses del seguimiento postoperatorio momento en el que aún no habían cumplido los requisitos establecidos para la retirada del medicamento según nuestro protocolo. Los casos libres de las drogas se debían a intolerancia hacia las mismas, intoxicaciones e inestabilidad en el consumo. El 88% de los pacientes se mantuvieron después de la cirugía con monoterapia y sólo 4 pacientes mantenían el consumo de más de una droga. Lo que se corresponde con la literatura revisada (53) con respecto a la efectividad de la monoterapia en el paciente operado por epilepsia intratable y la afirmación de que la terapia múltiple no es necesaria e incluso no parece modificar los resultados. Como podemos observar tres daños focales permanentes fueron provocados por la cirugía (11%), lo que se corresponde a lo reportado al respecto (52) que recoge de un 5 a un 15 por ciento de morbilidad quirúrgica. Los demás pacientes con daño permanente tenían el mismo al momento de la cirugía, no lográndose la recuperación posterior a la cirugía. El fallecimiento se debió a la recurrencia de un astrocitoma gemastocítico con excéresis parcial y radioterapia, demostrándose por histología cambios anaplásicos en el mismo 18 meses después de la primera cirugía. Las meningoencefalitis postquirúrgicas estuvieron en relación con el prolongado tiempo quirúrgico y la instrumentación que se necesitaba en los primeros casos para el uso del electrocorticógrafo. El hematoma subdural se produjo por la retracción sobre venas puentes y la sustancial diferencia de presión al producirse la excéresis y evacuación en este caso de un astrocitoma quístico. No tuvimos muertes a causa directa de la cirugía. Ni tampoco se encontró diferencia en los resultados con respecto a la mejoría de las crisis y el uso de la radioterapia, aunque en esto último se encuentran discrepancias en la literatura (54). CONCLUSIONES
RECOMENDACIONES Recordar que el paciente epiléptico con signos clínicos que sugieran focalización o ante cualquier paciente con intratabilidad de su epilepsia, debe ser sometido a estudios que descarten la presencia de una lesión intracraneal como etiología de su mal. Y si se determina esto por imagenología debe remitirse a un centro con experiencia para considerar a la cirugía como una alternativa de tratamiento. BIBLIOGRAFÍA (1) Porcell J. Tipos de cirugía de la epilepsia. Correo de Ciencias Neurológicas 1991; 1: 29-32. (2) Engel J. Update on surgical treatment of the epilepsies. Neurology 1993; 43: 1612-1617. (3) Adler J., Giuseppe E., Results of surgery for extratemporal partial epilepsy that began in childhood. Arch Neurology 1991; 48: 133-140. (4) Olivier A. Surgery of epilepsy, overall procedure. McGill University Montreal, Quebec, Canada, 1993. (5) Engel J. Surgery for epilepsy: a review. Acta Neurology Scand, 1986; 73: 551-560. (6) Elwes R. La option de surgery. Epilepsy today 1993; March. (7) MacKenzie A. R. Surgery for refractory epilepsy. Medical Journal of Australia 1990; 153: 69-73. (8) Pascual M. A. Prevalencia de la epilepsia. Un estudio de la población cubana. Centro Nacional de Información de Ciencias Médicas. Ciudad Habana. 1978: 9. (9) Holmes G. Surgical management of children with epilepsy. International Epilepsy News. 1995; 120: July. (10) Gumnit J. R. Surgical treatment of the epilepsies, edited by J. Engel Jr., 1987; 3: 71-79. (11) Holmes L. G. Surgical management of children with epilepsy. Neurology 1993; 43: (suppl. 5): 28-37. (12) Mossell K. Secundary epileptogenesis in man. Arch Neurology. 1985; 42: 318-335. (13) Lüders O, H. Awad Issam. Conceptual considerations. Epilepsy surgery, edited by Hans Lüders, Raven Press, Ltd., New York, 1991: Chapter 7: 51-62. (14) Spencer DD, Spencer SS, Matsson RH, Williamson PD. Intracerebral masses in patients with intractable partial epilepsy. Neurology 1984; 34: 732-736. (15) Goldring S, Rich K, Picker S. Experience with gliomas in patients presenting with a chronic seizure disorder. In: Little JR, ed. Clinical neurosurgery, vol. 33. Baltimore; Williams & Wilkins, 1986; 15-42. (16) Cascino G. D., Kelly P. J., Marsh W. R., Sharbroungh F. W. Sterotaxic resection of intra-axial cerebral lesions in partial epilepsy. Mayoclinic proc 1990; 65: 1053-1060. (17) Kelly PJ Volumetric streotactic surgical resection of intra-axial brain mass lesions: Mayoclinic proc 1988; 63:1186-1198. (18) Boon PA, Williamson PD, Fried Y, Spencer DD, Novelly RA, Spencer SS, Matson RH. Intracraneal, intraaxial, space-occupying lesions in patients with intractable partial Seizures; an anatomoclinical, neuropsychological and Surgical correlation. Epilepsia 1991; 32: 467-476. (19) Rasmussen TR. Surgical treatment of complex partia seizures, results, lessons, and problems. Epilepsia 1983; 24:65-76. (20) Awad IA, Rosenfeld J, Ahl J, et al. Intactable epilepsy and structural lesions of the brain: mapping, resection strategies, and seizure ouctome. Epilepsia 1991; 32:179-186. (21) Yeh H. Kashiwagi S., Tew J. M., Berger T. S. Surgical management of epilepsy associated with cerebral arteriovenous malformations J’Neurosurg 1990; 72:216-223. (22) Goldring S, Rich K, Picker S. Experience with gliomas in patients presenting with a chronic seizure disorder. In Little JR, ed. Clinical Neurosurgery, vol. 33. Baltimore; Williams & Wilkins, 1986; 15-42. (23) Sperling N. R., Cahan L. D., Brown J. W. Relef of seizures from a predominanthy posterior temporal tumor with anterior temporal lobectomy. Epilepsia 1989; 30: 559-563. (24) Fish D., Anderman F., Olivier A. Anterotemporal corticectomy in patients with complex partial seizures and small, relatively inaccessible posterotemporal or extratemporal structural lesions (abstract). Epilepsia 1989; 30-704. (25) Chayatté D., Fried Y. Angiograpically occult vascular malformation of brain. Contemp Neurosurgery 1990; 12(4): 1-5. (26) Dennis A. S. Tactical approaches to focal resections, in: Surgery for epilepsy. NIH Consensus Development Conference 1990; March: 19-21. (27) Venita Jay, M. D., Lawrence E.B, M. D., Hiroshi O. Pathology of temporal lobectomy for refractory seizures in children. J. Neurosurg 1993; 79: 53-61. (28) Mitchel S.B., Saadi Ghatan, B. S., Haglund M. D. Low-grade gliomas associated with intratacble epilepsy: seizure outcome utilizing electrocorticography during tumor resection. J. Neurosurg 1993; 79: 62-69. (29) Daumas-Duport C., Scheithauser B. W., Chodkiewiez J. D. Dysembryoplastic neuroepithelial tumor: a surgically curable tumor of young patients with intractable partial seizures. J. Neurosurg 1988; 23: 545-556. (30) Cahan D. L., Crandall H. P. Neurosurgical aspects of epilepsy in children and adolescents. Neurological surgery. Edited by J. Youmans, M.D., Saunders Company Philadelphia 1990; Chapter 165: 4271-4287. (31) Drake J., Hoffman J. H. Surgical management of children with temporal Lobe Epilepsy and mass lesions. J. Neurosurg 1987; 21: 792-797 (32) Engel J. Jr. Surgical treatment of epilepsies. Second Edition, edited by J. Engel; Jr. Raven Press; Ltd. New York 1993. Chapter 13: 95-102. (33) Rhoton A. Microsurgical Anatomy of the choroidal fissure. Surgical Neurology 1988; 30: 1. (34) Amiran K., Issam A. A., Lüders H. Extent of Resection in Temporal Lobectomy for Epilepsia. II. Memory Changes and Neurologic Complication. Epilepsia 1989; 30 (6):763-771. (35) Hirsch A., Engel J. Jr. Spencer SS. Surgical Treatment of the Epilepsia. Second Edition, Edited by J. Engel, Jr. Raven Press, Ltd, New York 1993. Chapter 42:440-459. (36) Girvin P. J. Complications of Epilepsy Surgery . Epilepsy Surgery, edited by Hans Lüders, Raven Press, Ltd., New York 1991. Chapter 73: 653-660. (37) Engel J. Jr. Surgical treatment of the Epilepsia. Second Edition, edited by Engel, Jr. Raven Press, Ltd, New York 1993. Chapter 43: 460-466. (38) Rasmussen T. Surgical treatment of patients with complex partial seizures. Advances in Neurology, Vol. 11. New York, Raven Press, 1975, pp 415-449. (39) Wiliamson D. P. Wieser H. G. Clinical Characteristics of partial Seizures. Surgical Treatment of the Epilepsies, edited by J. Engel. Raven Press. New York 1987:101-120. (40) Engel J. Jr. Surgical Treatment of the Epilepsia. Second Edition. Edited by Engel J. Jr. Raven Prez. New York 1993; Chapter: 5, 6, 7: 49-77. (41) Duncan S. J., Harvey J. S. Seizure characteristics, pathologicy and outcome after temporal lobectomy. Neurology 1987. March·7: 405-409. (42) David R. F., Shelagh J. S. Rasmussen T. Surgical treatment of children with medically intractable Frontal or Temporal Lobe Epilepsy : Results and Highlights of 40 Year’s Experience. Epilepsia 1993; 34: 244-247. (43) Christopher B. T. A., Phillip Anstow. Radiological Detection of Surgically treatable Pathology. Surgical treatment of the Epilepsies, edited by Engel J. Jr. Raven Press, New York 1987. Chapter 87: 213-257. (44) Dodrill B. C., Wilkus R. Ojemann A. G. Multidisciplinary prediction of Seizure Relief from Cortical Resection Surgery. Annals of Neurology 1986. July 20; 1: 2-12. (45) Fish D., Anderman F., Olivier A. Anterotemporal corticectomy in patients with complex partial seizures and small relatively inaccessible posterotemporal or Extratemporal structural lesions (Abstract). Epilepsia 1989; 30: 704. (46) Fiol M. E., Boening A. J. Effect of Isoflurane on Intraoperative Electrocorticogram. Epilepsia 1993; 34(5): 897-900. (47) Kirkpatrick J. P., Monanar M. Control of temporal lobe epilepsy following en bloc resection of low grade tumors. J. Neurosurg 1993; 78: 19-25. (48) Falconer M.A., Driver M.V., Serafetinides EA. Temporal lobe epilepsy due to distant lesions; two cases relived by operation. Brain 1962; 85: 521-534.
(49) Wyllie E., Lüders H, Morris H. H III, et al: Clinical outcome after complete or partial cortical resection for intractable epilepsy. Neurology 1987; 37: 1634-1641. (50) Bergers S. M., Ghatan S. Low-grade gliomas associated with intractable epilepsy: seizure outcome utilizing electrocorticography during tumor resection. J. Neurosurg 1993; 79: 02-69. (51) Boon P. A., Williamson P. D. Presurgical evaluation of patients with intratacble partial seizures, indications and evaluation techniques for resective Surgery. Clin Neurol. Neurosurg 1989; 91: 3-11. (52) Adler J., M.D., Giuseppe E. Results of Surgery for Extratemporal Partial Epilepsy that Began in childhood . Arch Neurology 1991; 48: 133-140. (53) Kyznieccky R., Zeava K. R. Antiepilectic Drog treatment After temporal Lobe Epilepsy Surgery. A Randomized Study Comparing Carbamazepine and Polytherapy. Epilepsia 1992; 33(5): 908-912. (54) Marino R. Neurosurgical aspects of epilepsy in adults. Neurological Surgery. Edited by J. Joumans, M.D. Saunders Company Philadelphia 1990; chapter 166: 4288-4299. ANEXOS PROGRAMA PARA EVALUACIÓN Y TRATAMIENTO QUIRÚRGICO DE LAS EPILEPSIAS REFRACTARIAS
I. REQUISITOS PARA ENTRAR AL PROGRAMA a. Valoración por un equipo de epileptólogos y neuropediatras de que el paciente no alcanza control de su epilepsia con el uso de las drogas anticonvulsivantes apropiadas a cada caso y determinación de niveles séricos adecuados de los medicamentos. Puede requerir hospitalización y ensayo de varias drogas alejado del medio familiar, con observación médica estrecha. Reafirma concepto de epilepsia refractaria. b. Evidencias clínicas y de otros tipos (electroencefalografía, imagenología, etc.) que permitan identificar un SÍNDROME EPILÉPTICOS REMEDIABLE QUIRÚRGICAMENTE, lo cual sería una indicación de remisión temprana al programa para cirugía de las epilepsias. Ejemplos: Epilepsia del lóbulo temporal mesial con crisis de origen focal. Epilepsia generalizada secundariamente con crisis específica de "drops attack" (ej: Sind. Lennox -Gastaut). Epilepsia secundaria a lesión hemisférica difusa sobre todo en edades pediátricas. Lesiones estructurales bien identificadas en la neocorteza. c. Valoración socioeconómica del paciente y su entorno familiar y laboral. CRITERIOS DE EXCLUSIÓN Enfermedad neurológica progresiva, alteración metabólica y degenerativa del S. N. C. Estado psicótico crónico. Contraindicación médica para cirugía. No cooperación del paciente o sus familiares. CI por debajo de 70-para resección de foco. CI por debajo de 50-para callosotomía. Debe valorarse casuísticamente. RESECCIÓN DE FOCO. Los exámenes preoperatorios buscan definir el lado y área cerebral responsables de la actividad epiléptica, así como zonas de déficit funcional focal. Resultan entonces dos grupos: Cirugía resectiva basada en estudios no invasivos o extracerebrales. Constituye la fase 1 de los estudios diagnósticos. Empleo de electrodos intracraneales (fase 2 del diagnóstico): cuando no se alcanzan los criterios en la fase I y se considera candidato a cirugía. Estereoencefalografía. Cuando se sospecha lesión epileptogénica en áreas temporomesial o lóbulo límbico. Las rejillas (grids) subdurales para estudio de la neocorteza temporal o extratemporal buscando delimitar la zona epiléptica y hacer un mapeo funcional. ESTUDIOS DIAGNÓSTICOS. FASE 1. ELECTROENCEFALOGRAFÍA Aspectos a evaluar en el E. E. G.: a) Focal. b) Focal con propagación trancallosa. c) Multifocal con propagación transcallosa. d) Actividad paroxística bilateral sincrónica. e) Paroxismos multifocales sin propagación. - Paciente hospitalizado. - Registro interictal. Determinar la actividad de base y alteraciones por paroxismos o de otro tipo. - Registro ictal. Recoge entre 3 y 10 episodios electroclínicos que se correspondan totalmente con la clínica del enfermo. - Se emplean electrodos de superficie y esfenoidales (cigomáticos en ausencia de estos). De gran utilidad la evaluación de 24 horas con video-E. E. G. - Utilización de análisis computarizado del E. E. G. con mapas de amplitud (BRAIN MAPPING). EXÁMENES DE DÉFICIT FUNCIONAL FOCAL. SPECT.-Interictal: buscando zona de baja perfusión focal. -Ictal: buscando una zona de hiperperfusión focal. EVALUACIÓN NEUROPSICOLÓGICA. Definir lateralidad del lenguaje y exámenes de memoria verbal por test no invasivos, buscando déficit focal o difuso de las funciones cognitivas, memoria, definir nivel funcionamiento para permitir comparaciones postoperatorias. Test de Wada (amobarbital intracarotídeo): valoración de lenguaje y memoria (dominancia estrictamente) E. E. G. COMPUTARIZADO. Determinar atenuación focal de los ritmos normales o de la actividad rápida (tipo ritmo beta) inducido por tiopental. DIAGNOSTICO DE LESIÓN ESTRUCTURAL POR IMAGEN : (sea ocupativa o atrófica) Tomografía Axial Computarizada. Resonancia Magnética Imagenológica. Con la conjunción de estos recursos puede decidirse la intervención. La confirmación del foco es siempre mayor mientras más diversos sean los medios diagnósticos que de forma congruente señalan igual localización. Ejemplo: Lobectomía temporal anterior: se identifica con registro por electrodo esfenoidal el lóbulo temporal donde se inician las electrodo esfenoidal el lóbulo temporal donde se inician las crisis, en SPECT aparecen zona de hipoperfusión interictal en la misma región y se confirma un déficit funcional focal con 2 exámenes más y/o se encuentra una lesión estructural en el lóbulo temporal donde comienzan las crisis. ESTUDIOS DIAGNÓSTICOS FASE 2. Cuando no puede determinarse de forma inequívoca y repetida la localización del foco. Consiste fundamentalmente en el uso de la estereoencefalografía o de rejillas subdurales. En el primer caso de 2 a 4 semanas y con los grids un período más corto. Siempre video E.E.G. Se buscaría además la presencia de información funcional suplementaria o al menos que no estuviera en contradicción con el foco determinado en esta fase.
USO DE LA ELECTROCORTICOGRAFÍA En los casos con evaluación de electrodos profundos previa, en que el área epileptogénica pudiera extenderse a región temporal posterior o en casos con foco localizado a regiones extratemporales para definir la extensión de la resección. RECORDAR: La cirugía del lóbulo temporal es la que más se beneficia y fundamentalmente la esclerosis mesial del temporal (70%-80% elimina crisis). La resección de foco extratemporal tiene mejores resultados cuando hay lesión estructural. Los pacientes con convulsiones secundarias a lesión estructural en la neocorteza, identificado por RMI o TAC pueden quedar libres de crisis después de resecciones muy limitadas o la excéresis de solo la lesión (lesionectomía). Epilepsia focal tiene fuerte relación (histórica) con entidades patalógicos tales como: - Pérdida neuronal (esclerosis mesial temporal) - Gliosis (post-trauma) - Displasia cortical - Anomalías corticales congénitas (heterotopia) - Malformaciones vasculares Cirugía desconectiva (callosotomía). Indicada cuando no se define un origen focal de las crisis, se sospecha con bastante fundamento propagación comisural y están presentes un tipo específico de crisis DROPS-ATTACKS. (70% mejoría y 30% no cambia) Hemisferectomía. Epilepsia intratable que se origina en un hemisferio, que tiene evidencias de disfunción difusa, hemiparesia contralateral con mano inútil y el OTRO HEMISFERIO ES NORMAL, como por ejemplo en la : - Hemimegaloencefalia - Infartos cerebrales - Sturge Weber - Lesiones post-traumáticas - Encefalitis Rasmussen - Encéfalo displasia
ARCHIVO DE IMÁGENES y E. E. G. SECUENCIA ELECTROENCEFALOGRÁFICA Preoperatorio Transoperatorio Transoperatorio Postoperatorio Pre-resección Post-resección
Fig Secuencia de la actividad eléctrica cerebral que muestra la efectividad del proceder realizado. (Lesionectomía total más Topectomía)
Preoperatorio Transoperatorio Transoperatorio Postoperatorio Pre-resección Post-resección
Otro ejemplo de las modificaciones de la actividad eléctrica cerebral. (Lesionectomía total más resección de foco a distancia)
PREOPERATORIO POSTOPERATORIO
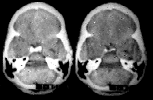
CASO.2 T.NEUROEPITELIAL DISEMBRIOPLASTICO 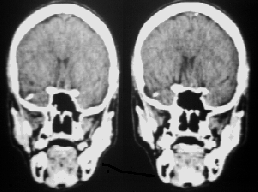
CASO.3 ANGIOMA CAVERNOSO |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Si desea contactar directamente a los autores , hágalo por email a: alonsof@infomed.sld.cu |