2.- SANGRE Y SUS COMPONENTES. HEMODERIVADOS.
La sangre ha sido transfundida con éxito durante unos 60 años. En este periodo de tiempo la práctica transfusional ha cambiado radicalmente debido a mejoras en los métodos de extracción y conservación de la sangre. Los objetivos principales de los procedimientos de extracción, preparación, conservación y transporte de la sangre y sus componentes son:
1. mantener la viabilidad y la función de los componentes más importantes.
2. evitar los cambios físicos perjudiciales para los componentes.
3. minimizar la proliferación bacteriana.
La solución anticoagulante-conservante evita la coagulación y proporciona los nutrientes adecuados para un metabolismo continuado de las células durante el almacenamiento. Durante el almacenamiento la integridad de las células sanguíneas depende de un delicado equilibrio bioquímico de muchos materiales, especialmente la glucosa, los iones hidrógeno (pH), y el trifosfato de adenosina (ATP). Este equilibrio se mantiene mejor en los hematies cuando se almacenan a una temperatura entre 1 y 6 ºC, en tanto que las plaquetas y leucocitos mantienen mejor su función almacenados a temperatura ambiente. Los factores de coagulación plasmáticos lábiles se mantienen mejor a una temperatura de -18 ºC o inferior. Además, la refrigeración o congelación minimizan la proliferación de bacterias que podrían haberse introducido en la unidad durante la venipuntura o procesamiento.
De la sangre total pueden separarse varios componentes en el mismo banco
de sangre. Los hematies y las plaquetas se aislan de la sangre total mediante
centrifugación suave, siendo posteriormente procesados para obtener
varios preparados distintos.
El plasma residual puede utilizarse directamente o bien ser fraccionado
nuevamente para obtener otros componentes.
Normalmente se obtienen más de 20 productos.
Entendemos por COMPONENTE SANGUINEO al producto separado de una unidad de sangre total, mientras que la denominación DERIVADO DEL PLASMA hace referencia a un producto separado de un gran volumen de mezclas de plasma mediante un proceso llamado FRACCIONAMIENTO. (TABLA I)
Unidad de sangre extraida con un anticoagulante y bolsa autorizados y no fraccionada.
Contenido: Una unidad de sangre total (ST) contiene 450 mL de sangre más aproximadamente 63 mL de solución anticoagulante-conservadora, con lo que su volumen final está en torno a los 500 mL.
La sangre total puede ser almacenada refrigerada entre 21 y 35 días dependiendo de la solución conservante anticoagulante-utilizada. Durante la conservación a 4 ºC las plaquetas y leucocitos dejan de ser funcionantes al cabo de pocas horas después de la extracción, y se produce una reducción gradual de la viabilidad de los hematies. Los hematies conservados durante 5 semanas en CPD-A presentan una recuperación media del 70%, la recuperación mínima aceptable. Los niveles de factores V y VIII también descienden. La tasa de Factor VIII experimenta una disminución del 50% a las 24 horas de la extracción y el factor V queda reducido al 50% a lo 10-14 días.
Por tanto la trasnfusión de sangre total supone el aporte de hematies y plasma deficitario en factores lábiles de la coagulación, no aportando tampoco plaquetas ni granulocitos.
Aunque es necesario disponer de un pequeño almacen de sangre total raras veces se utiliza. En realidad se considera un despilfarro emplear sangre total, pues ello impide la preparación de componentes específicos. Aunque su uso se considera ya como un vestigio del pasado, si se dispone de ella en el banco de sangre son muy pocas sus indicaciones, estando sólo reservada para:
1. Hemorragia aguda masiva (espontánea, traumática o quirúrgica) asociada a shock hipovolémico, el cual nunca se produce con pérdidas inferiores al 25% del volumen sanguíneo. La pérdida aguda de hasta el 10-15% del volumen sanguíneo (hasta 750 mL en un adulto de unos 70 Kg de peso) suele ser bien tolerada. Si las pérdidas superan el 20%, existe riesgo de shock hipovolémico y debe iniciarse la reposición de volumen. En las pérdidas superiores al 40% de la volemia debe recordarse que lo que determina la gravedad del cuadro clínico en la hemorragia aguda es la hipovolemia y no la deficiencia de hematies, de forma que si se mantiene un volumen sanguíneo normal, y por tanto la perfusión tisular, la tolerancia de la anemia grave es buena. Por ello, debe iniciarse de forma rápida el tratamiento con soluciones cristaloides y/o coloides. Cuando se haya completado el estudio pretransfusional del enfermo se perfundirán los hemocomponentes adecuados o si la pérdida de sangre supera el 80% del volumen sanguíneo, sangre total si se dispone de ella.
2. Exaguinotransfusiones: en este caso la sangre
total deberá no exceder de los 5 días.
2.2.- CONCENTRADOS DE HEMATIES:
Componente obtenido tras la extracción de aproximadamente 200 mL de plasma de una unidad de sangre total después por centrifugación. Son el componente sanguíneo más frecuentemente usado para incrementar la masa de células rojas.
Contiene los hematies correspondientes a una unidad de sangre total, más unos 100 mL de plasma residual.
Cuando la sangre se recoge en bolsa que contienen CPD-A, estos concentrados pueden conservarse durante 35 días a 4 ºC.(TABLA II)
Los concentrados de hematies están básicamente indicados en enfermos normovolémicos, con anemia crónica sintomética, refractaria al tratamiento etiológico, aunque su uso asociado a otros componentes celulares y plasma o sustitutos plasmáticos es hoy habitual en el tratamiento de la anemia aguda hemorrágica.
El objetivo del tratamiento transfusional en el enfermo con anemia refractaria de comienzo lento es mejorar la capacidad de transporte de oxígeno y evitar su sintomatología.
Debe transfundirse sólo al enfermo con síntomas estables, de severidad moderada, causados directamente por la anemia. es importante tener siempre en cuenta que la transfusión mejorará sólo transitoriamente la anemia, puesto que el trastorno subyacente persiste. No debe olvidarse que la vida media de una donación normal son aproximadamente 50 días, y que la transfusión se asocia además, a la supresión de la eritropoyesis residual de la médula ósea del enfermo, por lo que la hemoglobina volverá a niveles pretransfusionales en pocas semanas.
De un modo general puede establecerse que si la concentración de Hb es ³ 10 g/dL, la transfusión casi nunca está indicada. Si la Hb es de 5-8 g/dL, es fundamental el juicio clínico para tomar la decisión de transfundir o no. Si la Hb es inferior a 5 g/dL, la mayoría de enfermos requieren transfusión repetida.
En la anemia aguda hemorrágica hay que tener en cuenta que la sintomatología anémica dependerá tanto de la intensidad de la anemia como de la velocidad de instauración. Así, la transfusión de concentrados de hematies puede estar también indicada cuando la disminución en la cifrade Hb es superior a 2 gr/24 horas.
2.2.5.- Cantidad a transfundir:
El volumen a transfundir dependerá del volumen sanguíneo
del enfermo, de la
severidad de la anemia y del nivel de Hb que se desea conseguir. La
siguiente fórmula simplificada es útil para calcular el efecto
previsible sobre la concentración de Hb de la transfusión:
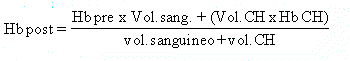
Como guía aproximada podemos estimar que, en un adulto de unos 60 Kg de peso, una unidad de 250 mL de CH aumentará la Hb en 1.2 g/dL y el hematocrito en 3 %.
- como expansor de volumen plasmático.
- como sustituto de terapeúticas específicas para anemia.
- para mejorar la cicatrización de heridas.
- para mejorar el tono vital del paciente.
- con Hb superior a 10 gr/dL.
Debido a su elevado valor hematocrito los CH son viscosos y por ello su velocidad de infusión es lenta. La velocidad puede incrementarse mediante la adición de suero salino para disminuir la viscosidad. Las soluciones que contienen calcio, como el ringer-lactato, no deben añadirse a ningún producto sanguíneo, ya que pueden inducir la coagulación. las soluciones de glucosa deben evitarse ya que forman grumos de hematies. EN GENERAL NO DEBEN AÑADIRSE A LOS PRODUCTOS SANGUINEOS OTRAS SUSTANCIAS QUE NO SEAN SUEROS SALINOS.
Los pacientes que experimentan fuertes y/o reiteradas reacciones no hemolíticas febriles a causa de las transfusiones suelen mejorar cuando se les transfunde hematies pobres en leucocitos.
La denominación "hematies pobres en leucocitos" se aplica a aquellos concentrados preparados según un método que reduce el contenido de leucocitos en el componente final a una cifra inferior a 5 x 108, reteniendo como mínimo el 80 % de los hematies originales. El nombre correcto para este componente es " hematies libres de leucocitos separados por (método utilizado)". Entre los métodos para eliminar leucocitos se encuentra la filtración, la centrifugación, y el lavado.
La mayoría de las reacciones provocadas por anticuerpos anti leucocitos dependen de la cifra de éstos, por lo tanto, en muchos casos una reducción del 50 % del número de leucocitos en una unidad de hematies evitará la reacción. No obstante en algunos pacientes la eliminación de más del 95 % de los leucocitos puede no anular la respuesta febril.
Componente obtenido a partir de una unidad de sangre total a la que se le ha retirado el plasma mediante lavados con solución isotónica.
El lavado de los hematies no es el método más eficaz para eliminar los leucocitos, aunque si se consigue eliminar el plasma. El proceso de lavado elimina la mayor parte de las proteinas plasmáticas y microagregados. Los pacientes IgA deficientes y con anticuerpos antiIgA pueden experimentar reacciones anafilácticas después de la tramsfusión de sangre o componentes sanguíneos que contenga IgA. La transfusión de hematies lavados reduce la incidencia de reacciones febriles, urticarias, y probablemente también reacciones anafilácticas. Lo ideal, sin embargo, en estos pacientes es utilizar sangre de donantes IgA deficientes.
- anemia con anticuerpos antileucocitarios
- anemia con anticuerpos antiproteinas plasmáticas
- prevención de isoinmunización HLA
- anemia hemolítica autoinmune
- hemoglobinuria paroxística nocturna
Los neocitos son hematies relativamente jóvenes, que se consideran especialmente aptos para realizar transfusiones a pacientes afectos de talasemia mayor y otras enfermedades que requieran transfusiones periódicas que pueden inducir el desarrollo de una hemocromatosis. En el proceso de envejecimiento los hematies depositan hierro en los depósitos tisulares a razón de 1,08 mg de hierro por mL de hematies. Los hematies transfundidos tienen en teoría un promedio de vida de 60 días, pero en la práctica sobreviven generalmente durante menos tiempo. El aislamiento y posterior transfusión de hematies con un promedio de vida de 30 días y unas probabilidaddes de supervivencia de 90 días, podría reducir a la mitad la frecuencia de las transfusiones periódicas que reciben un paciente y la cantidad de hierro depositado en los tejidos.
Hematies congelados preferentemente antes de los 7 días postextracción, utilizando crioprotector y conservados a temperatura inferior a - 80 ºC.
Los hematies pueden ser congelados utilizando técnicas especiales
de criopreservación.
Dichas técnicas permiten periodos de conservación de
hasta 10 años. Se trata de procedimientos caros; por tanto el uso
de hematies congelados se recomienda en circustancias especiales, entre
las cuales destacan:
- autotransfusión
- individuos pertenecientes a grupos sanguíneos raros
- individuos con anticuerpos múltiples
Durante los últimos años los hospitales han experimentado un significativo aumento en el uso de concentrados de plaquetas, especialmente debido al soporte de tratamientos oncológicos y al aumento que han experimentado los trasplantes de órganos.
Podemos disponer de 2 productos:
1. PLASMA RICO EN PLAQUETAS (poco usado): se obtiene después de una centrifugación suave de la sangre total.
2. CONCENTRADOS DE PLAQUETAS: un concentrado de plaquetas corresponde a las plaquetas obtenidas de una unidad de sangre total por doble centrifugación, o bien a partir de donantes por medio de procesos de aféresis (plaquetoféresis), procedimineto por el cual el donante sólo dona plaquetas.
Los concentrados de plaquetas contienen aproximadamente 6 x 109 plaquetas, lo que representa el 60-80 % de las contenidas en una unidad de sangre total, en un volumen reducido de plasma (50-70 mL).
Según la bolsa de plástico utilizada las plaquetas son viables durante 5 días o más si se mantienen a 22º C sometidas a una agitación horizontal constante.
El cálculo de la dosis de CP se debe realizar calculando 1 unidad de CP por cada 10 Kg de peso.
Cuando en un paciente se observa un bajo recuento de plaquetas, debe confirmarse que se trata de una trombocitopenia real y por tanto se debe excluir un recuento falseado o PSEUDOTROMBOCITOPENIAS presentes en el 1% de los pacientes, generalmente causadas por la presencia del anticoagulante o por una técnica deficiente. Se debe tener en cuenta también que el riesgo de hemorragia espontánea está principalmente determinado por el grado de trombocitopenia, pero que éste no es el único motivo hemorrágico (hay pacientes que alcanzan cifras de 5000/mL sin sangrado). Por todo ello no es posible definir con certeza la cifra de plaquetas a partir de la cual se requiere la administración profiláctica de CP.
1. Presencia de hemorragia en paciente trombocitopénico.
2. Trastornos cualitativos plaquetares con presencia o con datos sugestivos de hemorragia inminente de riesgo vital, o cuando estos pacientes vayan a someterse a cirugia.
3. En las trombocitopenias secundarias a quimioterapia es clásico el umbral de 20.000 plaquetas/mL como cifra por debajo de la cual se incrementa el riesgo hemorrágico y por tanto debe iniciarse la trasnfusión de CP. Sin embargo la política actual es más restrictiva y bascula entre 2 tendencias:
a. USO PROFILÁCTICO: Gmür et al. aconsejan mantener a los enfermos por encima de:
5.000/mL si no hay factores adicionales
10.000/mL si hay fiebre o manifestaciones hemorrágicas menores
20.000/mL si
existen lesiones anatómicas, otra coagulopatía o administración
simultánea de heparina.
b. TRANSFUSIÓN TERAPEÚTICA:
Patten et al. en Texas siguen un programa de transfusión sólo
terapeútica cuando aparecen hemorragias importantes y el enfermo
tiene una cifra de plaquetas inferior a 20.000/mL, sin observar incrementos
de la mortalidad.
4. En enfermos que van a ser sometidos a procesos invasivos: para realizarlas en condiciones de seguridad se pantea a menudo el problema del nivel mínimo aconsejable. En general se recomienda:
- una cifra plaquetaria mínima de 40-50.000/mL para acometer estos procedimientos, sobretodo cuando se trata de acceder a zonas no visualizables, inflamadas, muy vascularizadas o con presiones altas. Bishop et al aconseja llegar al acto operatorio con una cifra trombocitaria superior a 50.000(mL y en los 3 días siguientes mantener un recuento de plaquetas superior a 30 ó 40 x 109/mL
- por el contrario, cuando se trate de incidir en lugares de observación directa o con posibilidad de hemostasia mecánica el nivel de plaquetas puede ser algo menor.
Junto con el agua y los electrolitos, el plasma contiene proteinas (albúmina, globulinas y factores de la coagulación), siendo adecuado para la reposición de estos factores. La mayoría de los factores de la coagulación son estables a temperatura de refrigeración, excepto el VIII y, en menor grado, el V. Para mantener niveles adecuados de los factores V y VIII debe conservarse el plasma congelado. Generalmente el plasma se obtiene a partir de sangre total durante la preparación de otros componentes como CH y plaquetas.
2.8.1.- Plasma fresco congelado:
2.8.1.1.- Definición:
Se define como PFC el plasma separado de la sangre de un donante y congelado a una temperatura inferior a -18º C en las 8 horas siguientes a la extracción.
Si se almacena a -30º C (mejor que a -18º C) el PFC tiene un periodo de caducidad de 12 meses. Pasado este tiempo, el nivel de Factor VIII puede haber disminuido en algunas unidades de tal manera que el plasma ya no sea óptimo para el tratamiento de pacientes con esta deficiencia. Si el PFC no se utiliza en el plazo de un año, debe considerarse a partir de entonces y etiquetarse como PLASMA. El plasma con esta nueva denominación tiene 4 años más de vida útil si se conserva a -18º C o menos.
2.8.1.2.- Indicaciones:
La Conferencia Consenso sobre el Plasma ha delimitado claramente las indicaciones del PFC, clasificándolas en diversos grupos según la fortaleza de la indicación.
A. INDICACIONES EN LAS QUE SU USO ESTA ESTABLECIDO Y DEMOSTRADA SU EFICACIA: existen pocas situaciones clínicas en las que el PFC tiene utilidad terapeútica demostrada.
1. Púrpura trombótica trombocitopénica
2. Púrura fulminante del recien nacido, secundaria a deficit congénito de proteina C o proteina S, cuando no se disponga de concentrados específicos de dichos factores.
3. Exanguinotransfusión en neonatos, para reconstituir el concentrado de hematies cuando no se dispone de sangre total.
B. INDICACIONES EN LAS QUE SU USO ESTA CONDICIONADO A LA EXISTENCIA DE HEMORRAGIA GRAVE Y ALTERACIONES SIGNIFICATIVAS DE LAS PRUEBAS DE LA COAGULACION:
1. Pacientes que reciben una transfusión masiva (reposición de un volumen igual o superior a su volemia en menos de 24 horas)
2. Trasplante hepático.
3. Reposición de los factores de la coagulación en las deficiencias congénitas, cuando no existen concentrados específicos.
4. Situaciones clínicas con deficit de vitamina K que no permiten esperar la respuesta a la administración de vitamina K IV o no responden adecuadamente a ésta (malabsorción, enfermedad hemorrágica del RN,...)
5. Neutralización inmediata del efecto de los anticoagulantes orales.
6. Secundarias a tratamiento trombolítico, cuando el sangrado persista tras suspender la perfusión del fármaco trombolítico y después de administrar un inhibidor específico de la fibrinolisis.
7. CID aguda, una vez instaurado el tratamiento adecuado.
8. Cirugia cardíaca con circulación extracorpórea siempre que se hayan descartado otor motivos de hemorragia (trombocitopenia...)
9. Insuficiencia hepatocelular grave y hemorragia microvascular difusa o hemorragia localizada con riesgo vital.
10. Reposición de factores plasmáticos de la coagulación depleccionados durante el recambio plasmático, cuando se haya utilizado la albúmina como solución de recambio.
C. INDICACIONES EN LAS QUE SU USO ESTA CONDICIONADO A OTROS FACTORES:
en ausencia de clínica hemorrágica será suficiente
la alteración de las pruebas de la coagulación para indicar
la administración de
PFC en:
1. pacientes con deficits congénitos de la coagulación, cuando no existan concentrados de factores específicos, ante la eventualidad de ua actuació agresiva (cirugía, extracciones dentarias, biopsias...)
2. En pacientes sometidos a anticoagulación oral que precisen cirugía inminente.
D. SITUACIONES EN LAS QUE EXISTE CONTROVERSIA SOBRE SU EFECTIVIDAD:
1. Preveción de la hemorragia microvascular difusa en enfermos que tras haber sido transfundidos masivamente tengan alteraciones significativas de las pruebas de la coagulación, aunque no presente manifestaciones hemorrágicas.
2. Como profilaxis de la hemorragia en pacientes con hepatopatías y trastornos importantantes de la coagulación, que deben ser sometidos a una intervención quirúrgica o proceso invasivo.
3. En los pacientes críticos por quemaduras, en la fase de reanimación no puede recomendarse su utilización sistemática.
E. SITUACIONES EN LAS QUE SU USO NO ESTA INDICADO:
1. todas aquellas que puedan resolverse con terapias alternativas o coadyuvantes.
2. en la reposición de la volemia.
3. Prevención de hemorragia intraventricular del RN prematuro.
4. Como parte integrante de esquemas de reposión predeterminados.
5. Como aporte de Inmunoglobulinas.
6. Uso profiláctico en pacientes diagnosticados de hepatopatía crónica con alteraciones de las pruebas de la coagulación, que van a ser sometidos a procesos invasivos menores.
7. Pacientes con hepatopatía crónica e insuficiencia hepatocelular avanzada e fase terminal.
8. El PFC no debe utilizarse como aporte:
- nutricional o para al corrección de la hipoproteinemia
- alimentación parenteral
- de factores de la coagulación en el recambio plasmático (exceptuando los puntos A1 y B10).
9. Correción del efecto anticoagulante de la heparina
10. Reposición de volumen en las sangrías de RN con policitemias
11. Ajuste del hematocrito de los concentrados de hematies que van a ser transfundidos a los RN.
2.8.1.3.- Efectos adversos y riesgos:
- transmisión de agentes infecciosos, fundamentalmente VHC, VHB, VIH, y otros virus a pesar de las medidad de detección previas a la transfusión.
- hemolisis por incompatibilidad ABO
- sobrecarga de volemia
- Reacciones alérgicas, urticariformes y anafilácticas.
- Toxicidad por el citrato (hipocalcemia grave)
- edema pulmonar no cardiogénico.
- aloinmunización eritrocitaria.
Es la parte insoluble en frio del plasma que resulta de la descongelación entre 1 y 6º C del PFC.
Contiene un 50% del Factor VIII, un 20-40% del fibrinógeno y un 30% del factor XIII que estaban presente originalmente en el PFC.
Contiene tanto factor VIII:C como Factor de Von Willebrand. Los standars establecen que al menos el 75% de las bolsas de crioprecipitado deben contener un mínimo de 80 UI de factor VIII. Cada unidad contiene una cantidad variable de fibrinógeno, normalmente 100-350 mg.
Congelado a -40º C tiene una duración de 1 año, pero una vez descongelado debe usarse antes de las 4 horas.
Su efecto es restaurar el Factor VIII y/o el fibrinógeno (factor
I), siendo por tanto sus principales indicaciones la Enfermedad de Von
Willebran y la hipofibrinogenemia. Aunque en estas enfermedades puede utilizarse
el PFC como tratamiento de reposición temporal, es más apropiado
el crioprecipitado debido a su menor volumen (25-30 mL).
También pueden ser usados en la hemofilia A (déficit
congénito factor VIII) y en el deficit congénito de fator
XIII aunque en estas entidades son más eficaces los concentrados
de factores específicos.
La dosis a administrar dependerá del volumen sanguíneo del receptor y de su situación clínica. De forma orientativa puede indicarse 1 bolsa de crioprecipitado por cada 6-7 Kg de peso.
2.10.- CONCENTRADOS DE FACTORES PLASMATICOS DE LA COAGULACION.
Actualmente es posible obtener concentrados de la mayoría de los factores plasmáticos de la coagulación a partir del PFC, aunque cada vez son más los productos de origen genéticos. Estos últimos parecen conseguir igual actividad biológica y efectividad terapeútica junto a un menor riesgo de transminsión de enfermedades infecciosas (VIH, VHB,...), sin embargo su costo es extremadamente alto y por ello no son todavía claras sus indicaciones. Paralelamente los concentrados obtenidos a partir del PFC son sometidos a distintos procesos de inactivación viral (pasteurización, solvente-detergente, calor seco,...) que los hacen igualmente seguros.
Los concentrados más utilizados son:
2.10.1.- Concentrados de factor VIII:
* Preparados de origen plasmático de pureza intermedia (< 10 UI/mg de proteina): Kryobulin TIM 3, Hemate-P.
Aunque su uso es clínicamente aceptable, la mayor alteración inmunológica que producen hacen aconsejable su sustitución por otros tipos de preparados.
* Preparados de origen plasmático de alta pureza (<10 UI/mg de proteina): Beriate-P, Fanhdi, Hemofil M, Monoclate-P.
De elección en el tratamiento de la hemofilia A, si bien en los hemofílicos VIH negativos la tendencia actual es la administración de preparados recombinantes.
* Preparados recombinantes: Bioclate, Helixate, Kogenate, Recombinate.
* Preparados de Factor VIII porcino: Hyate C.
La administración de FVIII a los pacientes hemofílicos puede seguirse de la aparición de anticuerpos contra el FVIII humano, de tal forma que posteriores administraciones resultan ineficaces en la prevención y tratamiento de procesos hemorrágicos. En estos casos una posibilidad es la administración de FVIII porcino, ya que los inhibidores del FVIII tienen algún grado de especificidad de especie.
El tratamiento se debe iniciar con una dosis de 50-100 UI/Kg, con dosis subsecuentes dependiendo de la respuesta.
2.10.2.- Concentrados de factor VIII y factor Von Willebrand:
* Producto: Haemate P
* Contenido: 1.000 UI de FVIII 2.200 UI de FvW
* Indicaciones: aunque puede ser utilizado en la hemofilia A su principal indicación es la enfermedad de von Willebrand, a dosis de 20-40 UI FVIII/Kg cada 12 horas.
2.10.3.- Concentrados de factor IX:
Pueden usarse preparados plasmáticos que junto al FIX contienen otros factores del complejo protrombínico (FII, FVII, FX), o concentrados de FIX de alta pureza obtenidos por procedimientos cromatográficos.
El uso de estos preparados en pacientes portadores de Hemofilia B se ha asociado a la aparición de fenómenos trombóticos, a menudo fatales. Se ha recomendado, por ello, la administración de 5-10 UI de Heparina por ml de concentrado, previamente al uso de estos preparados, sobre todo es casos de terapia sustitutiva por cirugía ortopédica, o bien la utilización conjunta de concentrados de antitrombina III. sim embargo estas medidas no han eliminado completamente las complicaciones trombóticas.
Tanto los CCP como los de FIX ejercen un efecto hemostático satisfactorio, si bien estos últimos tienen menor capacidad de generar un estado trombofílico. Aunque la posible aparición de trombosis relacionada con la administración de de CCP no es una complicación frecuente que contraindique éstos de manera general, se recomienda el uso de Concentrados de FIX en las siguientes situaciones:
- necesisdad de mantener niveles elevados de FIX
- en sujetos hemofílicos sometidos a cirugía de riesgo o con hepatopatías crónicas o bien con antecedentes de enfermedad tromboembólica.
- en situaciones que generan un estado de hipercoagulabilidad (diabetes, procesos séticos, ...) y en el Recien Nacido prematuro.
- Hemofílcos B sometidos a tratamiento
erradicador de un inhibidos por inmunotolerancia.
2.10.4.- Concentrados del complejo protrombínico activado (CCPA):
Durante las dos últimas décadas los CCPA han sido el sostén principal del tratamiento de episodios hemorrágicos en hemofílicos con inhibidores de los factores VIII o IX. Su mecanismo de acción se basa en la llamada "actividad Bypass del inhibidor", es decir, la coagulación se induce en el punto en el que el FVIII no es necesario (el factor VIIa contenido en el preparado activaría al FX sin requerir al FVIII).
Dosis:
+ Hemorragia leve: 50-100 UI/Kg en una sola dosis.
+ Hemorragia severa-mediana: 100 UI/Kg/6 horas (2 dosis), continuar con 50 UI/Kg/12 horas valorando la respuesta a las 24 horas.
+ Hemorragia muy grave: 100-200 UI/Kg cada 6-8 horas.
