|
|
Capítulo 9.1. Lesiones por Radiaciones ionizantes
4. EFECTOS
DE LA RADIACION:
|
|
4.1. CLASIFICACION:
Los efectos de la radiación pueden ser agudos, que aparecen corto
tiempo después de la exposición a la radiación, o
crónicos, que aparecen a menudo muchos años despues de recibir
la exposición. Tambien pueden clasificarse en somáticos,
genéticos, si afectan a las células germinales y dan lugar
a efectos en la descendencia de los individuos irradiados, o teratogénicos,
si afectan al feto durante la gestación.
|
|
De un modo general, pueden dividirse en efectos estocásticos,
que ocurren al azar, por lo que no tienen umbral y su efecto puede aparecer
independientemente de la dosis recibida. Al estar basados en probabilidades,
la posibilidad de aparición del efecto aumenta con el incrementode
las dosis. Un ejemplo es la mayor incidencia de cáncer. Los efectos
no estocásticos estan directamente relacionados con la cantidad
de la radiación recibida, con lo que el efecto es más severo
cuanto mayor sea la dosis, por ejemplo, las quemaduras. Típicamente
tienen una dosis umbral, por debajo de la cual, se estima que el efecto
nocivo no aparece. |
|
4.2. DOSIS
RECIBIDAS Y DOSIS LIMITE:
El intervalo de tiempo que transcurre entre la exposición, y
la aparición del efecto de la radiación se denomina periodo
de latencia. La dosis umbral, para cada determinado efecto biológico,
es la dosis mínima de radiación que produce el efecto. La
dosis máxima permisible es la máxima dosis que, en el estado
actual de nuestros conocimientos, no se espera que cause ninguna lesión
apreciable en la persona irradiada en ningún momento de su existencia.
Los límites suelen expresarse como dosis máxima permitida
anual, son revisados cada cierto tiempo, y son diferentes cuando se considera
una exposición total de todo el cuerpo del individuo, o cuando se
considera la exposición localizada de una zona, y también
para las personas en riesgo de exposición laboral, o para el público
en general. Como ejemplo, damos en la
Tabla II algunas
de las dosis límite de la Legislación Española1:para
trabajadores profesionalmente expuestos, referidos a cualquier periodo
de doce meses consecutivos:
|
|
En la misma Legislación, se define como trabajadores profesionalmente
expuestos a aquellas personas que, por las circunstancias en que se desarrolla
su trabajo, son susceptibles de recibir dosis superiores a un décimo
de cualquiera de los límites anuales de dosis. Por ley, todos ellos
deben utilizar obligatoriamente un dosímetro que debe ser enviado
cada mes para su lectura al CentroNacional
de Dosimetría, ubicado en Valencia. El Centro devuelve el dosímetro,
junto con una lectura de la dosis recibida en el mes anterior. Toda dosis
mayor de 4 mSv recibida en un mes, cuando se refiere a exposición
total del organismo, o de 40 mSv si se refiere a dosis superficial en manos
o piel, supone un aviso de que, de repetirse en los meses sucesivos, podría
eventualmente superarse la dosis total anual máxima permitida. |
|
Estas dosis pueden ser revisadas, pues en 1995, la International Commission
of Radiation Protection (ICRP) recomendaba disminuir los estándares
previos, sobre todo, porque la extrapolación de los efectos de dosis
elevadas, a las dosis bajas puede no ser adecuada 2 |
|
Muchos de los datos acerca de las dosis de radiación permitidas
han sido extraídos de fuentes norteamericanas, australianas o del
Reino Unido, a partir de los datos recogidos en las distintos accidentes
radiactivos, de los datos de las bombas atómicas de Hiroshima y
Nagasaki, y de algunos datos experimentales. La mayoría de la información
es perfectamente extrapolable al público español De
hecho, los límites de la tabla antes expuesta coinciden exactamente
con los de la legislación USA. Para los menores, y los fetos, las
dosis máximas son de 5 mSv/año y su equivalente, respectivamente. |
|
4.3. LA
RADIACION COMO FACTOR DE RIESGO:
Por término medio, una persona recibe aproximadamente 360 mrem
cada año, la mayor parte de ella, a partir de fuentes naturales
de radiación. Según datos de 1992, la dosis media recibida
por los trabajadores de una Central de Energía Nuclear en USA era
de 300 mrem, además de la irradiación basal, que se denomina
radiación de fondo, aquella que cualquier habitante recibe por término
medio, aún sin estar expuesto a ninguna fuente de radiación.
|
|
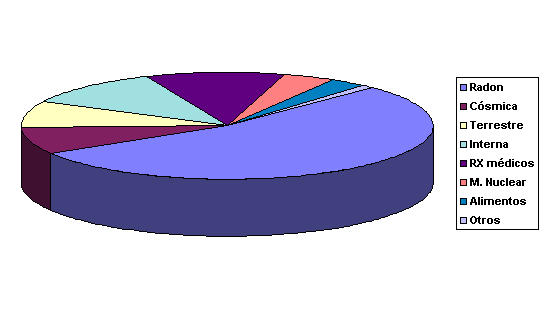
La Tabla
III muestra las dosis de radiación de fondo que recibe un ciudadano
medio de USA, según las distintas fuentes generales de exposición: |
|
En la siguiente tabla (Tabla
IV) se pormenorizan algunas de las dosis recibidas de fuentes concretas |
|
Es poco probable que un ciudadano normal pueda recibir dosis de más
de 5 rem por año, por lo que las estimaciones del riesgo de la radiación
suelen basarse más en los aumentos de la frecuencia de las neoplasias
que en las muertes debidas directamente a la radiación. No obstante,
excepcionalmente, y como consecuencia de accidentes en que está
implicado material radiactivo, o a causa de controles defectuosos de los
instrumentos que son empleados en el diagnóstico médico por
imagen, o en terapéutica con radiaciones para el tratamiento de
neoplasias, algunos sujetos pueden recibir dosis mucho más elevadas.
Más allá de los 100 rem, comienzan a desarrollarse los distintos
aspectos de la enfermedad por radiación.
|
|
Las dosis de algunos exámenes médicos se muestran en
la Tabla V. Las dosis
de Rayos X proceden de evaluaciones realizadas en 1908-1985, y con los
tubos actuales, pueden ser algo menores. |
|
Dado que el organismo humano está compuesto de substancias químicas
que tomamos de nuestro entorno, que algunas fracciones de estas substancias
químicas están formadas por isótopos radiactivos,
y que el organismo no dispone, que sepamos, de ninguna capacidad de seleccionar
isótopos del mismo elemento, no es nada extraño que en nuestro
organismo existan substancias radiactivas, algunas de ellas con vida media
extraordinariamente larga. Según el International Committee for
Radiation Protection (ICRP), las concentraciones de algunos elementos radiactivos
en un ser humano de 70 K de peso, serían (TablaVI): |
|
Algunas áreas del planeta tienen, en virtud de elevadas concentraciones
de minerales radiactivos acumuladas en su suelo, un nivel basal de radiación
que excede en mucho a la radiación media de las tablas anteriores.
En la mayor parte de los casos, se debe a la monazita, un mineral altamente
insoluble que suele ir unido a la ilmenita, que da a las arenas de algunas
playas su característico color negro. La monazita es relativamente
rica en derivados de la serie del 232Th, aunque también
de la serie del 226Ra. En algunas playas brasileñas,
la radiación es de hasta 5 mrad/h (50mGy/h),
casi 400 veces la radiación de fondo antes descrita. El empleo de
esta arena para asfaltar las calles hace que algunas de ellas tengan una
radiación 10 veces mayor que la radiación de fondo normal.
En el sudoeste de la India, existen depósitos de monazita todavía
más abundantes que los de Brasil. Los habitantes de la zona reciben
de promedio 500-600 mrad/año (5-6 mGy)/año. En estas zonas
se ha detectado una frecuencia elevada de aberraciones cromosómicas,
similares a las de los trabajadores de áreas radiactivas o en los
expuestos a niveles elevados de radiación, aunque la frecuencia
de estas aberraciones es más alta que la predicha para las dosis
recibidas, lo que puede significar que la asunción de que los efectos,
dentro de esos límites, es lineal con la dosis, puede no ser totalmente
cierta. |
|
Si se toman en cuenta las evaluaciones de los comités científicos
designados al efecto, cuyos trabajos se iniciaron en los años cincuenta,
poco después del dramático final de la Segunda Guerra Mundial,
los riesgos de la radiación son escasos para el ciudadano medio.
El más reciente de estos comités, el Biological Effects of
Ionizing Radiation Committee Five (BEIR V) publicó sus conclusiones
en 1990, y, a diferencia del anterior (BEIR IV), que había enfocado
su atención en los peligros de los agentes emisores de radiación
alfa en el interior del organismo, fundamentalmente en los riesgos del
radón, concentró su atención precisamente en la exposición
continua a radiaciones externas. |
|
La estimación de los riesgos procedentes de la radiación
externa ha tropezado con abundantes dificultades, ya que la mayoría
de los casos conocidos de irradiación del organismo entero en humanos,
lo han sido en dosis cercanas a las recibidas a partir de la radiación
de fondo. Los datos fundamentales siguen siendo los extraídos a
partir de los supervivientes de las bombas atómicas de Hiroshima
y Nagasaki, que recibieron dosis bastante elevadas, por extrapolación.
Dado que la radiación no es la única causa de aparición
de neoplasias, es preciso tomar en cuenta en cada población estudiada
este mismo riesgo para el grupo étnico, la frecuencia habitual de
cánceres, la frecuencia de hábitos tabáquicos o de
otro tipo que pudieran influir en la tasa de neoplasias, etc. Según
el BEIR V, el riesgo de muerte por cancer es de 0.08% por rem para las
dosis recibidas de forma rápida, y hasta 2-4 veces menor (0.04-0.02%)
por rem si las dosis se reciben durante un periodo prolongado. Dado que
esta es una estimación global, sin distinción de sexo, grupos
de edad, ni de formas concretas de neoplasias, hay un elevado nivel de
incertidumbre asociado con estas cifras. |
|
Por ello, se ha intentado, en base a datos actuariales, comparar los
riesgos de la radiación con otros riesgos comunes. Así, si
se estima que en USA, la frecuencia de fallecimientos por cancer es aproximadamente
del 20%, y como aproximación conservadora se estima que para dosis
bajas de radiación, el riesgo tiene una relación lineal con
la dosis, la exposición de una población de 1000 personas,
con los riesgos antes reseñados, a una radiación de 1 rem,
significaría la aparición de ocho fallecimientos adicionales,
es decir, fallecerían 2008 en lugar de 2000. La cifra sería
inferior si la misma dosis hubiera sido recibida durante un periodo prolongado.
Se ha traducido este riesgo a descenso en la expectativa de vida, midiendo
los días perdidos de una población debido a un fallecimiento
por diversas causas, dividido entre la totalidad de la población,
como una forma de considerar el riesgo relativo (Tabla
VII): |
|
Y en cuanto a los riesgos puramente laborales (TablaVIII)
3: |
|
Otra manera de expresar el problema es considerar la equivalencia del
riesgo relativo de la posibilidad de 1 en un millón de morir de
actividades comunes en nuestra sociedad (Tabla
IX): |
|
Basándose en la información de que se produce una muerte
por cada 7.3 millones de cigarrillos consumidos, o lo que es lo mismo,1.37
* 10-7 fallecimientos por cigarrillo, 5.6* 10-8muertes
por milla conducida, y 4% canceres fatales por Sv (100 rem) por exposición
a bajas dosis, algunos exámenes médicos habituales tendrían
un riesgo similar a (TablaX)
4: |
|
4.4. MECANISMO
DE LOS DAÑOS POR RADIACION:
La radiación causa ionizaciones en las moléculas que componen
las células, al separar electrones de los átomos de aquellas.
Los iones formados pueden reaccionar con otras estructuras químicas
cercanas de la célula, ocasionando daños. A bajas dosis,
como las que se reciben diariamente procedentes de la radiación
de fondo ambiental, las células reparan el daño con bastante
rapidez. A dosis muy elevadas, las células pueden ser incapaces
de reparar los desperfectos, y pueden sufrir daños permanentes,
o aún la muerte. Aún así, muchas células pueden
morir sin que el organismo en sí sufra graves consecuencias, ya
que pueden ser reemplazadas. Si las células que sufren cambios permanentes
logran dividirse, pueden dar lugar a células hijas anormales. En
el peor de los casos, si estas células no son eliminadas por los
mecanismos de reconocimiento de proteínas extrañas, pueden
dar lugar a un cáncer. A dosis más elevadas, las células
deterioradas no pueden ser reemplazadas a velocidad suficiente como para
que los tejidos y órganos ejerzan su función de forma adecuada,
apareciendo los distintos grados de la enfermedad por radiación
que describiremos más adelante. Esta tiene un amplio espectro de
manifestaciones, en dependencia fundamentalmente de las dosis de radiación
recibidas, aunque también del estado previo del individuo, y de
los cuidados que pueda este recibir.
|
|
4.4.1. Radicales libres:
La enfermedad por radiación es pues una enfermedad producida
por radicales libres 5,6,7,8,9,10,11,12,13al
igual que el síndrome de isquemia-reperfusión, que algunas
intoxicaciones, y otros muchos cuadros patológicos. La mayor parte
de los iones formados por el efecto de la radiación, lo son a partirde
moléculas de agua, pues no en vano el agua es la molécula
más abundante del organismo. Un radical libre es cualquier átomo
o molécula capaz de existencia independiente, que posee en su capa
electrónica externa un electrón no pareado. En virtud de
ello, se trata de substancias con una gran capacidad para reaccionar con
las moléculas cercanas, a las que pueden causar cambios químicos
y estructurales que lleguen a traducirse en la pérdida de su función.
Aunque no son ni mucho menos los únicos, los radicales libres más
abundantes en la naturaleza son los radicales libres de oxígeno,
pues en gran parte se producen en el curso de la respiración celular
normal 14, 15,ademásde
en muchos procesos patológicos, fundamentalmente en algunas intoxicaciones
-paraquat, diquat 16,17,18,paracetamol
19-,
bajo la acción de algunas substancias químicas empleadas
como antineoplásicos-las antraciclinas
20,21-,en
la isquemia, y posterior reperfusión de los órganos22,23,24,
en los leucocitos polimorfonucleares que han sido activados por substancias
extrañas al organismo 25,26,27y,
por supuesto, bajo la acción de la radiación 28.
|
|
Cuando la molécula de oxígeno adquiere un electrón,
aparece un radical llamado superóxido, representado por O 2.-.
Es probablemente el más abundante de los radicales libres de oxígeno,
aunque no el más reactivo. No obstante, de forma espontanea, con
el concurso de algunos metales de transición como el cobre o el
hierro, o por intermedio de enzimas específicas, como las superoxidodismutasas,
puede transformarse, por adquisición de un nuevo electrón,
y de dos protones, en peróxido de hidrógeno, o agua oxigenada,
que, aunque es capaz de intervenir en casi todas las reacciones radicalares,
no es técnicamente un radical libre, pues no tiene electrones desapareados.
El radical hidroxilo es el resultado de la adquisición, por parte
de la molécula del oxígeno, de tres electrones, con rotura
molecular y adición de un protón. El radical libre hidroxilo
es una de las substancias químicas más reactivas. En virtud
precisamente de esa reactividad, el radical hidroxilo, representado por
HO. es la más nociva de las formas radicalares del oxígeno.
El radical hidroxilo es el responsable de la mayor parte del daño
ocasionado al DNA celular y a las membranas causado inicialmente por las
radiaciones ionizantes. |
|
Las reacciones del HO. pueden ser de tres tipos: abstracción
de H, adición, y transferencia electrónica. En cuanto a esta
última, siguiendo un principio clásico de la química
de los radicales libres, la reacción de un radical libre con una
especie química no radicalar produce un radical libre diferente,
que puede ser más o menos activo que el radical libre original. |
|
El ejemplo más típico de la reacción de abstracción
de hidrógeno es la reacción del radical hidroxilo con los
ácidos grasos de las membranas celulares, para producir, tras
algunas transformaciones complejas de las moléculas del ácido
graso, una reacción en cadena, denominada lipoperoxidación,
en la que se van produciendo cada vez más radicales libres, y que
si no es detenida por los agentes antioxidantes de la propia membrana o
por agentes externos, puede llegar a producir lesiones de la membrana,
además de productos de degradación, como el hidroxinonenal
o el malondialdehido que de por sí tienen propiedades cancerígenas. |
|
Cuando la producción del radical hidroxilo se da cerca de una
cadena de DNA, el radical puede reaccionar con la desoxiribosa, transformándola
en una gran cantidad de diferentes productos, algunos de los cuales han
revelado propiedades mutágenas en algunas bacterias. Además,
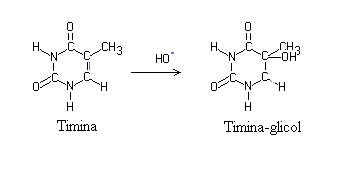
puede actuar directamente sobre las bases púricas y pirimidínicas,
en general por adición, por ejemplo, en el doble enlace de la timina,
para convertirla en timina-glicol, al que confiere el caracter de radical
libre. Este puede reaccionar posteriormente con el oxígeno, para
formar peroxitimina, francamente reactiva, que puede unirse a moléculas
adyacentes, modificando la estructura de la cadena de DNA |
|
Algunos de los productos del ataque oxidativo del radical hidroxilono
sufren
transformación ulterior, y son excretados en la orina, donde
pueden cuantificarse. Por ejemplo, se calcula que la timinaglicol, y la
timidinaglicol - timinaglicol que todavía tiene unida la desoxiribosa
-y el 5-hidroximetiluracilo son excretados en cantidad aproximada de 100nmol
(10-9 mol) cada uno, cada día, en un ser humano normal.
Si todas estas moléculas procedieran del resultado de la reparación
de cadenas de DNA (alguna cantidad es producida por las bacterias intestinales,
y otra proviene de la presente en los alimentos), corresponderían
a una media de 1000 bases de DNA dañadas en cada una de las células
que componen el organismo. Dado que estos son solamente algunos de los
productos de degradación del ataque radicalar al DNA, los daños
que precisan ser reparados diariamente pueden ser mucho más numerosos.
|
|
4.4.2. Apoptosis:
Otro mecanismo por el que la radiación puede ocasionar daño
tisular es la inducción de apoptosis. Este mecanismo no excluye
al anterior, y hay evidencias de que puede ser desencadenado por la formación
previa de radicales libres que lesionen el material genético 29.
El término apoptosis (del griego apo, aparte, y ptosis,caído
-como cae la lluvia) fué acuñado en 1972 por Kerr
y cols. 30
para designar un tipo de muerte celular que difiere de la necrosis, tanto
bioquímica como morfológicamente. Otros autores ya habían
descrito aspectos morfológicos y funcionales con anterioridad, destacando
la importancia que podría tener para los fenómenos de crecimiento,
senescencia y proliferación celular normal o tumoral. Algunos autores
lo han denominado también "muerte celular programada" 31,32.La
apoptosis parece ser un fenómeno necesario en la embriogénesis,
en la involución de los tejidos endocrinos una vez desaparece el
estímulo secretor, en la eliminación de células ectópicas,
y en general, en el mantenimiento de la composición celular de cualquiera
de los sistemas orgánicos en que las células proliferan durante
toda la vida del individuo.
|
|
Al contrario de la muerte por necrosis, en que las membranas celulares
se rompen y el contenido celular se esparce por los alrededores, atrayendo
a las células inflamatorias destinadas a fagocitar los fragmentos,
en la apoptosis, la membrana también es afectada, perdiendo su flexibilidad
y apareciendo en ella a modo de bullas o burbujas. El núcleo muestra
una condensación progresiva de la cromatina y en los análisis,
una fragmentación de las cadenas de ADN. La célula parece
hundirse sobre sí misma, probablemente por destrucción de
la estructura del citoesqueleto. El núcleo se vuelve picnótico.
Finalmente la célula se fragmenta, conservando siempre una membrana
y formando los denominados cuerpos apoptópicos, que son finalmente
fagocitados, no solo por los macrófagos y neutrófilos, como
en el caso de la necrosis, sino sobre todo, por las células adyacentes
del mismo tipo que la que ha sufrido la apoptosis, en un a modo de "canibalismo",
por lo que los cambios inflamatorios son prácticamente nulos. |
|
Ya TROWELL en 1952 observó picnosis nuclear a dosis tan bajas
como de 0.5 Gy 33,
con una relación dosis-respuesta que era linear hasta los 8 Gy,
lo que ha sido confirmado por otros autores en linfocitos, en la médula
ósea, en las células de las criptas de la mucosa intestinal,
en el cerebelo,etc. Algunas células son más resistentes que
otras a la aparición de apoptosis tras la irradiación. Incluso
algunos tumores radioresistentes no muestran apoptosis o esta aparece solo
tras un considerable retraso después de la irradiación. La
sensibilidad a la apoptosis viene también determinada por la madurez
de la célula y por su estado funcional. |
|
El proceso de la apoptosis dista mucho de estar totalmente aclarado,
y todavía menos los motivos que la ponen en marcha. En muchas células,
la radiación daña directamente el ADN al comunicar directamente
su energía a la cadena de ácido nucléico, o por la
producción previa de radicales libres, según describimos
anteriormente, y ello es el mecanismo inicial que desencadena la apoptosis.
La presencia de radicales libres daña las membranas celulares y
activa entre otras a la fosfolipasa C-g 34que,
mediante la movilización de Ca++ de los depósitos
intracelulares, y también permitiendo la entrada de este desde el
exterior de la célula, activa una endonucleasa de ADN dependiente
de Ca++ y Mg++ , y sensible al Zn++, que
rompe el ADN en fragmentos de aproximadamente 180 pares de bases. La actividad
de la endonucleasa aumenta hasta siete veces a las tres horas de la irradiación,
probablemente por síntesis de novo, pues esta fragmentación
cromosómica post-irradiación puede ser inhibida por la cicloheximida,
un inhibidor de la síntesis protéica, por actinomicina D,
inhibidor de la síntesis de ARN, por los iones de Zn++que
inhiben la endonucleasa de forma directa, o por quelación del calcio
intracelular. |
|
Recientemente se ha reconocido que existen genes cuya activación
pone en marcha la apoptosis, genes cuya activación la facilita,
y otros cuya activación la inhibe. En las células de mamíferos,
el gen indispensable para la apoptosis parece ser el que codifica el enzima
interleucin-1b -convertasa. Partes de la proteina
de este enzima son similares a las substancias producidas por genes de
otras especies que también regulan en ellas esta forma de muerte
celular.El TNFa parece tener tabién una
zona de 80 aminoácidos capaz de desencadenar esta muerte celular.
En algunas células la IL-4 parece inducir apoptosis, aunque en otras
tiene efecto protector. |
|
Además del gen activador, el gen p53 parece ser indispensable
para iniciar la apoptosis de algunos sistemas celulares. Su delección
hace que las células sean mucho más resistentes a la radiación,
aunque sigan siendo sensibles a la apoptosis inducida por los corticoides
o el calcio. Se ha encontrado que la radiación gamma induce la expresión
de este gen en varios tipos celulares en animales, y la extensión
de la apoptosis coincide con la expresión del p53. |
|
Por el contrario, el gen bcl-2 y sus relacionados parecen inhibir la
apoptosis y prolongar la supervivencia de las lineas celulares. La proteina
producida por este gen tiene un 25% de homología con la del virusde
Epstein-Barr, que también se ha visto que protege a las células
B de la muerte celular programada. Esta proteina parece tener capacidad
antioxidante y bloquea la apoptosis inducida por radiación, por
glucocorticoides, o por otros mecanismos. El ácido 9-cis-retinoico
es un potente inhibidor de la activación de la apoptosis, al menos
en las células T. La diferencia en actividad con la forma trans,
más de diez veces mayor, sugiere que la acción depende del
receptor X para el retinóico, que tiene mucha mayor afinidad por
la forma cis. |


