 Fig. 1.
Imagen tipo histograma en un tejido normal
Fig. 1.
Imagen tipo histograma en un tejido normal
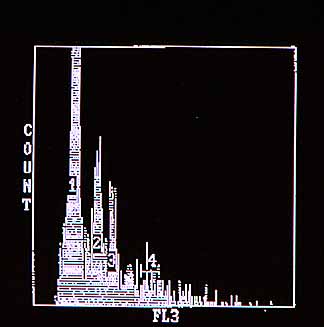
Fig. 4. Histograma aneuploide multiploide.Citometría de flujo. Tumor de ovario.
Las técnicas de CITOMETRIA se agrupan en la CITOMETRIA DE FLUJO y la CITOMETRIA ESTATICA. De todas las medidas que pueden obtener los métodos cuantimétricos, las de mayor aplicación práctica son la investigación de la PLOIDIA y de la PROLIFERACION CELULAR. Son de importancia porque el pronóstico de muchos tumores se relaciona con la carga de DNA y con la actividad mitótica. Además los datos de ploidía en general no cambian, y así se ha podido comprobar en algunos casos que algunos valores de la citometría de flujo se mantienen durante décadas. Sin embargo el pronóstico de neoplasias en estadios precoces o avanzados no suele tener correlación con la cantidad de DNA. En los estadios muy iniciales al ser los tratamientos muy efectivos la curva natural de evolución no es observada y en los muy avanzados el pronóstico no se modifica por la ploidía sino por el grado de diseminacion de la neoplasia.
El material biológico objeto de estudio por estos métodos puede proceder de cultivos celulares, de tejido fresco, bloques de parafina trás fijación en formol o de citologías.
 Fig. 1.
Imagen tipo histograma en un tejido normal Fig. 1.
Imagen tipo histograma en un tejido normal |
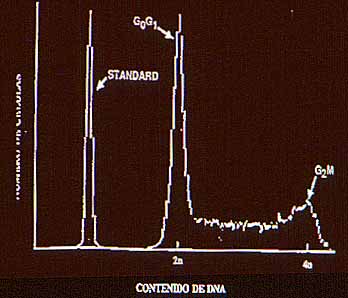
La ploidía en la citometría se recoge en histogramas que se comparan con los de poblaciones celulares control. Normalmente cerca del 90% de las células en un tejido están en fase G0 y G1 del ciclo celular o lo que es lo mismo en un momento en que no se están dividiendo y que su carga cromosómica está formada por el número de pares de cromosomas propios de la especie. Esto se conoce como 2c. El resto de las células están adquiriendo material de DNA o ya han alcanzado la cantidad doble de DNA (4c) y por tanto están preparándose o dispuestos para la mitosis. Son las fases S y G2 y M del ciclo celular. Por ello el histograma representativo de una población celular normal (Fig. 1), está formado por un pico alto y mayor (2c) que corresponde a las fases G0/G1, una fase de meseta de las células en fase S que están sintetizando DNA(fase S), y otro pico menor (4c) correspondiente a las células en fase G2 y M . |
| El histograma se considera diploide si el pico primero y más alto, coincide con una desviación, en general, no muy superior al 10% con el de una población control que habitualmente está formada por hematíes de diversas especies o por células no tumorales del individuo en que estaba el tumor. | |

|
Cuando la distribución de las células en el dispersado problema coincide como hemos dicho con el del control se dice que el índice de DNA (ID) es de 1 (ya que su cociente sería 1) y nuestro caso es por tanto DIPLOIDE( Fig.2 y 3). |
 Fig. 4. Histograma aneuploide multiploide.Citometría de flujo. Tumor de ovario. |
Todos los ID distintos de 1 se denominan ANEUPLOIDES. Los menores de 1 hipoploides y los mayores de 1 hiperploides. Un ID de 2 se denomina histograma tetraploide y multiploide (Fig 4) cuando hay múltiples picos correspondientes a otras tantas poblaciones celulares por el contenido de DNA. |
La aneuploidia es frecuente en los tumores malignos y en general es un parámetro que señala peor pronóstico, aunque en algunos tumores debido a la mayor sensibilidad a los tratamientos, como ocurre en cervix y linfomas, indica lo contrario. Por estudios de cancerogénesis en animales se ha visto que antes de la transformación a carcinoma los epitelios presentan aneuploidia. Ello indica que el análisis de DNA puede ser utilizado para separar las displasias con mayor probabilidad de transformación maligna.
La PREPARACION del material para la CITOMETRIA DE FLUJO en esencia consiste en conseguir dispersados celulares a los que se les aísla los núcleos mediante destrucción del citoplasma con pepsina o detergentes. Finalmente los núcleos son marcados con fluorocromos que se unen estequiométricamente con los ácidos nucleicos por lo que la emisión de fluorescencia es directamente proporcional a la cantidad de ADN nuclear. Los fluorocromos más frecuentemente usados son Ioduro de Propidio, Bromuro de Etidio y DAPI. Tienen avidez tanto por el ARN como por el ADN, por lo que es necesario eliminar las cadenas de ARN. Esto se consigue incubando la suspensión celular con RNAasa antes de la tinción con el fluorocromo. Algunos colorantes como el Naranja de Acridina se unen al ARN y al ADN emitiendo fluorescencia de distinta longitud de onda por lo que se utiliza para el análisis simultáneo de ambos componentes. En algunos estudios para separar solo las células tumorales se las marca con anticuerpos con fluorescencia y así al fluorecer con el orange se obtiene el histograma separado de las células de un tumor de estirpe epitelial del de otras células como las del estroma o inflamatorias. El protocolo que seguimos en el Hospital Clínico, utiliza ioduro de propidio y esta basado en la técnica de Vindelov.
En el citómetro de flujo (Fig.5) la suspensión celular a estudiar se sitúa en el colector de muestras que es un compartimiento presurizado desde el que va a una cámara de flujo. Las partículas de la suspesión se sitúan en el centro del flujo y pasan una a una a velocidad constante por la fuente de excitación que suele ser un LASER de Argón. El haz de luz se dispersa al ser interceptado por las partículas y además se produce una excitación de los fluorocromos. Varios filtros ópticos dejan pasar determinadas longitudes de onda. Las señales luminosas son recogidas por unos fotodetectores colocados en el eje de la luz en posición ortogonal consiguiendo medir los ángulos de dispersión de la luz y la intensidad de la fluorescencia. Las señales son amplificadas y transformadas a forma digital en un computador.

Fig. 5. Equipo de citometría de flujo
Antes de cada sesión de trabajo se fijan las CONDICIONES DE ANALISIS que consisten fundamentalmente en alinear el laser y ajustar los voltajes para obtener el canal de fluorescencia deseado. Para las partículas de control utilizamos elementos de plástico fluorescentes homogéneos y muy estables. Usamos controles biológicos correspondientes a núcleos celulares con una cantidad conocida de ADN. Los hematíes de pollo contienen un 35% de ADN respecto a la especie humana y los de carnero un 80%. Es conveniente añadir un nuevo control que idealmente es una muestra sana del paciente y del mismo órgano, procesada en iguales condiciones que la muestra problema.