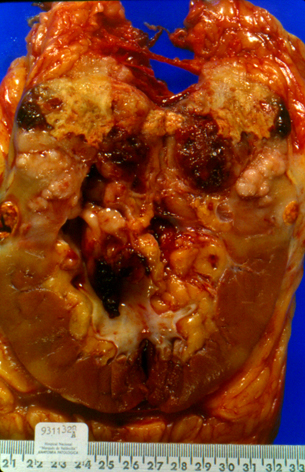
Figura 1. Carcinoma renal sarcomatoide. Nótese el aspecto blanquecino de algunas áreas.
Introducción:El carcinoma de células renales sarcomatoide (CCRS) es poco frecuente. Presenta áreas típicas de carcinoma renal asociadas con un componente sarcomatoide de origen epitelial. El pronóstico es fatal en la mayoría de los casos, sin que existan factores pronósticos de importancia. Mediante citometría de flujo se ha observado un 60% de aneuploidía en los escasos tumores analizados. Presentamos 15 casos de CCRSs analizando diferentes parámetros en relación con la supervivencia, incluído el análisis de ploidía y ciclo celular mediante citometría de flujo.
Material Y Métodos: Revisamos 306 carcinomas de células renales diagnosticados en el Hospital Universitario Marqués de Valdecilla desde 1971 hasta 1994, encontrándose 15 CCRSs. Se dividieron los tumores según el componente predominante (>50%) fuera sarcomatoide o epitelial. Realizamos contaje e índice mitótico (en relación a 10 CGA, a 1000 células, y a mm2). La citometría de flujo se realizó sobre material incluido en parafine de acuerdo con las recomendaciones de consenso para la implantación de la citometría de ADN clínica. Se utilizó el Cellfit Cell cycle analysis versión 2.0.2 de Becton-Dickinson, con análisis matemático de fase S según el método RFIT.
Resultados: El estadio clínico-patológico (p<0,05) y la proporción de componente sarcomatoide (p<0,001) correlacionaron con el pronóstico en el análisis LogRank. El análisis de ploidía mostró un 46,7% de tumores aneuploides. No se observó relación de la ploidía con la supervivencia. Existe una tendencia al mejor pronóstico en tumores con Fase S menor del 20%. El contaje y el índice mitótico no mostraron relación con la supervivencia.
Conclusión: El estadio clinico-patológico y la proporción de componente sarcomatoide mostraron importancia pronóstica en los carcinomas renales sarcomatoides El contaje, índice mitótico y la ploidía no mostraron correlación con la supervivencia en los carcinomas renales sarcomatoides.
El carcinoma renal sarcomatoide es una neoplasia poco frecuente que se caracteriza por presentar áreas típicas de carcinoma de células renales asociadas íntimamente con un componente morfológico sarcomatoide pero de origen epitelial (1) (Figuras 1 y 2). A pesar de su relativamente corta incidencia: 1.0% (2)-6.3% (3) dentro de los carcinomas, parece importante reconocer este tipo de tumor ya que ha demostrado ser de peor pronóstico que el carcinoma de células renales convencional (4) y presenta un elevado índice de metástasis en el momento del diagnóstico con nula respuesta a la cirugía radical (5).
Es preciso diferenciarlos de los verdaderos sarcomas renales, menos frecuentes (1-3% de los tumores renales malignos) (6) pero de características histológicas similares. Por otra parte, en estudios genéticos se ha demostrado que presenta múltiples anomalías cromosómicas, algunas de ellas compartidas con las del resto de tipos de carcinomas de células renales (7,8) y mediante citometría de flujo se ha observado un elevado índice de aneuploidía entre la población celular tumoral, alcanzando valores entre el 60% (9) y el 100% (10) en las dos series en la que se ha estudiado este parámetro hasta el momento.
Presentamos 15 casos de carcinoma renal sarcomatoide con el propósito de establecer una correlación clínico-patológica analizando diferentes parámetros en relación con la supervivencia, incluído el análisis del contenido nuclear en ADN mediante citometría de flujo.
Se revisaron los 306 carcinomas de células renales diagnosticados en el Hospital Universitario Marqués de Valdecilla desde 1971 hasta 1994 por dos patólogos de nuestra institución, admitiéndose para este estudio sólamente los 15 que mostraban un componente claramente epitelial asociado a otro sarcomatoide con marcadores epiteliales inmunohistoquímicos positivos (Cam 5.2, 34-beta-E12, EMA) (Dako. Glostrup. Dinamarca). En todos los casos se utilizó recuperación de antígenos mediante olla a presión y buffer citrato y el sistema EnVision Plus en un inmunoteñidor automático Techmate 500-220 (Biotek, Santa Bárbara. CA USA).
Se valoraron todas las preparaciones histológicas disponibles, y en los casos en que éstas se encontraban deterioradas se practicaron nuevos cortes. El número de preparaciones examinadas osciló entre 2 (correspondiente a una biopsia) y 23, con una media de 8,46. El caso correspondiente a la biopsia no fue incluido en el análisis de la proporción del componente sarcomatoide.
En todos los casos se valoró la proporción del componente sarcomatoide, dividiendo los tumores en dos grupos, según el mayoritario (>50%) fuera dicho componente sarcomatoide o que el mayoritario fuera el epitelial. También se tuvo en cuenta el patrón histológico de las dos fracciones, según recordara al Histiocitoma Fibroso Maligno, al Fibrosarcoma, o fuera no específico, indicando las áreas más características en la parte sarcomatoide y de acuerdo con lo expuesto por Fleming 1993 (7) en las áreas epiteliales.
La cantidad de tejido necrótico se valoró de acuerdo con lo expuesto por otros autores (11) de la siguiente forma: Los tumores que no presentaban zonas necróticas, grado 1; si la necrosis era mínima (<15%) grado 2; moderada (15-50%) grado 3; o masiva, grado 4.
De las características celulares de las áreas sarcomatoides se tuvo en cuenta el grado nuclear (12), y el índice mitótico en relación a 10 CGA, a 1000 células, y a mm2 (13) así como la densidad celular, expresada en nº de células por mm2
Con todos los datos recogidos tanto anatomopatológicos como de exploraciones clínicas se procedió a asignar el estadio clínicopatológico a cada tumor según la U.I.C.C (14).
Para el análisis del contenido nuclear en ADN, seguimos las recomendaciones del consenso para la implantación de la citometría de ADN clínica (15,16). Se utilizó material incluido en parafina, (repitiéndose el análisis con dos muestras diferentes para evitar el factor de la heterogeneidad tumoral) practicando 4 cortes de 50 mm de espesor, de muestras que contenían al menos un 20% de celularidad tumoral. Para el procesamiento, se siguió una modificación del método de Hedley (17). La desparafinación se realizó a 55º durante 20' en una mezcla de Xilol-HemoDe (FisherBrand USA) en proporción 1/3, repitiéndose este paso durante 10' a temperatura ambiente. Posteriormente el material fue rehidratado mediante pasos sucesivos de 20 minutos por alcoholes de concentraciones decrecientes (100º, 96º, 70º, 50º) y agua destilada. La digestión enzimática fue practicada en proteasa (Sigma) disuelta en PBS al 0.1% y a pH de 7,4 durante 2h. a 37ºC agitando en vórtex repetidamente (18).
Para detener la digestión se utilizó PBS frío, filtrando luego el material en malla de 40 mm y centrifugando a 1500 rpm durante 10 minutos. Por último se procedió a la resuspensión y almacenamiento durante 24 h. a 4ºC de las células en buffer citrato.
Se realizó control de número de células (mínimo de 500.000) y aplicación del kit "Cycle test DNA reagent kit de Becton-Dickinson Cat No 95-2000", con tratamiento con RNAasa y tinción de las células con Yoduro de Propidio con el método de Vindeløv (19). El control del pico de referencia diploide fue en todos los casos componente tisular normal no tumoral.
La medición se realizó en un aparato FacScan, equipado con el programa Cellfit Cell cycle analysis versión 2.0.2 de Becton-Dickinson, con análisis matemático de la fase S según el método RFIT (rectángulo). Se efectuó en todos los casos un proceso de ventana (gating) para evitar agregados celulares.
Se consideró un tumor como aneuploide en ADN si se demostraba la presencia de un pico de ADN distinto al de la población diploide considerando el contenido nuclear de ADN de ésta como 2N. Los tumores se catalogaron dentro de la categoría de tetraploides si el pico correspondiente a la posición 4N sobrepasaba el 15% de las células (20) y si se demostraba la presencia de una población apreciable en el pico 8N. Sólo se admitieron para el estudio aquellos casos cuyo coeficiente de variación fue menor de 10 (21,22).
El seguimiento clínico postintervención fue de al menos 5 años en 11 casos. El resto osciló entre 10 y 40 meses. Se realizaron curvas actuariales de supervivencia con el método de Kaplan-Meier. La comparación estadística entre las curvas se efectuó con el test de Logrank.
Los carcinomas renales sarcomatoides suponen en nuestra serie un 4,8% de los carcinomas de células renales (15/306). En la tabla I presentamos los datos clínicos de los pacientes. En 4 de los 15 casos, en las exploraciones radiológicas se sugerían otros diagnósticos como el de pielonefritis xantogranulomatosa o el de oncocitoma debido a la existencia de zonas hipodensas centrales, áreas necróticas y calcificaciones. El tratamiento aplicado fue en todos los casos quirúrgico, con nefrectomía radical mediante laparotomía o lumbotomía, excepto en uno de ellos en el que sólo se pudo practicar biopsia diagnóstica y tratamiento paliativo al ser inextirpable. Se asoció tratamiento quimioterápico en uno de ellos, sin que se observara mejoría en la supervivencia. El estadio histopatológico fue variable, con 8 pacientes (53,33%) que presentaban enfermedad metastásica en el momento del diagnóstico, siendo el lugar de asiento extranodal más frecuente el pulmón (20% tres casos), correspondiendo a estos pacientes supervivencias muy cortas. Sólo 2 (13,3%) casos presentaron metástasis óseas al diagnosticar el tumor, y cuatro (26,6%) presentaron metástasis en ganglios linfáticos regionales. En tres de los casos la tumoración se encontraba limitada al riñón. En el análisis de Log-Rank aparecieron diferencias significativas (p<0,05) con medias de supervivencia en estadios II, III y IV de 57,67; 35,75 y 8,31 meses respectivamente (Figura 3).
Las propiedades microscópicas se observan en la tabla II. En todos los casos se objetivaron áreas típicas de carcinoma entremezcladas con otras más pleomórficas formadas por células fusiformes de gran atipia. En 5 de los casos predominaba claramente el patrón sarcomatoide mientras que en diez el mayoritario era el patrón epitelial. Al efectuar la prueba de Log-Rank encontramos diferencias altamente significativas entre los dos grupos (p<0,001) (Figura 4).
En cuanto a la disposición de la fracción sarcomatoide, la más frecuente fue la no específica, aunque en todos ellos se podían observar áreas entremezcladas formadas por células que recordaban más o menos estrictamente a varios tumores de partes blandas tales como rabdomiosarcoma, hemangiopericitoma, condrosarcoma e incluso osteosarcoma con células gigantes osteoclasto-like.
Las áreas claramente epiteliales fueron de patrón arquitectural sólido en 10 ocasiones, destacando la existencia de una tumoración quística y dos de características papilares. Las células eran de aspecto granular eosinófilo en 9 casos,y de forma llamativa cromófobas en otro caso ya comunicado por nuestro grupo (23). No aparece relación estadística con la supervivencia en el análisis de Log-Rank, aunque hay que señalar que todos los pacientes con tumores formados por células claras fallecieron de la enfermedad, frente a un 67% de los tumores formados por células eosinófilas. El único caso formado por células cromófobas continua vivo y libre de enfermedad a los 71 meses del diagnóstico.
El grado de necrosis fue 3 en la mayoría de los tumores, existiendo sólo 1 con un porcentaje de tejido necrótico menor del 15%. En el análisis estadístico no aparecieron diferencias significativas.
La densidad celular no fue uniforme con grandes diferencias entre tumores, siendo la media de 4426,49 células/mm2, pareciendo existir una tendencia al peor pronóstico en los tumores con mayor densidad celular, aunque sin llegar a mostrar significación estadística (datos no mostrados).
El índice mitótico reveló ser variable según el parámetro de referencia utilizado, relacionándose perfectamente el nº de mitosis por 10 CGA con mitosis por mm2. De todas formas en el análisis de correlación entre nº de mitosis y supervivencia no se pudo hallar relación estadística con ninguno de los parámetros utilizados (Figura 5).
En los 15 casos analizados mediante citometría de flujo, obtuvimos un índice de tumores aneuploides en ADN de un 46,67% (7/15), siendo uno de los tumores tetraploide, otro hipodiploide y uno multiploide con un pico hipo y otro hiperdiploide (Figura 6).
En el análisis estadístico de los datos referentes a la ploidía y supervivencia, no encontramos diferencias significativas en el Log-Rank (p=0,222) (Figura 7), aunque la media de supervivencia en los pacientes con tumores diploides en ADN fue de 36,9 meses y en los aneuploides en ADN de 15,2 meses. Sí se observó relación sin embargo entre la ploidía y el estadio clínico-patológico, siendo el 75% de los casos diagnosticados en estadio IV aneuploides, mientras que en el resto de estadios sólo un 14% de tumores fueron aneuploides.
En el análisis de los parámetros de proliferación celular, obtuvimos diferencias entre las fases S de los tumores diploides y aneuploides en ADN aplicando la prueba de U Mann-Withney. Por otro lado en el análisis de Log-Rank, y estratificando los tumores con un punto de corte arbitrario del 20% de células en Fase S, no se apreciaros diferencias significativas, aunque las medias de supervivencia se separaban con 8,1 meses para aquellos tumores con una Fase S mayor de 20 (seis pacientes) y 40,3 para los de Fase S menor de 20 (seis pacientes) (Figura 8).
Por otro lado tampoco encontramos diferencias apreciables al estratificar los tumores de acuerdo a la ploidía en ADN y los parámetros de proliferación celular (es decir, diploides y aneuploides con fases S altas y bajas).
Los tumores epiteliales renales han sufrido en su conocimiento una evolución que ha desembocado en la posibilidad de utilizar una clasificación aplicable de rutina usando métodos habituales anatomopatológicos que corresponde con tumores genotípicamente distintos (7). De todos modos el carcinoma sarcomatoide no tiene todavía una delimitación clara desde el punto de vista genético ya que parece compartir características tanto del carcinoma papilar parenquimatoso como del convencional (8,24).
En nuestra serie y desde el punto de vista clínico, el gran tamaño tumoral observado en el momento del diagnóstico (11,3 cm de media) ha resultado en una gran proporción de neoplasias de localización subtotal, lo que unido a la frecuente aparición de necrosis y calcificación hace que en varios casos el diagnóstico preoperatorio por análisis de imagen (TAC o Ecografías) orientara hacia procesos inflamatorios tales como la pielonefritis xantogranulomatosa o hacia procesos tumorales benignos como el oncocitoma (4/15).
El análisis del estadio clínicopatológico revela una alta proporción de casos con metástasis en el momento del diagnóstico (53%), siendo el pulmón el lugar de asiento más frecuente, cifra que coincide con las aportadas por Tomera (2) (38,5%) Sella (5) (56,8%) y Bertoni (25) (42%) y ligeramente superior a la de Ro (4) (28,5%). Al analizar la relación del estadio con la supervivencia encontramos claras diferencias con una sobrevida media para los casos de estadio IV de 8,31 meses, equivalenta a la de Sella (5) (4,5 meses). Para el resto obtuvimos una media de 35,75 meses en los pacientes en estadio III y de 57,67 meses para los estadios II. En cuanto a la importante correlación encontrada, estamos de acuerdo con los autores que encuentran que este es uno de los parámetros que mejor define el pronóstico de los pacientes (4,9). Dentro de los parámetros histológicos analizados, el porcentaje del componente sarcomatoide ha sido el único diferenciador desde el punto de vista estadístico de forma muy importante, presentando una buena correlación con el pronóstico al separar los tumores en dos grupos. Así, los casos con más de un 50% de componente sarcomatoide presentan 3,5 meses de supervivencia media. Sólo un autor refiere que este parámetro puede tener importancia pronóstica, aunque sólo en el caso de tumores localizados en el riñón (4). Nosotros encontramos una media de supervivencia de 36,5 meses en aquellos pacientes con menos del 50% de componente sarcomatoide.
El patrón histológico del componente sarcomatoide no arrojó diferencias significativas en cuanto a su comportamiento, semejante a lo obtenido por otros autores (9).
El grado de necrosis también ha sido considerado en la literatura (4), y nosotros destacamos la importante presencia de necrosis en la mayoría de los tumores y el hecho de haber encontrado una tendencia al peor pronóstico conforme este se hace más evidente, aunque no llega a ser significativa estadísticamente.
En cuanto al componente epitelial, es importante señalar que la mayoría (10/15) estaba compuesta por células granulares con el patrón arquitectural sólido como dominante. De todas formas hay que apuntar la existencia de dos tumores papilares, patrón que sólo ha sido notificado en nuestro conocimiento por un autor (26) y también el hecho que sólo una de las neoplasias, ya comunicada por nuestro grupo (23) contenía células cromófobas, en contra de la opinión de algunos autores que indican al carcinoma cromófobo como el componente epitelial más frecuentemente asociado con un cambio sarcomatoide (10).
La densidad celular no fue uniforme y no presentó relación con el pronóstico, semejante a lo comunicado (4), aunque existía un tendencia al peor pronóstico al aumentar la celularidad. Los índices mitóticos analizados no presentaron relación estadística aunque hay que destacar una tendencia a empeorar el pronóstico conforme dicho índice aumentaba.
En nuestro estudio hemos encontrado un elevado porcentaje de tumores aneuploides en ADN (47%). Sin embargo, no hemos encontrado una relación apreciable con la supervivencia aunque bien es cierto que se observa una disminución de la media en la cifra de supervivencia entre los tumores diploides y aneuploides, con lo que este parámetro, si bien no es definitivo, sí podría resultar orientativo. Además, aparece en nuestro estudio el dato que indica que los tumores aneuploides se presentan más frecuentemente en estadios avanzados, semejante a lo encontrado por otros autores (9) con lo que quizá el efecto del contenido nuclear anómalo en ADN pudiera quedar enmascarado por el del estadio clínico, más fuerte en el análisis estadístico. Así pues estamos de acuerdo en que en este tipo tumoral, la ploidía en ADN resulta un factor más a tener en cuenta a la hora de considerar el pronóstico de estos pacientes. Existen dos comunicaciones sobre citometría de flujo en carcinomas renales sarcomatoides (9,10). En el primer artículo, el 60% de los casos son hipodiploides, mientras que Akhtar encuentra un elevado porcentaje de tumores hipodiploides. Ellos relacionan este hecho con la naturaleza cromófoba del componente epitelial. Nuestros resultados son diferentes en cuanto a la proporción de neoplasias hipodiploides, pero sí estamos de acuerdo en el elevado porcentaje de carcinomas aneuploides. Por otro lado, los parámetros de proliferación celular tampoco aportan un elemento distintivo desde el punto de vista estadístico, aunque aquellos pacientes con tumores de fase S elevadas presentan una media de supervivencia menor.
En resumen, hemos analizado 15 casos de carcinoma sarcomatoide renal, y hemos encontrado que los parámetros que se asocian de forma estrecha con el pronóstico en el análisis de Log-Rank han sido el porcentaje de la fracción sarcomatoide y el estadio clínicopatológico, resultando de menor interés el grado de necrosis, los datos obtenidos de la citometría de flujo y tanto la densidad celular como los índices mitóticos.
|
Figura 1. Carcinoma renal sarcomatoide. Nótese el aspecto blanquecino de algunas áreas. |