RESUMEN
- Fundamento: El horno de microondas (HMO) fue introducido en los laboratorios
de anatomía patológica en la década de los 80. Actualmente el HMO doméstico
es empleado habitualmente en los procedimientos de microscopia óptica, fundamentalmente
como fuente de energía para el desenmascaramiento antigénico por calor junto
a una solución tampón, de forma alternativa a la olla presurizada o a los
vaporizadores. Además de para este procedimiento en algunos centros y de manera
menos frecuente lo emplean para acelerar la fijación tisular, proceder a la
inclusión en parafina y en resinas o realizar de forma rápida técnicas histoquímicas.
No obstante el HMO doméstico carece de un adecuado control de la radiación
energética y temperatura alcanzada y además la infinidad de modelos en el
mercado con diferentes potencias, imposibilita la obtención de resultados
reproducibles entre laboratorios que permitan estandarizar cada método.
En la actualidad, la nueva generación de MO que controlan de forma constante
la temperatura (± ½ ºC), hasta para sustancias no polares como la parafina
o el xileno y que disponen de sistemas antiburbujas permiten la realización
rápida de fijación e inclusión de tejidos en parafina y en resinas, desenmascaramiento
antigénico más controlado, aceleración de tinciones histoquímicas e inmunohistoquímicas
incluida la técnica con oro coloidal, hibridación in situ y amplificación
de ADN.
Objetivo: El propósito de esta comunicación es aportar nuestra experiencia
en la utilización de los HMO de la última generación para el manejo de las
biopsias que requieren un procesamiento acelerado y destacar distintos protocolos
y procedimientos de fijación, inclusión y tinción de las muestras tisulares.
Material y métodos: Para el procesamiento de las biópsias empleamos un
horno microondas de última generación Energy Beam Sciences Inc. modelo H2800/2
con una potencia de 1800 vatios (Vitro-Imico, España). Las muestras fueron
cilindros y cuñas renales con sospecha de rechazo agudo o procedentes de
riñones de donantes añosos.
Resultados: Mediante la utilización de este tipo de hornos es posible acelerar
la inclusión de pequeñas muestras de tejido hasta tan solo una hora, así
como reducir enormemente los tiempos de incubación de las técnicas más habituales
en patología renal diagnóstica como es el caso del PAS, tricrómico de Masson,
plata metenamina, etc. Se discuten y comentan los protocolos técnicos que
empleamos y las posibilidades técnicas en los laboratorios de anatomía patológica
de los nuevos HMO.
PALABRAS
CLAVE
Microondas, Fijación, Inclusión, técnicas histoquímicas.
INTRODUCCION
El horno de microondas (HMO) es una cavidad multimedio de resonancia cerrada,
en la que debido a sus dimensiones y al material de alta conductividad del que
están fabricadas sus paredes, se generan campos electromagnéticos de resonancia
con una frecuencia comprendida en el rango de 2.425-2.475 GHz 1.
Boon y Kok 1 recogen perfectamente
la reciente historia del HMO en los laboratorios de patología que data sólo
de hace dos décadas y que, a pesar de haberse obtenido numerosos progresos en
la manipulación de las biopsias y de los procedimientos técnicos, tan sólo algunas
de las posibilidades de este instrumento han sido adoptadas como cotidianas.
En el trabajo habitual de los laboratorios de patología existen diariamente
múltiples actividades que pueden beneficiarse del empleo de HMO. La irradiación
en los tejidos con una fuente energética externa de calor determina mejoras
en la conservación de las características morfológicas e incremento de la velocidad
de las reacciones fisicoquímicas que acontecen en el procesamiento de los tejidos
2.
La no universalización de los procedimientos técnicos empleando HMO creemos
que tiene su principal causa en que en los laboratorios de patología fueron
introducidos fundamentalmente los HMO domésticos. Estos presentan serios problemas
a la hora de reproducir los resultados debido a la imposibilidad de controlar
la temperatura adecuadamente (en muchos modelos la temperatura sólo se gradúa
en múltiplos de 5 grados y en un rango limitado) o de controlar el tiempo de
irradiación (unos modelos disponen de selección del tiempo en ciclos, en intervalos
de tiempo predeterminados, etc.) y también debido a que existe una gran variabilidad
en la potencia de cada MHO doméstico (rango entre 500-1000 W), por último es
conocido que en la cámara del HMO no es homogénea la irradiación ni constante
la temperatura que se alcanza. Todas estas circunstancias hacen imposible conocer
la exacta potencia que se emplea en cada procedimiento y por ende su estandardización.
El desarrollo de procesadores microondas específicos para los laboratorios
de patología ha permitido solventar los problemas en el control de potencia
y temperatura manteniendo una curva de calentamiento ideal y manteniendo el
tejido o las secciones histológicas en contacto con los reactivos durante el
tiempo exacto a la temperatura o potencia deseada.
El propósito de esta comunicación es aportar nuestra experiencia en la utilización
de los HMO de la última generación para el manejo de las biopsias que requieren
un procesamiento acelerado y destacar distintos protocolos y procedimientos
de fijación, inclusión y tinción de las muestras tisulares.
MATERIAL
Y MÉTODOS
Las muestras fueron cilindros y cuñas renales con sospecha de rechazo agudo
o procedentes de riñones de donantes añosos. Para el procesamiento de las biópsias
empleamos un horno de microondas de última generación, específico para laboratorio,
marca Energy Beam Sciences Inc. modelo H2800/2 con una potencia de 1800 vatios
(Vitro-Imico, España).
Las muestras fueron procesadas en HMO según el protocolo de inclusión acelerada
(aprox. 1 hora) que se detalla en la tabla I.
Tabla I: Protocolo de fijación e inclusión en horno de micoondas*
| REACTIVO |
TIEMPO |
TEMPERATURA |
VOLUMEN REACTIVO |
| Preserve TM |
30 + 15 min. |
T.A. + 55ºC |
250 mL en recipiente de plástico. |
| Alcohol absoluto |
4 min. |
67ºC |
250 mL |
| Alcohol absoluto |
2 min. |
67ºC |
250 mL |
| Alcohol isopropílico |
4 min. |
74ºC |
250 mL |
| Alcohol isopropílico |
2 min. |
74ºC |
250 mL |
| Parafina |
8 min. |
83ºC |
250 mL. Previamente calentada y licuada en horno convencional y en recipiente
de cristal. |
* Para muestras de 4 x 3 mm de diámetro máximo. Para muestras más grandes o
con tejido adiposo abundante hay que incrementar los tiempos
Tras obtener secciones renales de 3 µm de espesor, dejar secar en estufa durante
10 minutos y desparafinar e hidratar hasta agua destilada de forma convencional,
se realizaron las técnicas histoquímicas de hematoxilina-eosina, PAS y tricrómico
de Masson de forma clásica y también e HMO según los procedimientos siguientes:
Técnica de hematoxilina-eosina 3:
- Introducir las secciones en hematoxilina de Harris en una jarra Coplin durante
3 minutos (o en HMO cubrir con 200µL de hematoxilina e irradiar a 500 W durante
20-30 segundos).
- Lavar en agua hasta obtener el cambio de color.
- Teñir con eosina durante 2 minutos (o en HMO cubrir con 200µL de eosina
e irradiar a 500 W durante 20-30 segundos).
- Deshidratar, aclarar y montar.
Técnica del PAS3:
- Tratar las secciones con ácido peryódico al 0.5% durante 10 minutos a temperatura
ambiente.
- Lavar con agua destilada dos veces.
- Incubar con reactivo de Schiff 15-30 minutos (o en HMO con un volumen de
50 mL de reactivo en una jarra Coplin, previamente calentado a 35ºC, irradiar
a 70ºC durante 40 segundos).
- Lavar en agua corriente.
- Contrastar con hematoxilina 30 segundos, Lavar y azulear en agua destilada.
- Deshidratar aclarar y montar.
Técnica del tricrómico de Masson3-4:
- Mordentaje en solución de Bouin durante 1 hora a 56-60ºC (o en HMO en jarra
Coplin tapada con una gasa durante 60 segundos a 450 W)
- Extraer la solución fijadora y lavar en agua destilada hasta que desaparezca
el color amarillo.(Con HMO dejar atemperar hasta poder tocar los portaobjetos
con los dedos)
- Teñir con hematoxilina férrica durante 10 minutos, Lavar con agua corriente.
(o en HMO en jarra Coplin tapada con una gasa, irradiar a 450 W durante 45
segundos. Dejar atemperar fuera del HMO y lavar con agua corriente durante
2 minutos).
- Lavar con agua destilada.
- Teñir con la solución de escarlata-fucsina ácida 1% durante 2-5 minutos
(o en HMO irradiar a 450 W durante 60 segundos).
- Lavar con agua destilada.
- Tratar con solución acuosa de ácido fosfotúngstico al 5% durante 15 minutos.
(o en HMO irradiar a 450 W durante 60 segundos).
- Teñir con solución verde luz al 2% durante 5 min.(o en HMO irradiar a 450
W durante 20 segundos).
- Diferenciar en solución de ácido acético al 1% durante 3-5 minutos a temperatura
ambiente.
- Deshidratar aclarar y montar.
RESULTADOS
Y DISCUSIÓN
Con los nuevos HMO se consiguen realizar los procedimientos técnicos habituales
en los laboratorios de patología con igual o superior calidad que de forma tradicional.
La figura 3 pone de manifiesto este hecho (Fig. 3).
Se puede apreciar en las imágenes que la morfología y el grado de tinción de
las estructuras renales son superponibles con ambos procedimientos. La aportación
fundamental de los HMO para labortorio con respecto a los HMO domésticos es
la posibilidad de controlar rigurosamente todo el proceso y hacer estandarizable
los métodos entre los distintos laboratorios.
La fijación de los tejidos con HMO se produce de forma más rápida, y en el
caso de biopsias como las utilizadas en este trabajo de 3-4 mm de espesor se
completa en 45 minutos. Las muestras tisulares con este procedimiento son perfectamente
válidas para realizar estudios complementarios de inmunohistoquímica o de biología
molecular. Los fijadores empleados pueden ser como en este caso Preserve TM,
Cryofix TM o formalina tamponada al 10%; todos ellos proporcionan
unos resultados superponibles. El HMO puede utilizarse para fijar rápidamente
con formalina tamponada secciones criostáticas. Este procedimiento consistente
en aplicar sobre los cortes en congelación formalina tamponada al 10% irradiando
en HMO a 450 W durante 20 segundos, la mejor calidad de las imagenes morfológicas
puede ser de utilidad para el diagnóstico en las intraoperatorias.
La inclusión de los tejidos en HMO puede utilizarse en aquellos casos donde
se requiere la emisión de un dictamen rápido. Como se desprende de esta comunicación,
una de las principales aplicaciones son las biopsias de trasplante; pero biopsias
de diagnóstico, principalmente de pequeño tamaño como son las biopsias endoscópicas
o los cilindros renales, hepáticos, prostáticos etc., pueden beneficiarse de
una inclusión menos prolongada. El principal factor que se debe considerar es
el tiempo de contacto con los reactivos. Los tiempos de fijación e inclusión
se de deben ajustar en función del tamaño del espécimen y de las características
del tejido, principalmente la proporción de tejido adiposo. Nosotros preferimos
modificar sólo el parámetro tiempo dejando constante el volumen de los reactivos
y la temperatura de incubación.
Otros procedimientos que generalmente se alargan durante bastante tiempo, como
la decalcificación de tejidos óseos o dentales pueden acelerase con el uso de
HMO. Empleando HMO se pueden decalcificar las muestras para su posterior corte
con micrótomo convencional en menos tiempo (horas o días en vez de en semanas).
El procedimiento es muy simple y basta con colocar las muestras en una solución
de ácido nítrico al 5%. e irradiar a 450 W hasta que el tejido se ablande. En
el caso de cilindros de médula ósea puede conseguirse en menos de 4 minutos
5.
Las técnicas histoquímicas empleando HMO se pueden llevar a cabo de dos formas
diferentes. Por un lado, se pueden realizar introduciendo las preparaciones
en jarras Coplin con los reactivos en los que se introduce la sonda, que asegura
el control exacto de la temperatura y del tiempo total en el que debe estar
en contacto la sección tisular con el reactivo. Con esta forma de proceder,
es aconsejable para mejorar las tinciones ajustar la temperatura de los reactivos
por debajo de su punto de ebullición. De forma alternativa las tinciones se
pueden realizar colocando sobre una plataforma de poliestireno los portaobjetos
y cubriendo con algunas gotas del reactivo la sección tisular. En este segundo
caso, la tinción es cuestión de segundos puede ser de utilidad en extensiones
citológicas y cuando las altas temperaturas no produzcan alteración de los reactivos
6. Nosotros hemos obtenidos mejores
resultados controlando la temperatura con sonda introducida en la jarra Coplin
con suficiente reactivo y añadiendo dentro de la cámara del HMO un recipiente
con agua destilada para garantizar un mayor grado de humedad.
Prácticamente todas las tinciones de histoquímicas habituales pueden realizarse
empleando HMO (hematoxilina-eosina, Papanicolaou, Giemsa) como las tinciones
histoquímica para identificación específica de sustancias, microorganismos o
componentes tisulares (PAS, mucicarmin, Azul Alcian, Sudan, Perls, Rojo congo,
Masson-Fontana, Grimelius, Ziehl-Neelsen, Plata metenamina, Auramina Rodamina,
Van Gieson, Tricrómico de Masson, Bodian, etc.) 7
con una reducción de tiempo muy importante (de horas a minutos) y con una calidad
semejante o mayor sobre todo en las técnicas en las que se emplean colorantes
polares o colorante con iones de metales pesados que reaccionan extraordinariamente
bien con la irradiación con HMO 7.
Es sin duda para el desenmascaramiento antigénico para lo que más se emplea
el HMO. Diferentes son los procedimientos usados en cada centro en cuanto a
tiempos, recipientes, soluciones tampón etc. tanta es la diversificación que
ante la gran disparidad de resultados se intenta imponer la olla presurizada
como método mas estandarizable para el desenmascaramiento antigénico. Nosotros
pensamos que los nuevos HMO pueden ser de gran ayuda en la tarea de unificar
procedimiento al poder controlar exactamente los parámetros mas cruciales como
son temperatura y potencia de irradiación. Además en esto HMO La inclusión acelerada
permite la realización de tinciones inmunohistoquímicas sin ningún tipo de artefacto
e incluso mejora la tinción inespecifica debida a la biotina endógena presente
en el riñón. En el caso de biopsias posttrasplante con sospecha de rechazo,
el poder disponer en pocas horas de técnicas histoquímicas (hematoxilina-eosina,
PAS y tricrómico de Masson) para poder establecer la severidad del rechazo renal
mediante el sistema de puntuación de Banff, junto a un estudio completo del
perfil inmunofenotípico por inmunohistoquímica del infiltrado inflamatorio,
que facilita la identificación correcta de fenomenos como la tubulitis o la
glomerulitis es de gran ayuda para el patólogo.
En conclusión, con estos breves comentarios queremos poner de manifiesto las
múltiples posibilidades de los HMO específicos para laboratorios de Anatomía
Patológica y las utilidades y beneficios que pueden tener en muchas de las actividades
cotidianas que se llevan a cabo en nuestros laboratorios.
BIBLIOGRAFIA
- Boon
ME, Kok LP. Microwave cookbook of pathology. The art of microscopic visualization.
Coulomb Press Leyden, 2ª ed. pp 86-88, 1989.
- Horobin
RW. Fundamental mechanisms of cytological staining. In: Boon ME, Kok LP
(eds) Standasdization and quantitation of diagnostic staining in cytology.
Leiden: Columb Press Leyden. pp 9-14, 1986.
- Moorlang
HE, Boon ME, Kok LP Reducing staining times to seconds in individual cases
applying microwave irradiation. Stain Technol 62: 357-360, 1987.
- López-Caballero
JJ, Peña MC, De Federico MJ. Coloración para fibras colágenas y elásticas
del tejido conectivo. Coloración para sustancia amiloidea. En: Garcia del
Moral R, Laboratorio de Anatomía Patológica, Interamericana McGraw-Hill,
pp 175-193, 1993.
- Stam
PH. Microwave for decalcification In: Boon ME, Kok LP. Microwave cookbook
of pathology. The art of microscopic visualization. Coulomb Press Leyden,
2ª ed. pp 118, 1989.
- Suurmeijer
AJP. Microwaves and staining, In: Boon ME, Kok LP. Microwave cookbook of
pathology. The art of microscopic visualization. Coulomb Press Leyden, 2ª
ed. pp 119-140, 1989.
- Brinn
NT. Rapid metallic histologic staining using microwave oven. J Histotechnol
6:125-129, 1983.
ICONOGRAFÍA

Figura 1. Horno de microondas con control de temperatura y
potencia.
|

Figura 2. Detalle del panel de control de temperatura y potencia
del Horno de microondas.
|
Figura 3. Secciones tisulares renales fijadas e incluidas con
el procedimiento convencional (A, B, C y D) y con procedimiento acelerado
en horno de microondas (E, F, G y H). A y E, esclerosis glomerular y
fibrosis intersticial (tricrómico de Masson x400). B y F, leve arteriosclerosis
(B: PAS x400; F: H&E x400). C y G, glomérulos renales teñidos con PAS
(x400). D y H, arteriolopatía hialina (PAS x400)
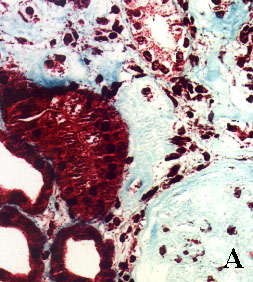
figura 3A
|
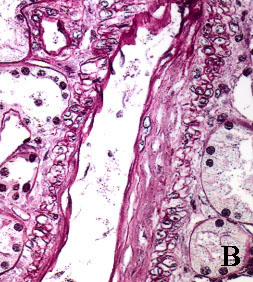
figura B
|
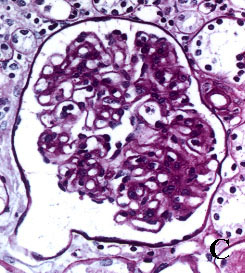
figura C
|
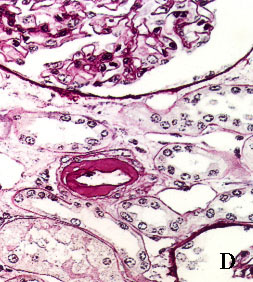
figura D
|
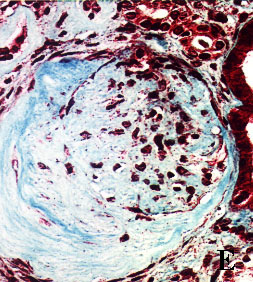
figura E
|
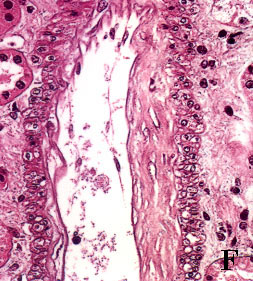
figura F
|
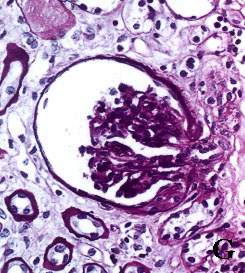
figura 3G
|
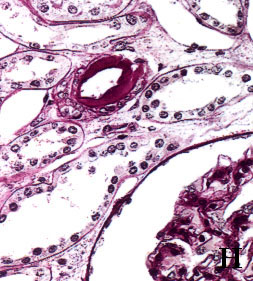
figura 3H
|
Francisco O'Valle.
Copyright © 2000, Departamento de Anatomía Patológica, Facultad de Medicina
y Hospital Universitario, Universidad de Granada, 18012 Granada, España. Reservados
todos los derechos.







