|
Lesión inducida por la ventilación mecánica: ¿qué hemos aprendido de los
modelos experimentales?
Introducción
El Síndrome de Distrés
Respiratorio Agudo (SDRA) es una entidad clínica caracterizada por una
elevada mortalidad que, aunque ha descendido en las últimas décadas (1)
debido al mejor conocimiento de la fisiopatología de la enfermedad y a la
mejora global de las medidas de soporte, se mantiene entre un 30 y un 50%
(2, 3). La principal causa de mortalidad de este grupo de pacientes es el
fracaso múltiple orgánico (SFMO) (5), representando el 90% de la misma; la
hipoxemia refractaria constituye sólo un 10% de los casos (4).
Se ha propuesto cómo la propia
ventilación mecánica (VM) empleada en el tratamiento y en el soporte vital
de los pacientes con o sin lesión pulmonar puede estar implicada en los
mecanismos productores del fracaso múltiple orgánico. Sin embargo, hasta
el momento no se habían descrito los mecanismos por los cuales la VM
podría producir daño “a distancia” en los órganos, induciendo su
disfunción. Este es el propósito de esta revisión de la literatura:
resumir la evidencia experimental actual con la que se puede demostrar que
es posible tanto la lesión pulmonar inducida o producida por el respirador
como también la lesión de órganos a distancia.
Lesión pulmonar inducida
por el ventilador (VILI)
Son varios los
mecanismos por los que la ventilación mecánica puede ocasionar una lesión
pulmonar:
1.- Daño pulmonar
inducido por el empleo de elevadas FiO2
En humanos no se ha podido demostrar
claramente el daño pulmonar debido al empleo de elevadas fracciones
inspiradas de oxígeno porque no se han observado las lesiones histológicas
características de una lesión pulmonar aguda. Sin embargo, sí se han
demostrado fenómenos de atelectasia “por reabsorción” y una bronquitis
hiperóxica.
Se piensa que el
estrés oxidativo es un mecanismo importante en la producción del daño
pulmonar. Este daño se produce mediante la producción de diferentes
agentes reactivos con propiedades oxidantes (6, 7), como el peróxido de
hidrógeno, los radicales hidroxilo y los aniones superóxido, que en estos
modelos experimentales inducen fenómenos de apoptosis del epitelio
alveolar, además de alteraciones de las funciones celulares,
fundamentalmente a nivel mitocondrial.
2.- Daño pulmonar
inducido por presión excesiva en la vía aérea (barotrauma) y
sobredistensión pulmonar (volutrauma)
La relación
existente entre la presión en la vía aérea y el daño pulmonar fue
demostrada inicialmente por Webb y col (8), empleando un modelo de ratas
ventiladas durante 1 hora y utilizando diferentes niveles de presión en su
vía aérea, con y sin PEEP. Los animales que fueron ventilados con
presiones pico de 14 cm de H2O no presentaron ningún cambio
histológico en el pulmón, mientras que aquellos ventilados con alta
presión (entre 30 y 45 cm de H2O) presentaron lesiones
consistentes en un importante edema tanto perivascular como alveolar.
Exactamente los mismos hallazgos han sido demostrados posteriormente en
ensayos con animales de mayor tamaño (conejos y ovejas), aunque en ellos
el tiempo de VM preciso para inducir estos cambios histológicos ha sido
mayor (9, 10, 11, 12).
Sin
embargo, más que la presión en la vía aérea por sí misma parece que el
efecto deletéreo sobre el pulmón está determinado por la sobredistensión
del tejido pulmonar, reflejando por tanto más un ”efecto de volumen” que
un verdadero “efecto de presión”. Así, en modelos experimentales de
ventilación mecánica en ratas en los que se limita la entrada de volumen
circulante mediante el cerclaje del tórax y abdomen, y en los que se
induce una sobrepresión importante en la vía aérea (con relativamente bajo
volumen), no se ha observado una lesión histológica compatible con lesión
pulmonar aguda (13). En cambio, cuando los animales son ventilados en el
mismo modelo experimental sin restricción torácica, empleando por tanto un
volumen circulante más alto, sí que se produce una lesión pulmonar severa.
Estos resultados se
han comprobado también en otras especies (14, 15). Kolobow y col (11),
estudiando dos grupos de ovejas sanas anestesiadas y ventiladas bien con
un volumen circulante de 10 ml/kg o bien con un volumen circulante de
50-70 ml/kg, observaron como en un periodo de 48 horas y en las de mayor
volumen circulante se desarrollaba un daño pulmonar agudo caracterizado
por la alteración progresiva de la mecánica pulmonar y el deterioro del
intercambio gaseoso, sin que existiera barotrauma. Este daño se producía
con volúmenes circulantes elevados incluso cuando las presiones en la vía
aérea eran sólo moderadamente elevadas (30 cm de H2O). En la
necropsia se encontraron atelectasias pulmonares severas y un aumento del
agua extravascular pulmonar, con un aumento significativo del peso
pulmonar.
Imai Y y
col. (16) han descrito cómo el empleo de VM, administrada en un modo
asistido-controlado, con volúmenes corrientes altos, FiO2 de 1
y con una presión media en la vía aérea de 15 cm de H2O,
provoca al cabo de cuatro horas un aumento de la cifra de leucocitos
polimorfonucleares y de los niveles de PAF, TXB2 y 6 cetoPGF1 en el lavado
broncoalveolar (BAL), mientras ocurre una alteración de la mecánica
pulmonar, consistente en una disminución de la compliance estática,
comparada con los animales con SDRA inducido, ventilados con alta
frecuencia.
3.- Daño pulmonar
inducido por bajo volumen total (atelectrauma)
Existe
evidencia experimental de que lesiones histológicas y cambios
inflamatorios compatibles con SDRA pueden inducirse con el empleo en la
ventilación de un bajo volumen total, más que por un bajo volumen
circulante (17). Este atelectauma se produce por el mecanismo de cierre y
reapertura cíclico de las unidades alveolares cerradas y da lugar a
fenómenos de carácter inflamatorio (17).
En
diferentes estudios experimentales en animales y en humanos (18, 19, 20)
se ha descrito como la ventilación mecánica en modelos caracterizados por
el empleo de niveles bajos de PEEP da lugar a un incremento de los niveles
de marcadores inflamatorios medidos en el BAL. Estos hallazgos consisten
en un incremento de los niveles de TNF, IL-8, IL-6, PAF, TXB2 y de la
cifra de leucocitos polimorfonucleares que, además, se encuentran
activados, como se demuestra por el aumento en la expresión de CD11b
(B2integrina) y la disminución de la expresión de CD62L (L selectina) y de
F actina, lo que permite una adhesión leucocitaria inadecuada, aumentando
la posibilidad de migración transendotelial.
Colmenero
y col (21), estudiando el efecto de la PEEP y el empleo de bajos volúmenes
circulantes en un modelo de cerdo, también han demostrado cómo el empleo
precoz de PEEP previene un aumento de la permeabilidad vascular inducido
por la ventilación mecánica.
Tremblay y
col (22), en un modelo experimental sobre pulmón ex-vivo de rata séptica, han
descrito cómo la ventilación mecánica con volúmenes circulantes elevados
(40 ml/kg) produce un aumento en la concentración de mediadores
inflamatorios en el lavado pulmonar. Este efecto está potenciado si el
pulmón es ventilado sin PEEP, multiplicando por 50 la concentración de
mediadores en el lavado pulmonar. Sin embargo, este estudio puede ser
cuestionado porque no tiene en cuenta el posible efecto hemodinámico que
puede producir en el propio pulmón y en la incidencia de fenómenos
inflamatorios la ventilación con un volumen circulante tan elevado. De
hecho, recientemente Broccard y col (23), han demostrado en un modelo de
pulmón ex-vivo de conejo, cómo las alteraciones en la intensidad de la
perfusión del pulmón contribuyen a la producción de daño pulmonar inducido
por la ventilación mecánica.
Además de la liberación de mediadores
inflamatorios a nivel pulmonar, el empleo de estrategias ventilatorias
deletéreas en modelos experimentales induce fenómenos de apoptosis celular
a nivel pulmonar, e incluso se ha demostrado el fenómeno de traslocación
no solo de interleuquinas y mediadores inflamatorios, sino también
traslocación bacteriana desde el pulmón (24, 25).
4.- Daño pulmonar
inducido por otros parámetros ventilatorios
Aunque
existen pocos estudios, otros parámetros ventilatorios podrían tener
influencia en el desarrollo de VILI, aunque con un efecto mucho menos
significativo. Así, el incremento de la frecuencia respiratoria podría dar
lugar a un aumento de los fenómenos nocivos sobre el pulmón debido a un
mayor estrés de ciclado. En un modelo de pulmón de conejo perfundido
ex-vivo se ha demostrado mayor edema y hemorragia perivascular cuando éste
es ventilado con una frecuencia de 20 rpm que cuando es ventilado sólo con
3 rpm (26).
Otro
parámetro ventilatorio estudiado es el empleo de un flujo decelerado en
lugar de un patrón de flujo constante, asociándose con él una reducción de
los fenómenos de sobredistensión pulmonar en las zonas no dependientes
(27).
Además, todos estos fenómenos inductores
de lesión pulmonar son mucho más evidentes cuando los modelos deletéreos
de ventilación mecánica se aplican en pulmones previamente dañados (10,
28) o en modelos experimentales realizados sobre pulmones inmaduros (29).
Transmisión de la lesión pulmonar a la
circulación sistémica
El tejido
pulmonar sometido a los mecanismos descritos previamente da lugar a la
liberación de diferentes mediadores proinflamatorios, como el tromboxano
B2, el Factor activador de las plaquetas y diferentes citoquinas (16, 22,
30). Esta liberación de mediadores no queda circunscrita al espacio
alveolar sino que, en diferentes investigaciones, se ha demostrado cómo
pasan a la circulación sistémica (experimentos realizados tanto en modelos
de pulmón de ratones in vivo o ex-vivo con perfusión) (30, 31).
Además, se
ha demostrado la traslocación de bacterias o de sus productos desde los
espacios aéreos a la circulación sistémica. Estos estudios se han
realizado en animales de mayor tamaño (perros) ventilados con ZEEP y con
alto volumen tidal (24, 32), en los que se instilan intratraquealmente
poblaciones bacterianas, dando lugar a una bacteriemia.
Lesión de órganos a distancia
A pesar de
todos estos conocimientos, de la fuerte sospecha y de los datos indirectos
de que la ventilación mecánica aplicada de una manera deletérea podría ser
un factor contribuyente en la producción del Síndrome de Fallo Múltiple
Orgánico, sólo muy recientemente Imai y col (33) han demostrado esta
asociación.
Los investigadores realizan un modelo
experimental sobre conejos de Nueva Zelanda (4-5 kg), sedados, relajados y
ventilados mecánicamente a través de una traqueostomía, en los que se les
induce un SDRA mediante la administración intratraqueal de ácido
clorhidrico. Los animales (n=24) fueron aleatorizados a dos grupos de
ventilación mecánica:
-
Grupo 1
(grupo protector): bajo volumen (5-7 ml/kg) y alta PEEP (9-12 cm H2O).
-
Grupo 2
(grupo deletéreo): alto volumen (15-17 ml/kg) y baja PEEP (0-3 cm H2O).
La frecuencia respiratoria fue similar en ambos grupos, entre 45 y 55
rpm.
El modelo se mantuvo durante 8 horas y
posteriormente los animales fueron sacrificados. Ambos modelos de
ventilación fueron testados previamente en estudios piloto con el fin de
confirmar su efecto sobre el pulmón.
En este
estudio se describe cómo los animales del grupo 2 tienen en el aspirado
pulmonar y en plasma niveles más altos de MCP-1; IL-8 y oncogen regulador
del crecimiento (GRO), demostrando una mayor lesión pulmonar en este
grupo. Al tiempo, también se encuentra como marcador de lesión de órganos
a distancia, un aumento significativo del índice apoptótico en las células
epiteliales tubulares renales y en las células epiteliales de villis
intestinales. Estos cambios también se aprecian en el estudio de estas
poblaciones celulares mediante microscopía electrónica.
Resulta
llamativo que estos fenómenos no se produzcan en el hígado, y que en el
pulmón, el índice de apoptosis sea superior en aquellos animales
ventilados con una estrategia protectora. Pero es que en ellos, sin
embargo, los que son más frecuentes son los fenómenos de necrosis celular
(cambios ya descritos en anteriores modelos de isquemia-reperfusión) (34).
Estas
lesiones descritas son producidas por sustancias presentes en el plasma de
estos animales, descartando, por ejemplo, un posible efecto hemodinámico
del modelo. Este fenómeno lo demuestran los autores mediante el cultivo de
células (LLC-RK1) en plasma de conejos de ambos grupos, al tener de forma
significativa mayores fenómenos de apoptosis las células incubadas en
plasma de conejos del grupo 2 que las incubadas en plasma de animales del
grupo 1.
En el
momento actual y a la luz de los estudios presentados podemos afirmar que,
al menos a nivel experimental, existen conocimientos que indican que los
modelos de ventilación mecánica en los que se aplica un alto volumen
circulante que produzca fenómenos de sobredistensión de los espacios
alveolares, en aquéllos en que se emplean unos niveles bajos de PEEP que
permitan fenómenos de colapso alveolar y, por tanto, fenómenos de apertura
y cierre cíclicos de unidades alveolares cerradas, y en los que se
utilizan una alta frecuencia respiratoria y una alta FiO2, dan lugar a un aumento de la permeabilidad vascular y a fenómenos
inflamatorios que conducen a la liberación de mediadores al pulmón y al
paso de éstos a la circulación sistémica, siendo capaces de inducir daño a
distancia en órganos como el riñón o el intestino (Fig 1).
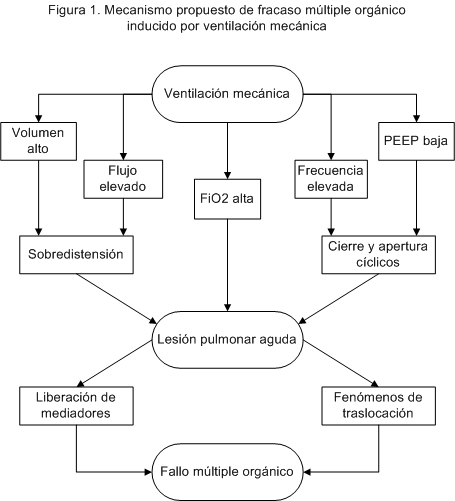
La mayoría de estos estudios de forma
aislada son criticables por ser realizados en modelos ex-vivo,
generalmente en animales de pequeño tamaño y con modelos de ventilación
mecánica exagerados. Por tanto, su aplicación directa sobre lo que
verdaderamente ocurre en humanos es difícil. Sin embargo, estos estudios
unidos a la evidencia que suponen los estudios llevados a cabo en humanos
comparando el efecto de diferentes estrategias de ventilación denominadas
“protectoras del pulmón”, hacen un todo que justifica el que se pueda
hablar de la ventilación mecánica como contribuyente en la producción del
fracaso múltiple orgánico.
Federico Gordo Vidal
Enrique Calvo Herranz
Unidad de Cuidados Críticos
Fundación Hospital Alcorcón, Madrid
©REMI, http://remi.uninet.edu. Mayo
2003.
Referencias
-
Hudson LD, Milberg JA,
Anardi D, Maunder RJ.
Clinical risks for
development of the acute respiratory distress syndrome. Am J Respir Crit
Care Med 1995; 151: 293-301. [Resumen
Medline]
-
Wyncoll DL,.Evans TW. Acute
respiratory distress syndrome. Lancet 1999; 354: 497-501.
[Resumen
Medline]
-
Ware LB,.Matthay MA. The
acute respiratory distress syndrome. N Engl J Med 2000; 342: 1334-1349.
[Resumen
Medline]
-
Esteban A, Fernandez-Segoviano
P, Gordo F, Aranburu J, Alia I, Martin A, Mon E. Correlation
among clinical and post-mortem diagnosis of ARDS. Am J Respir Crit Care
Med 1996; 159: 718.
-
Esteban A, Anzueto A,
Frutos F, Alia I, Brochard L, Stewart TE et al. Characteristics and
outcomes in adult patients receiving mechanical ventilation: a 28-day
international study. JAMA 2002; 287: 345-355.
[Resumen
Medline]
-
Chabot F, Mitchell JA, and
Gutteridge JM. Reactive oxygen species in acute lung injury. Eur Respir
J 1998; 11: 745-757. [Resumen
Medline]
-
Davis WB, Renard SI, and
Bitterman PB. Pulmonary oxygen toxicity. Early reversible changes in
human alveolar structures induced by hyperoxia. N Engl J Med 1983; 309:
878-883.
[Resumen
Medline]
-
Webb HH, Tierney DF. Experimental pulmonary edema due to
intermittent positive pressure ventilation with high inflation pressures.
Protection by positive end-expiratory pressure.
Am Rev Respir Dis 1974;
110: 556-565.
[Resumen
Medline]
-
Dreyfuss D,.Saumon G.
Experimental changes in the alveolo-capillary barrier induced by
artificial ventilation. Schweiz Med Wochenschr 1997; 127: 1023-1029.
[Resumen
Medline]
-
Dreyfuss D,
Saumon G.
Deleterious effects of mechanical ventilation on the lower lung. Rev Mal
Respir 1995; 12: 551-557. [Resumen
Medline]
-
Kolobow T, Moretti MP, Fumagalli R, Mascheroni D, Prato
P, Chen V, Joris M. Severe impairment in lung function induced by high peak
airway pressure during mechanical ventilation. An experimental study. Am
Rev Respir Dis 1987; 135: 312-315.
[Resumen
Medline]
-
John E, Ermacilla R, Golden
J. Effects of intermittent positive pressure ventilation on lungs of
normal rabbits. Br J Exp Pathol 1980; 61: 315-323. [Resumen
Medline]
-
Dreyfuss D, Soler P, Basset
G, Saumon G. High inflation pressure pulmonary edema. Respective effects of high
airway pressure, high tidal volume, and positive end-expiratory
pressure. Am
Rev Respir Dis 1988; 137:
1159-1164. [Resumen
Medline]
-
Carlton DP, Cummings JJ,
Scheerer LG. Lung overexpansion increases pulmonary microvascular
protein permeability in young lambs. J Appl Physiol 1990; 69: 577-583.
[Resumen
Medline]
-
Hernandez LA, Peevy KJ,
Moise A, Parker JC. Chest wall restriction limits high airway pressure-induced lung
injury in young rabbits. J Appl Physiol 1989; 66: 2364-2368.
[Resumen
Medline]
-
Imai Y, Kawano T, Miyasaka
K, Takata M, Imai T, Okayuma K. Inflamatory chemical mediators during
conventional ventilation and during HFOV. Am J Respir Crit Care Med
1994; 150: 1550-1554. [Resumen
Medline]
-
Whitehead T,.Slutsky AS.
The pulmonary physician in critical care: Ventilator induced lung
injury. Thorax 2002; 57: 635-642.
[Resumen
Medline]
-
Goodman RB, Strieter RM,
Martin DP, Steinberg KP, Milberg JA, Maunder RJ et al. Inflammatory
cytokines in patients with persistence of the acute respiratory distress
syndrome. Am J Respir Crit Care Med 1996; 154: 602-611.
[Resumen
Medline]
-
Matuschak GM. Liver-lung
interactions in criticall illnes. New Horiz 1994; 2: 488-504.
[Resumen
Medline]
-
Chollet S, Jourdain B,
Gilbert C, Elbim C, Chastre J, Gourgerot MA. Interactions between
neutrophils and cytokines in blood and alveolar spaces during ARDS. Am J
Respir Crit Care Med 1996; 153: 594-601.
[Resumen
Medline]
-
Colmenero R, Fernández R,
Fernández MA, Rivera R, Vazquez G.
PEEP and low tidal volume
ventilation reduce lung water in porcine pulmonary edema. Am J Respir
Crit Care Med 1997; 155: 964-970.
[Resumen
Medline]
-
Tremblay L, Valenza F,
Ribero P, Li J, Slutsky AS. Injurious ventilatory strategies increase
cytokines and c-fosm-RNA expression in a isolated rat lung model. J Clin
Invest 1997; 99: 944-952. [Resumen
Medline]
-
Broccard AF, Hatchkiss JR,
Kuwayama N. Consequences of vascular flow on lung injury induced by
mechanical ventilation. Am J Respir Crit Care Med 1998; 157: 1935-1952.
[Resumen
Medline]
-
Verbrugge SJ and Sorm V.
Lung overinflation without positive end expiratory pressure promotes
bacteremia after experimental klebsiella pneumoniae inoculation.
Intensive Care Med 1998; 24:
172-177. [Resumen
Medline]
-
Murphy NC, Tremblay L,
Engelberts JG, Slutsky AS, Romaschin A, Kavanagh BP. Adverse ventilatory
strategy causes pulmonary-to-systemic translocation of endotoxin. Am J
Respir Crit Care Med 2000; 162: 27-33.
[Resumen
Medline]
-
Hatchkiss JR, Blanch L,
Murias G. Effects of decreased respiratory frequency on
ventilator-induced lung injury. Am J Respir Crit Care Med
2000;
161:
463-468.
[Resumen
Medline]
-
Prella M, Feihl F,
Domenighetti G. Effects of short-term pressure-controlled ventilation on
gas exchange, airway pressures, and gas distribution in patients with
acute lung injury/ARDS: comparison with volume-controlled ventilation.
Chest 2002; 122: 1382-1388. [Resumen
Medline]
-
Hernandez LA, Coker PJ,
May S. Mechanical ventilation increases microvascular permeability in
oleic acid-injured lungs. J Appl Physiol 1990; 69: 2057-2061.
[Resumen
Medine]
-
Jobe AH,
Ikegami M. Lung development and function in preterm infants in the
surfactant treatment era. Annu Rev Physiol
2000; 62: 825-846.
[Resumen
Medline]
-
Chiumello D, Pristine
G, Slutsky AS. Mechanical ventilation affects local and
systemic cytokines in an animal model of acute respiratory distress
syndrome. Am J Respir Crit Care Med 1999; 160: 109-116.
[Resumen
Medline]
-
Held H, Boettcher S, Hamann
L, and et al. Ventilation induced chemokine and cytokine release is
associated with activation of NFkB and is blocked by steroids. Am J
Respir Crit Care Med 2001; 163: 711-716.
[Resumen
Medline]
-
Nahum A, Hayt J, and
Schmitz L, Marini JJ. Effect of mechanical ventilation strategy on dissemination of intratracheally instilled Escherichia coli in dogs. Crit Care Med 1997;
25: 1733-1743. [Resumen
Medline]
-
Imai Y, Parodo J, Kajikawa
O, De Perrot M, Fischer S, Edwards V et al. Injurious mechanical
ventilation and end-organ epithelial cell apoptosis and organ
dysfunction in an experimental model of acute respiratory distress
syndrome. JAMA 2003; 289: 2104-2112.
[Resumen
Medline]
-
Fischer S, Cassivi SD,
Xavier AM, and et al. Cell death in human lung transplantation:
apoptosis induction in human lungs during ischemia and after
transplantation. Ann Surg 2000; 231: 424-431.
[Resumen
Medline]
-
Amato MB, Barbas CS,
Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G et al. Effect of
a protective-ventilation strategy on mortality in the acute respiratory
distress syndrome. N
Engl
J
Med 1998; 338: 347-354.
[Resumen
Medline]
-
Stewart TE, Meade MO, Cook
DJ, Granton JT, Hodder RV, Lapinsky SE et al. Evaluation of a
ventilation strategy to prevent barotrauma in patients at high risk for
acute respiratory distress syndrome. Pressure- and Volume-Limited
Ventilation Strategy Group. N Engl J Med 1998; 338: 355-361.
[Resumen
Medline]
-
Singh JM,.Stewart TE.
High-frequency oscillatory ventilation in adults with acute respiratory
distress syndrome. Curr Opin Crit Care 2003; 9: 28-32.
[Resumen
Medline]
-
Esteban A, Alia I, Gordo F,
de Pablo R, Suarez J, Gonzalez G et al. Prospective randomized trial
comparing pressure-controlled ventilation and volume-controlled
ventilation in ARDS. For the Spanish Lung Failure Collaborative Group.
Chest 2000; 117: 1690-1696. [Resumen
Medline]
-
Ventilation with lower
tidal volumes as compared with traditional tidal volumes for acute lung
injury and the acute respiratory distress syndrome. The Acute
Respiratory Distress Syndrome Network. N Engl J Med 2000; 342:
1301-1308. [Resumen
Medline]
Palabras clave:
Síndrome de distrés respiratorio agudo, Lesión pulmonar inducida por
ventilador, Barotrauma, Volutrauma, Atelectrauma, Lesión sistémica
inducida por ventilador.
Busque en REMI con Google:
Envía tu comentario para su
publicación |