|
Tratamiento
antifibrinolítico en la cirugía de revascularización coronaria: riesgos de la aprotinina
[Versión para
imprimir]
Primera parte: [Resultados]
[Limitaciones] [Otras
evidencias]
Segunda parte: [Reflexión
sobre el papel de los estudios de cohortes para evaluar la seguridad de los
fármacos después de su comercialización]
Artículos REMI relacionados:
Palencia E. Riesgos del uso de aprotinina en cirugía cardiaca. [REMI
2006; 6 (2): 956] Echebarría J. Sobre
el uso de aprotinina en cirugía cardiaca. [REMI
2006; 6 (5): A46] [Comentario Lincoln de la Parte].
Martín JA. Utilidad de la aprotinina en pacientes reoperados de
cirugía cardiaca bajo circulación extracorpórea. [REMI
2006; 6 (6): A047C].
En un
estudio de cohortes prospectivo, Mangano y colaboradores [1]
analizan el pronóstico postoperatorio de pacientes sometidos a cirugía de
revascularización coronaria relacionándolo con la terapia antifibrinolítica
recibida. Los pacientes se reclutaron en 69 centros, recogiendo una fracción
1/50 de los casos esperados durante un año. El número esperado de casos por
centro fue de 100 y el periodo de reclutamiento se extendió entre noviembre
de 1996 y junio de 2001, seleccionando un total
de 4.374 pacientes. La asignación a un grupo de
tratamiento antifibrinolítico o a no recibir tratamiento antifibrinolítico
alguno no fue controlada por el investigador (de ahí la naturaleza de
observacional).
Se trata de
pacientes de más de 18 años en lista de espera para cirugía de
revascularización coronaria (la cirugía fue considerada primaria si era
electiva, suponía solamente revascularización coronaria o angioplastia, y
sin historia de cirugía cardiaca o vascular previa; se consideró compleja en
caso contrario).
Se compararon 4
grupos: Tres de tratamiento y un grupo control. Se usaron dos agentes
antifibrinolíticos análogos de la lisina: ácido aminocaproico y ácido
tranexámico, y un inhibidor de la serin-proteasa: aprotinina) y un grupo de
control sin tratamiento. Los contrastes se realizaron comparando cada uno de
los grupos de tratamiento con el grupo control.
Se seleccionaron como indicadores clínicos primarios de
resultado aquellos efectos adversos relacionados con la actividad
“protrombótica” de estos fármacos y que ocurrieron durante la
hospitalización: eventos cardiovasculares (infarto
agudo de miocardio o insuficiencia
cardiaca), cerebrovasculares (ictus,
encefalopatía o coma) o renales (disfunción o fallo renal). Además, midieron
como indicador de eficacia la reducción en las pérdidas sanguíneas en las 24
horas postcirugía. Se utilizaron definiciones operativas en la
identificación de cada tipo de evento de interés.
Se incluyeron en el estudio
3.000 pacientes, repartidos de forma desigual: a 1.295 se les administró
aprotinina, 833 ácido aminocaproico y 822 ácido tranexámico. El
grupo de control lo conformaron 1374 pacientes a los que no se administró
tratamiento antifibrinolítico alguno.
Al tratarse de un estudio
observacional, sin asignación aleatoria a los grupos de comparación, no
estaba garantizada la igualdad en la distribución de factores pronósticos
entre los grupos. Por ello fue necesario controlar en el análisis estas
desigualdades. En primer lugar, los autores se plantearon recoger para cada
paciente todos aquellos factores pronósticos y aquellos relacionados con la
decisión de asignar a un tratamiento u otro: en total se llegaron a recabar
7.500
variables por paciente (imaginamos que muchas de ellas serían la misma
variable medida en diferentes tiempos). Con esta información ajustaron las
diferencias entre grupos por el resto de factores pronósticos mediante
modelos multivariantes
(regresión logística). Para aminorar el sesgo de selección que supone una
asignación no aleatoria a los grupos de estudio, los autores construyeron
una puntuación que recogía la probabilidad de haber sido asignado a una
determinada terapia antifrinolítica. Con esta puntuación incorporada a los
modelos multivariantes (“propensity adjustment”)
se consigue un mejor
ajuste de los desequilibrios
entre los grupos de comparación.
Además, para el grupo de la
aprotinina se realizó un análisis dosis- respuesta comparando dos regímenes
de dosificación (dosis bajas y altas) del fármaco.
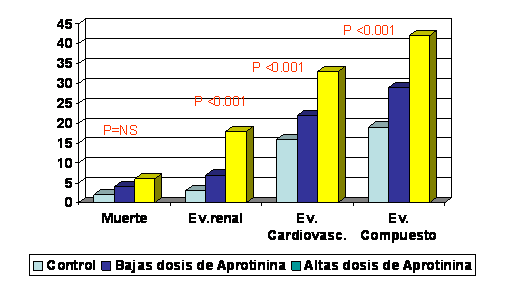
Principales resultados
Solamente
los pacientes a los que se administró aprotinina presentaron incrementos
estadísticamente significativos en los eventos desfavorables no mortales.
Aunque no se detectó una interacción estadísticamente
significativa entre el grupo de tratamiento y la complejidad de la cirugía
los autores muestran los resultados diferenciando ambos grupos, los
sometidos a cirugía primaria y aquellos a los que se practicó cirugía
compleja. Las asociaciones fueron mayores y estadísticamente significativas
en el primer grupo (tabla I).
|
Tabla I. Asociación entre la administración de
aprotinina frente a no tratamiento fibrinolítico en pacientes sometidos
a cirugía primaria tras ajustar el modelo multivariante
|
| Evento |
OR
ajustada (IC 95%) |
NND (IC
95%) |
| Mortalidad |
1,59 (0,76-3,34) |
87 (23-212) |
| Disfunción o fallo renal |
2,34
(1,27-4,31) |
27 (11-128) |
| Evento cardiovascular |
1,42 (1,09-1,86) |
19 (10-84) |
| Evento cerebrovascular |
2,15
(1,14-4,06) |
31 (12-246) |
| Compuesto |
1,49 (1,15-1,91) |
14 (8-45) |
| Compuesto: aparición de cualquier evento
desfavorable (muerte o evento renal o cardiovascular o cerebral); NND:
número de pacientes que es necesario tratar para observar un evento
desfavorable adicional; OR: odds ratio |
La relación entre aprotinina y la incidencia de eventos
desfavorables fue dosis-dependiente. La incidencia de eventos renales y del
indicador compuesto se incrementó de forma significativa en el grupo de
dosis baja de aprotinina respecto al control y en el grupo de alta dosis de
aprotinina respecto del grupo de dosis baja.
El indicador de eficacia (pérdidas sanguíneas en las
primeras 24 horas) se comportó de forma similar en los tres grupos de
tratamiento. La pérdida media con el control fue de 827 mL y la diferencia
media con respecto a aprotinina, ácido aminocaproico y ácido tranexámico fue
respectivamente de 74 mL (IC 95% 32-115 mL), 108
mL (IC 95% 64-151 mL) y de 151 mL (IC
95% 96-205 mL)
Limitaciones del estudio
En los estudios observacionales la distribución de los
pacientes entre los diferentes grupos de análisis responde a las
preferencias y decisiones tomadas por los pacientes y los facultativos que
los atendieron; una ventaja de este enfoque es
que analiza las relaciones entre exposición y resultado clínico en un
contexto de atención más realista que el de los ensayos clínicos. Como
contrapartida, la comparación entre los grupos está comprometida por una
posible distribución desigual de otros factores de riesgo, actuando como
factores de confusión en la relación exposición-efecto. Los métodos de
ajuste multivariante permiten compensar estas desigualdades,
pero tienen como principal limitación que solo pueden controlar los
factores de riesgo conocidos (los no conocidos o no medidos no pueden ser
controlados).
En el estudio de Mangano y col. [1]
la distribución por enfermedades de base es bastante similar, aunque existen
discretas diferencias en enfermedad renal de base,
que es uno de los factores analizados. Los autores del estudio han hecho un
esfuerzo importante en recoger todas las variables relacionadas tanto con el
tratamiento como con el desarrollo de los eventos desfavorables y han
utilizado técnicas de análisis multivariante. También presentan los datos
desagregados para eventos renales y se aprecia un aumento de ambos procesos
(disfunción renal y fallo renal que precisa diálisis) con aprotinina.
El estudio se ha diseñado con un tamaño de muestra
suficientemente grande para los cuatros grupos (tres de tratamiento y uno de
control). De todas maneras, los autores no dan detalles acerca de las
condiciones de cálculo del tamaño de muestra (hubiera sido interesante saber
la magnitud de las asociaciones que esperaban encontrar y en qué
estudios previos se basaban para estimarlas.
No se especifica si hubo
algún tipo de enmascaramiento entre los evaluadores. Tampoco se comenta si
se creó un grupo que revisara los eventos detectados para evitar “malas
clasificaciones”. De todas maneras, se trata de
eventos “duros” qué difícilmente habrán generado dudas en su detección y
clasificación.
Otras evidencias acerca de la seguridad de la
aprotinina en cirugía cardiaca
Los ensayos clínicos realizados hasta ahora han
mostrado una asociación mucho menor de la aprotinina con la incidencia de
disfunción renal y/o insuficiencia renal, y
solamente en uno de ellos los resultados fueron
estadísticamente significativos (tabla II).
|
Tabla II. Asociación de la utilización de aprotinina
con el riesgo de desarrollar un evento renal en revisiones sistemáticas
de ensayos clínicos
|
| Estudio |
RR (IC
95%) |
| Henry DA y col. [2] |
1,18 (0,17-20) |
| Brown JR y col. [3] |
1,47
(1,12-1,94) |
| Sedrakyan y col. [4] |
1,01 (0,55-1,83) |
| |
Existe una alerta de la FDA (FDA ALERT [2/2006]) de 8
de febrero de 2006 que comenta los resultados de este estudio y de otro
publicado en Transfusion [5]. Este segundo
estudio compara dos grupos de tratamiento antifibrinolítico (aprotinina
y ácido tranexámico) emparejados
mediante una puntuación de propensión
para balancear las diferencias basales en diferentes factores de riesgo. La
incidencia de disfunción renal fue significativamente superior en el grupo
de aprotinina (24%) respecto al ácido tranexámico (17%). Estas diferencias
fueron mayores en aquellos pacientes con una funcional renal preopeatoria
anormal (31% aprotinina, 18% ácido tranexámico).
El ACTA (Asociación de anestesistas cardiotorácicos en
cirugía cardiaca) [6] ha puesto en evidencia
algunas de las limitaciones del estudio de Mangano y cols y han sido motivo
de comentario en REMI [7]. Sin embargo, no
compartimos las limitaciones apuntadas por esta asociación en relación a la
naturaleza del estudio, el análisis estadístico utilizado y las variaciones
de la práctica clínica: esas tres limitaciones son inherentes a cualquier
estudio de cohortes y aceptarlas supondría negar cualquier evidencia
procedente de este tipo de estudios. Existió un verdadero esfuerzo por
“ajustar las diferencias”, lo que en teoría minimizaría la posibilidad de
sesgos.
Nos llama también la atención la poca diferencia en el
resultado de eficacia, que aunque sea estadísticamente significativo apenas
suponga 100 ml adicionales de pérdida, lo que
no supone siquiera una bolsa adicional de concentrados
de hematíes. En cualquier caso creemos que existen dudas suficientes acerca
de la seguridad de la aprotinina en cirugía cardiaca y que se dispone de
alternativas igualmente eficaces y seguras. Por tanto, y tal como apunta
Mangano en la respuesta a las cartas recibidas: “¿No debiéramos
posicionarnos protegiendo al paciente (primun non nocere) en lugar de
proteger al fármaco?”
Reflexión sobre el papel de
los estudios de cohortes para evaluar la seguridad de los fármacos después
de su comercialización
¿Cuales
son las razones para estas diferencias entre ensayos clínicos y estudios de
cohortes?
Los ensayos clínicos están diseñados para probar la
eficacia y seguridad de las terapias que se han de introducir en la práctica
clínica. Normalmente la puesta en marcha de los mismos se realiza por un
promotor comercial (el laboratorio productor del fármaco o una organización
de investigación contratada por él), y tienen
como objetivo primario comprobar la eficacia del nuevo producto. La
selección de los pacientes de estudio, los cálculos del tamaño de muestra,
la selección y definición de los indicadores clínicos de resultado, los
periodos de seguimiento, etc. se articulan
alrededor del objetivo de eficacia. Todo ello hace que sean relativamente
poco adecuados para comprobar la seguridad de un fármaco antes de su
autorización.
Estudios
de cohortes como el de Mangano y col. [1] se
diseñan invirtiendo la prioridad de los objetivos, teniendo como indicadores
primarios los relacionados con la seguridad (aparición de eventos
desfavorables relacionados con la actividad protrombótica de los fármacos)
sin renunciar a la medición de la eficacia. El estudio se ha planteado con
un tamaño de muestra suficientemente grande para los cuatros grupos y se ha
realizado en un contexto realista (incluyendo las variaciones en las
prácticas clínicas existentes). Estas características hacen que este tipo de
estudios sean más adecuados para comprobar la seguridad de una determinada
terapia. Como contrapartida, son más sensibles a la comisión de
sesgos que los ensayos clínicos, tanto en el proceso de
selección de los participantes, con características y pronósticos desiguales
entre grupos de partida, como en el seguimiento y obtención de la
información, sobre todo si no se utilizan técnicas de enmascaramiento.
¿Qué puede hacerse para
poner en evidencia los verdaderos perfiles de seguridad de estas terapias?
Una primera solución sería aumentar el tamaño y número
de ensayos clínicos y resumirlos en revisiones sistemáticas de calidad: con
ello solventaríamos el problema de un tamaño de muestra insuficiente pero,
como hemos apuntado anteriormente, no conseguiríamos corregir el resto de
factores que conducen a una infraestimación en la incidencia de efectos
adversos.
Otra solución la tendríamos en los estudios
observacionales postautorización: son estudios que analizan diferentes
aspectos de la eficacia y seguridad de las terapias ya autorizadas e
introducidas en la práctica clínica. Sin embargo, la gran mayoría de los
estudios postautorización son promovidos por los mismos laboratorios que
comercializan el fármaco que se estudia y presentan una escasa calidad
metodológica tanto desde el punto de vista científico como ético [8].
Finalmente, tenemos los estudios observacionales de
cohortes bien diseñados y sin un promotor comercial, que como el comentado,
se ha diseñado para detectar y evaluar la asociación de una terapia con
posibles eventos adversos.
En definitiva, sería deseable que las mismas agencias
estatales que se preocupan en legislar sobre los aspectos relacionados con
la eficacia de los nuevos fármacos, introdujeran medidas legales para
afianzar la seguridad de las nuevas terapias antes de su autorización
definitiva. Algunas de estas medidas ya han sido sugeridas [9],
como el registro prospectivo de todos los
ensayos clínicos, los requerimientos legales de hacer públicamente
disponibles todos los datos sobre efectos adversos detectados o la
realización de revisiones sistemáticas actualizadas de los efectos adversos
en ensayos publicados y no publicados. También ayudaría la introducción de
una nueva filosofía, más participativa y menos sensible a los conflictos de
intereses, en la forma de realizar y publicar los resultados de los ensayos
clínicos en marcha [10], sin olvidar la
promoción de la investigación independiente sobre la seguridad de las
terapias en uso.
Enlaces:
-
Mangano DT,
Tudor IC, Dietzel C; Multicenter Study of Perioperative Ischemia Research
Group; Ischemia Research and Education Foundation. The risk associated
with aprotinin in cardiac surgery.
N Engl J Med
2006; 354: 353-365. [Resumen]
[Artículos
relacionados]. Comentario en REMI: Palencia E. Riesgos del uso de
aprotinina en cirugía cardiaca. [REMI
2006; 6 (2): 956]
-
Henry DA, Moxey AJ, Carless PA, O'Connell D, McClelland
B, Henderson KM, Sly K, Laupacis A, Fergusson D. Anti-fibrinolytic
use for minimising perioperative allogeneic blood transfusion. Cochrane
Database Syst Rev 2001; 1: CD001886. [Resumen]
[Artículos
relacionados].
Uso de
antifibrinolíticos para reducir la necesidad de transfusión sanguínea
alogénica perioperatoria (Revisión Cochrane traducida). En: La Biblioteca
Cochrane Plus, 2006 Número 2. Oxford: Update Software Ltd. Disponible en:
http://www.update-software.com. (Traducida de The Cochrane Library, 2006
Issue 2. Chichester, UK: John Wiley & Sons, Ltd.)
[PDF
107 pág, 1,65 Mb]
-
Brown JR,
Birkmeyer NJ, O'Connor GT.
Aprotinin in cardiac surgery (letters).
N Engl J
Med 2006;
354:
1953-1957.
-
Sedrakyan A,Treasure T,Elefteriades JA. Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery: a
systematic review and meta-analysis of randomized clinical trials. J
Thorac Surg 2004; 128: 442-448. [Resumen]
[Artículos
relacionados]
-
Karkouti K, Beattie WS, Dattilo KM, McCluskey SA,
Ghannam M, Hamdy A, Wijeysundera DN, Fedorko L, Yau TM. A propensity score
case-control comparison of aprotinin and tranexamic acid in high-transfusion-risk
cardiac surgery. Transfusion 2006; 46:
327-338. [Resumen]
[Artículos
relacionados]
-
Statement by the Committee of the Association of
Cardiothoracic Anaesthetists on the use of aprotinin in cardiac surgery [PDF
3 pág, 12 Kb]
-
Echebarría J. Sobre el uso de aprotinina en
cirugía cardiaca. [REMI
2006; 6 (5): A46]
-
Pérez Zafrilla B,
García del Pozo J, Aguilar Ros A, de abajo FJ. Calidad de los estudios
postautorización de tipo observacional registrados en España antes de su
regulación. Med Clin 2006; 126: 607-610. [Resumen]
[PDF
55 Kb]
-
Dieppe PA, Ebrahim S,
Martin RM, Juni P. Lessons from the withdrawal of rofecoxib. BMJ
2004; 329: 867-868. [Resumen]
[Artículos
relacionados] [PDF
77 Kb]
-
Smith R, Roberts
I. Patient safety requires a new way to publish clinical trials. PloS Clin
Trials. 2006 1: e6. [HTML]
[PDF
454 Kb]
Jose María Tenías Burillo *, Vicente Ruiz García **
* Medicina Preventiva, Hospital Lluís Alcanyís de Xátiva
** Hospitalización Domiciliaria, Hospital La Fe de
Valencia
©REMI, http://remi.uninet.edu.
Junio
2006.
Palabras clave: Cirugía cardiaca, Aprotinina,
Tratamiento.
Busque en REMI con Google:
Envía tu comentario para su
publicación |