|
La sepsis y
el shock séptico constituyen factores de riesgo con frecuencia asociados
con el desarrollo de lesión pulmonar aguda (LPA) y síndrome de distrés
respiratorio agudo (SDRA) [1] por un doble mecanismo, indirecto
(situaciones de shock y liberación de mediadores inflamatorios) y directo
por efecto sobre el pulmón en el caso de la sepsis de origen pulmonar
(neumonía) [2]. A su vez, la propia sepsis como mecanismo de origen de la
lesión pulmonar aguda es un factor de riesgo independiente de aumento de
la mortalidad [3]. Hudson y col. [4] estudiaron de forma prospectiva a 695
pacientes ingresados en unidades de cuidados intensivos, con alguna de las
entidades clínicas supuestamente relacionadas con el SDRA; 179 (26%) de
ellos desarrollaron un SDRA, la mayor incidencia se produjo entre los
pacientes con sepsis (75 de 176: 43%) y en aquéllos que habían sido
sometidos a politransfusión (46 de 115: 40%). El porcentaje de pacientes
que desarrolló un SDRA en el resto de entidades fue significativamente
menor: contusión pulmonar 22%, aspiración broncopulmonar 22%,
politraumatizados 25%, polifracturados 11% y en el caso de intoxicación
por drogas 8%.
La mayor
mortalidad en términos absolutos se produce en aquéllos que desarrollan un SDRA en el contexto de un síndrome séptico, con una mortalidad de un 70%;
sin embargo, el mayor incremento de mortalidad en relación con la
aparición de un SDRA se produce en los pacientes politraumatizados, en los
que el desarrollo de esta entidad incrementa su mortalidad 4,3 veces
(12,9% contra 58%), mientras que el incremento en los pacientes sépticos
es únicamente de 1,4 veces (49,5% contra 68,9%).
Doyle y col.
[2] en un estudio de cohortes en el que estudiaron de forma consecutiva a
123 pacientes que cumplían criterios de LPA, encontraron una tasa de
mortalidad del 58%. La sepsis fue nuevamente la enfermedad que con mayor
frecuencia se asoció al daño pulmonar agudo (41% de los pacientes). La
conclusión de este estudio fue que el grado de LPA en los tres primeros
días de evolución, no predice la supervivencia de este grupo de pacientes,
sino que las variables que afectaban a la mortalidad en un análisis de
regresión logística eran: la sepsis, la disfunción de otros órganos y la
presencia de enfermedad crónica hepática.
|
2. Daño
pulmonar inducido por la ventilación mecánica |
Uno de los
cambios más importantes producidos en los últimos años en relación con la
LPA y el SDRA
es la aparición del concepto de que la propia ventilación mecánica puede
ser lesiva para el pulmón y perpetuar, por diferentes mecanismos, la
situación de daño pulmonar. Este fenómeno se produce tanto en pulmones
previamente sanos, como en los ya dañados, pero es de mucha mayor
intensidad, tanto in vivo como en modelos experimentales, en aquellos
pulmones que presentan una LPA preexistente [5].
Existe cada
vez mayor evidencia, tanto experimental como en modelos clínicos, de que
existe un proceso al que se ha denominado daño pulmonar inducido o
asociado a la ventilación mecánica (VILI ó VALI), que es iniciado por la
aplicación de forma repetida, sobre el tejido pulmonar, de una excesiva
tensión y excesiva deformación que afecta a estructuras tales como el
fibroesqueleto y la microvascularización pulmonar, así como a las pequeñas
vías aéreas distales y los tejidos yuxta-alveolares, y que es capaz de
reproducir, no sólo el cuadro clínico de la LPA y el SDRA tal y como
fueron definidos en 1994 por la conferencia americano-europea de consenso
[6], sino también la lesión histológica que caracteriza a la lesión
alveolar difusa, tal y como fue definida en 1976 por Katzenstein y col.
[7], y que constituye el verdadero patrón oro para el diagnóstico del SDRA
(figura 1).
|
Figura 1: Criterios de Katzenstein y
col. de daño alveolar difuso
|
| |
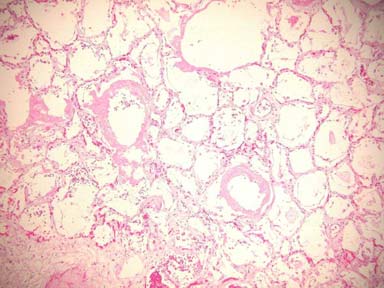 |
-
Presencia de membranas hialinas
-
Necrosis de células alveolares tipo I o células endoteliales
-
Edema o fibrosis intersticial
-
Proliferación de células alveolares tipo II
|
|
|
Según un
modelo publicado recientemente por Marini y Gattinoni [8], y sin necesidad
de que se produzcan presiones intratorácicas elevadas, los cambios en la
tensión y deformación de los tejidos pulmonares que se producen en los
diferentes ciclos respiratorios, son capaces de inducir fenómenos de
auténtica ruptura de las paredes alveolares, así como fenómenos de
mecanotransducción y liberación de mediadores inflamatorios que pasan a la
circulación pulmonar y sistémica, y que son capaces de producir una lesión
sobre órganos a distancia del pulmón, fenómeno denominado biotrauma. No es
necesario el empleo de grandes volúmenes corrientes para inducir estos
fenómenos de estiramiento pulmonar, debemos tener en cuenta que estas
fuerzas de estiramiento se producen una media de 21.600 veces al día (con
una frecuencia respiratoria en ventilación mecánica media de 15
respiraciones por minuto), y sobre unos 480 millones de alvéolos en unos
pulmones de tamaño medio, ya que según mediciones realizadas por Matthias
Ochs y col. [9] empleando microscopía electrónica han determinado que en
cada mm3 de tejido pulmonar existen 170 alvéolos.
El VILI se
produce fundamentalmente por dos mecanismos (figura 2):
|
Figura 2: Curva de presión-volumen
(P/V)
|
| |
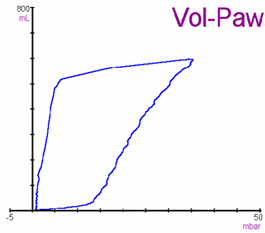 |
Los puntos de inflexión inferior y superior,
teóricamente representan los puntos a partir de los que se producen
fenómenos de sobredistensión y colapso pulmonar |
|
|
1.- La
sobredistensión pulmonar (volutrauma), producida por el empleo de volúmenes
corrientes elevados. Este fenómeno de estiramiento pulmonar va a producir
fenómenos de aumento de la permeabilidad vascular pulmonar y fenómenos de
hipertensión pulmonar por estiramiento vascular [10-15].
2.- La
apertura cíclica de unidades alveolares cerradas (atelectrauma) (figura
3). Este suceso va a inducir fundamentalmente la aparición de fenómenos
inflamatorios consistentes en: activación leucocitaria, activación de los
macrófagos alveolares, liberación de mediadores inflamatorios, fenómenos
de apoptosis de las células epiteliales pulmonares, inactivación del
surfactante pulmonar y traslocación de mediadores inflamatorios a la
circulación [16-23]. Muy recientemente Imai y col. [24] han demostrado en
un modelo experimental de LPA en conejos, que el empleo de una estrategia ventilatoria lesiva para el pulmón es capaz de inducir fenómenos de
apoptosis celular en órganos a distancia como son células renales y
células de las criptas intestinales.
|
Figura 3: TAC torácico: colapso de
las zonas dependientes del pulmón
|
| |
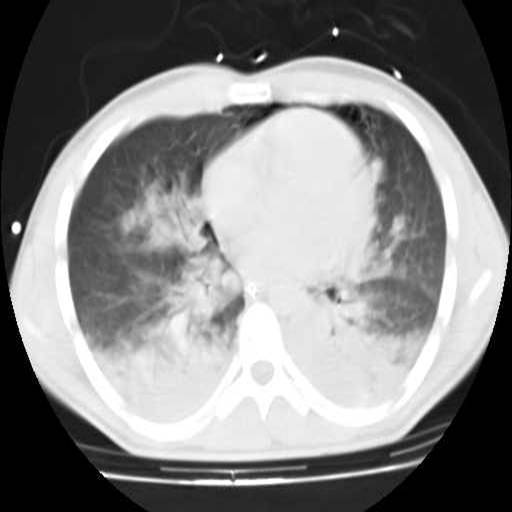 |
|
|
|
3. Estrategias
ventilatorias protectoras del pulmón |
A la luz de este mecanismo lesional asociado por la propia ventilación mecánica, se
han planteado dos nuevas estrategias terapéuticas en el manejo del SDRA,
consistentes en el empleo de agentes moduladores de la respuesta inmune y
el empleo de estrategias ventilatorias denominadas protectoras del pulmón,
encaminadas a disminuir los efectos nocivos de la propia ventilación
mecánica sobre el pulmón y sobre la respuesta inflamatoria sistémica
[25-31] (figura 4).
|
Figura 4: Esquema del funcionamiento
teórico de las estrategias ventilatorias protectoras del pulmón
|
| |
|
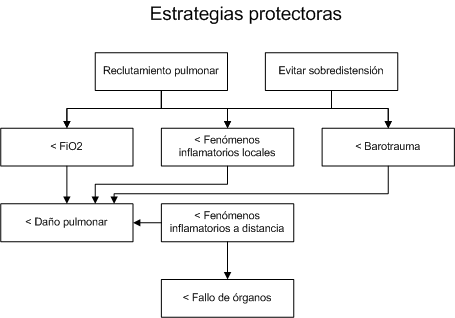
|
|
|
El objetivo
de estas estrategias ventilatorias sería disminuir la lesión pulmonar
inducida por el ventilador y disminuir la respuesta inflamatoria sistémica
asociada a este daño pulmonar, al tiempo que se produce una disminución del
posible efecto tóxico derivado del empleo de una FiO2 elevada y una
disminución también en la incidencia de barotrauma. Se han diseñado varios
tipos de estrategias protectoras, entre las que se incluyen la ventilación
líquida [32-34], la ventilación de alta frecuencia [35, 36] y la
extracción extracorpórea de CO2 [37]; sin embargo, éstas por el
momento no son aplicables (independientemente de la bondad o no de sus
resultados) en la práctica clínica habitual, al menos en la mayor parte de
la Unidades de Medicina Intensiva. También se ha intentado el uso del
soporte mediante ventilación mecánica no invasora (VMNI), con el fin de
disminuir en estos pacientes las complicaciones asociadas con la
ventilación mecánica convencional; sin embargo, y aunque la VMNI sí ha
demostrado su eficacia en otras formas de insuficiencia respiratoria aguda
como en el caso del edema agudo de pulmón de origen cardiogénico o en el
manejo de la reagudización de pacientes EPOC, en términos de disminuir la
necesidad de intubación, reducción de la tasa de complicaciones y también
de reducción de la mortalidad, por el momento no existe suficiente
evidencia que avale su uso rutinario en pacientes en situación de
insuficiencia respiratoria aguda hipoxémica en pacientes con LPA o SDRA
[38]. Sí se puede recomendar que se realice un intento de soporte ventilatorio con mascarilla en unidades entrenadas y con estrecha
vigilancia de signos precoces de fracaso respiratorio que indiquen la
necesidad de intubación [39].
En la
práctica clínica habitual, las técnicas ventilatorias descritas son:
1.-
Limitación de la presión alveolar y/o volumen corriente e hipercapnia
permisiva
El primer
método ventilatorio planteado en este sentido en los pacientes con SDRA
fue la reducción de la presión alveolar (Pa), aún a costa de inducir un
cierto grado de acidosis respiratoria. En la conferencia de consenso de
ventilación mecánica del American College of Chest Physicians (ACCP) de
1993 [40], se recomienda que la Pa generada por la ventilación mecánica no
supere los 35 cm de H2O, lo que en pacientes con SDRA de baja
distensibilidad, podría suponer el empleo de un volumen corriente de
aproximadamente 5 ml/kg, aún a pesar de la retención de carbónico y el
consiguiente descenso del pH que esto supone. Esta recomendación se
realizó en su momento, sin que hubiera ningún ensayo clínico aleatorizado
con suficiente número de pacientes que avalara esta recomendación.
En el
momento actual sin embargo se han publicado 5 ensayos clínicos
aleatorizados de excelente calidad metodológica [41-45] y dos
meta-análisis [46, 47] que incluyen estos cinco ensayos clínicos que han
tenido resultados que aunque en principio parecen contradictorios,
contribuyen a aclarar el modo en que se debe ventilar a los pacientes con LPA.
Únicamente
dos de estos ensayos clínicos (Amato y col. [41] y el estudio del ARDS
network [45]) encuentran una reducción significativa de la mortalidad
asociada al empleo de un bajo volumen corriente en pacientes con SDRA. En
el caso del estudio de Amato y col. esta reducción del volumen corriente se
asocia también con lo que se denomina una estrategia de ventilación a
pulmón abierto caracterizada por el empleo de niveles altos de PEEP,
métodos ventilatorios controlados por presión y empleo de maniobras de
reclutamiento pulmonar. En los otros tres ensayos clínicos, Brower y col.
[44], Stewart y col. [42] y Brochard y col. [43], no se encuentra esta
reducción de la mortalidad, de modo que incluso se aprecia una tendencia
(no significativa) a presentar mayor mortalidad en el grupo de pacientes
que son ventilados mediante una reducción predeterminada del volumen
corriente.
Cuando se
aplican las técnicas de meta-análisis a estos cinco ensayos clínicos, se
objetiva que analizados en conjunto y tomando como objetivo principal la
mortalidad al final del seguimiento de los pacientes, hay una reducción
significativa del riesgo en aquellos pacientes que ha sido ventilados con
limitación predeterminada del volumen corriente (RR 0,85; IC 95%: 0,74-0,98) [46]. Sin embargo, el resultado del meta-análisis esta fuertemente
influenciado por los resultados del estudio del ARDS network, dado que el
volumen de pacientes incluido en el mismo prácticamente duplica al número
de pacientes incluidos en el resto de los estudios.
Se debe
resaltar como los resultados obtenidos por el estudio del ARDS network son
similares, independientemente de que el factor de riesgo para el
desarrollo del SDRA sea o no sepsis, y también de que el SDRA sea de
origen pulmonar o extrapulmonar [48].
Una
explicación plausible para explicar esta discrepancia en los resultados en
los diferentes ensayos clínicos es el diferente comportamiento de los
grupo control (estrategia ventilatoria convencional) de los mismos y el
diferente nivel de Pa alcanzada en los diferentes estudios [47]. Todos los
pacientes que fueron asignados aleatoriamente al denominado brazo
protector (bajo volumen corriente), recibieron durante el período de
estudio y tras la aleatorización un volumen corriente inferior a 8 ml/kg
de peso corporal ideal o calculado y en los cinco estudios, la Pa media
durante el período de estudio fue inferior a los 30 cm de H2O.
Sin embargo, el comportamiento de los pacientes que fueron asignados aleatoriamente al brazo control (volumen corriente normal), fue dispar. En
los tres estudios en los que no se ha conseguido demostrar una reducción
de la mortalidad asociada al empleo de un bajo volumen corriente, se
empleó un volumen corriente en el brazo control de 10 ml/kg, mientras en
los dos estudios en los que el bajo volumen corriente si demostró una
reducción significativa de la mortalidad, el volumen empleado subió a 12
ml/kg. Esta diferencia en el volumen corriente empleado en los grupos
control también se tradujo en una diferencia significativa en la Pa media
que recibieron los pacientes durante el estudio, de modo que tanto en el
estudio de Amato como en el estudio del ARDS network la Pa fue superior a
35 cm de H2O, mientras que en los tres estudios restantes la Pa
fue siempre inferior a los 35 cm de H2O y incluso en el estudio
de Stewart esta Pa fue inferior a los 30 cm de H2O.
En su
conjunto, los ensayos clínicos y los meta-análisis referidos concluyen que
en pacientes con LPA o SDRA el empleo de un “excesivo” volumen corriente
superior a 10-12 ml/kg se asocia con un efecto lesional que da lugar a un
incremento en el riesgo de muerte de estos pacientes. Sin embargo, cuando se
consigue mantener un nivel de Pa inferior a 35 cm de H2O, no se
ha demostrado un efecto beneficioso por el empleo de un “muy bajo” volumen
corriente.
Desde un
punto de vista fisiológico es lógico pensar que la mera reducción del
volumen corriente a un valor predeterminado, independientemente y sin
tener en cuenta la presión producida en la vía aérea, no resulte en una
reducción significativa del daño pulmonar y sí de lugar a un aumento en la
probabilidad de complicaciones. Además del posible aumento en la
necesidad de sedación y relajación muscular, necesario por la difícil
adaptación de los pacientes a este tipo de soporte ventilatorio con bajo
volumen corriente, también es necesario un aumento muy significativo de la
frecuencia respiratoria, que conduce a la denominada “fatiga de tejido” y a
una mayor dificultad para mantener la apertura del pulmón durante todo el
ciclo respiratorio. Ambos mecanismos, la fatiga de tejido y el mayor
colapso del tejido pulmonar, potencian la LPA inducida por la ventilación
mecánica.
Sin embargo
se debe reconocer el importante avance que supone el concepto de la
limitación del volumen corriente en pacientes con SDRA, independientemente
del valor de PaCO2 y el gran trabajo realizado por los
investigadores del ARDS network; así, en las guías publicadas más
recientemente acerca del manejo de los pacientes con sepsis y SDRA, se
hace mención a que la forma óptima de ventilación de estos pacientes es la
estrategia ventilatoria basada en dicho protocolo [49].
2.- Ventilación a
pulmón abierto y empleo de maniobras de reclutamiento pulmonar
Los
estudios realizados mediante TAC torácico en pacientes con SDRA han
demostrado un defecto de aireación y un exceso de tejido pulmonar, que
aunque diseminado por todo el parénquima, se observa predominantemente en
los lóbulos superiores, mientras que en los inferiores y en las zonas
posteriores se produce una pérdida masiva de aireación en relación con la
aparición de atelectasias por compresión [50, 51] (figura 5).
|
Figura 5: Sistema informatizado de
medición objetiva de las consolidaciones pulmonares
|
| |
|
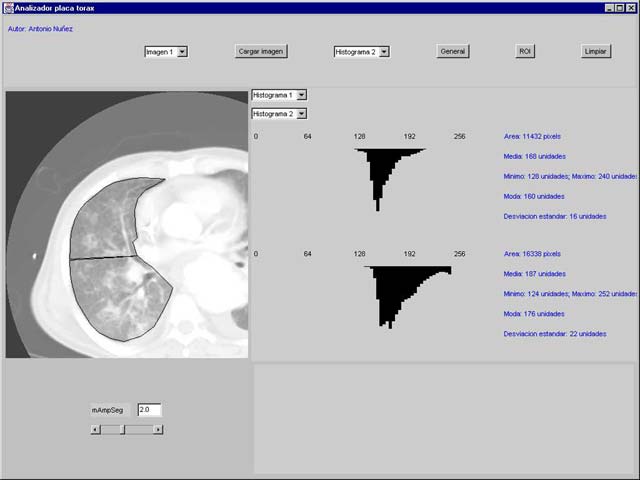 |
|
|
Estas
diferencias morfológicas en la distribución de gas se manifiestan
radiográficamente por la aparición de zonas hiperatenuadas que pueden ser
lobares, difusas o parcheadas [52]. Recientemente se ha demostrado en
estudios experimentales como el empleo de PEEP tiene un efecto protector
sobre la aparición del daño pulmonar inducido por la ventilación mecánica.
En base a estas observaciones experimentales, se ha recomendado emplear en
estos pacientes un nivel de PEEP basado en el comportamiento del pulmón de
acuerdo con los hallazgos de la curva de Presión-Volumen (P/V). Varios
estudios en humanos empleando la TAC torácica han documentado un
incremento en el reclutamiento de estas unidades pulmonares colapsadas con
el empleo de PEEP por encima del punto de inflexión inferior de la curva
de P/V.
Basándose
en estos hallazgos, Rainieri y col. [53] compararon los efectos del empleo
de un nivel de PEEP basado en los niveles de oxigenación y de un nivel de
PEEP basado en el punto de inflexión inferior de la curva de P/V, sobre
los niveles de citoquinas en el BAL de los pacientes con SDRA, objetivando
como el empleo de estos niveles superiores de PEEP puede reducir los
fenómenos de inflamación pulmonar y también disminuir los fenómenos
inflamatorios sistémicos, ya que en el “grupo protegido” se produce una
disminución significativa en los niveles de interleuquinas también a nivel
plasmático.
Este método
ha sido evaluado en el estudio de Amato y col [41], en el que en el grupo
tratamiento, los pacientes fueron mantenidos con un volumen circulante
inferior a 6 ml/kg de peso, pero empleando un nivel de PEEP 2 cm de H2O
por encima del punto de inflexión inferior de la curva de P-V de cada
paciente. El resultado fundamental de este estudio es que esta estrategia
de ventilación da lugar, en los dos objetivos fundamentales del estudio, a
una disminución significativa de la mortalidad y de la incidencia de
barotrauma en el grupo de pacientes ventilados con el método de
ventilación a pulmón abierto, frente a una estrategia convencional de
ventilación. Como ya he comentado, el problema del estudio es que sus
resultados son de difícil interpretación, dado que el grupo control fue
ventilado con volúmenes corrientes de 12 ml/kg y con una presión alveolar
media durante el estudio superior a los 30-35 cm de H2O.
El empleo
de un nivel de PEEP por encima del punto de inflexión inferior, puede no
asegurar la apertura pulmonar completa (figura 6). Así, Meyer y col. [54]
han demostrado como el punto de “derecruitment” ocurre con niveles de
presión superiores al punto inferior de inflexión de la curva P/V.
Empleando nuevamente el TAC, se ha sugerido que niveles de PEEP incluso
de 20 cm de H2O no aseguran el reclutamiento completo del
pulmón. En estudios en animales se ha descrito, por ejemplo, que se
requieren variaciones de presión de 40 cm de H2O con presiones
pico de 55, para abrir unidades pulmonares previamente cerradas [55]. Una
vez que estas unidades han sido abiertas, se estabilizan a una menor
presión. En humanos, Gattinoni y col. [56] mostraron que una presión de 46 cm de H2O producía reclutamiento en pacientes con SDRA.
|
Figura 6: Representación
tridimensional del TAC torácico de dos pacientes: 1 en ventilación
espontánea y 2 paciente con SDRA ventilado con una estrategia de
ventilación protectora del pulmón (PCV 30 PEEP 15 cmH2O)
|
|
|
|
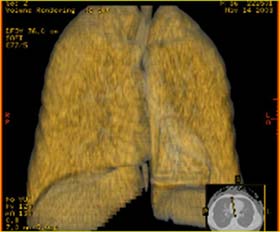 |
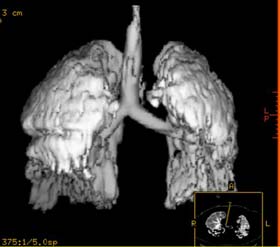 |
|
|
Por este
motivo se han introducido en la clínica las denominadas maniobras de
reclutamiento pulmonar [57-59], consistentes fundamentalmente en mantener
presiones transpulmonares elevadas durante un periodo corto de tiempo, con
el fin de conseguir abrir todas las zonas colapsadas del pulmón con LPA
(figura 7). Estas técnicas se han descrito en algún caso individual, sin
embargo por el momento no se ha demostrado un efecto mantenido sobre las
características mecánicas y morfológicas del pulmón, siendo posiblemente
su efecto sobre la oxigenación mayor en aquellos pacientes que son
ventilados con una estrategia de bajo volumen corriente o en fases
precoces del SDRA en las que se emplea un bajo nivel de PEEP [28].
|
Figura 7: Realización práctica de una
maniobra de reclutamiento pulmonar
|
|
|
|
 |
|
|
En el brazo
de tratamiento del estudio de Amato y col. [41] se emplearon maniobras de
reclutamiento pulmonar consistentes en el empleo durante 2 minutos de un
nivel de PEEP progresivamente mayor entre 20 y 40 cm de H2O con
una presión inspiratoria de 20 cm de H2O sobre el nivel de PEEP.
3.-
Empleo de métodos ventilatorios controlados por presión
La
descripción de los nuevos conceptos de mecánica pulmonar en pacientes con
SDRA ha hecho renacer nuevamente el interés por los métodos ventilatorios
controlados por presión (PCV, BiPAP y PSV), por dos motivos fundamentales,
el empleo del flujo decelerado y una mayor facilidad para asegurar el
límite de la presión pico y de la presión alveolar evitando episodios
inadvertidos de hiperpresión. Sin embargo y a pesar de estas ventajas
teóricas, encontramos una baja tasa de empleo de estos métodos incluso en
los pacientes con el diagnóstico de SDRA [60-62].
El "Spanish
Lung Failure Collaborative Group" [63] publicó un ensayo clínico que
incluyó a 79 pacientes que cumplían los criterios de diagnóstico de SDRA,
que fueron aleatorizados en dos grupos, ambos con la misma estrategia
ventilatoria, pero en un grupo se empleó PCV y en el otro grupo
ventilación controlada por volumen sin límite de presión pico
preestablecido. La mortalidad en el grupo PCV fue del 51%, frente a una
mortalidad en el grupo de ventilación controlada por volumen del 78% (RR
0,65;
IC 95%: 0,46-0,96). Sin embargo los resultados de este estudio no
fueron concluyentes, porque cuando se ajustó la mortalidad a otras
variables, tales como la disfunción orgánica y fundamentalmente la
incidencia de fracaso renal tras la aleatorización, el modo de ventilación
no se asoció con la mortalidad.
Recientemente, Prella y col. [64], por primera vez en un diseño
experimental y midiendo mediante TAC el grado de aireación pulmonar, demuestran uno de los mecanismos por los que puede existir una ventaja en
el empleo de la PCV o del flujo decelerado sobre la ventilación con flujo
constante, que consiste en una mejor distribución de gas en el pulmón,
mediada por un discreto efecto de reclutamiento de zonas pulmonares
dañadas, pero sobre todo por evitar fenómenos de sobredistensión en zonas
apicales pulmonares, sin que se produzca ningún cambio en la presión
alveolar, ni en el intercambio gaseoso. Estos fenómenos sin duda pueden
contribuir al daño pulmonar inducido por la ventilación mecánica.
4.-Ventilación en decúbito prono
Una
estrategia ventilatoria alternativa, capaz de mejorar la oxigenación en
los pacientes con SDRA [65, 66] es la ventilación en posición de decúbito
prono (DP). Los mecanismos por los que se produce esta mejora de la
oxigenación son complejos, pero fundamentalmente están en relación con una
disminución del gradiente gravitacional de presión pleural [67], con una
disminución del efecto del peso del corazón y mediastino sobre la parte
dependiente del pulmón [68], con cambios que permiten una distribución más
homogénea de la relación ventilación-perfusión [67] y con cambios en el
reclutamiento alveolar, de modo que en esta posición es menor la presión
precisa en la vía aérea para mantener la apertura pulmonar [69].
Los
diferentes estudios clínicos realizados reflejan un aumento significativo
de la oxigenación en posición de DP en pacientes con SDRA, sin que se
produzcan efectos deletéreos sobre la mecánica pulmonar o la situación
hemodinámica [68, 70-74].
Sin
embargo, a pesar de la mejoría en la oxigenación y su posible efecto como
estrategia ventilatoria protectora del pulmón, no han podido demostrarse
cambios en la mortalidad asociados al empleo de la posición de DP [75,
76], por lo que no se puede hacer una recomendación generalizada sobre su
uso. Gattinoni y col. incluyeron a 304 pacientes con LPA o SDRA, de los que
152 recibieron tratamiento convencional y 152 ventilación en DP durante 6
horas diarias en un período inferior a 10 días tras la aleatorización. No
hubo diferencias en la mortalidad entre los dos grupos (RR 0,84; IC95%: 0,56-1,27), aunque los pacientes en DP tuvieron una mejoría
significativa en la oxigenación.
5.-
Métodos de ventilación alternativos
Existen
algunos modos de soporte ventilatorio que en el momento actual y debido a
una combinación de factores, como son su complejidad técnica, la necesidad
de empleo de tecnología específica, en general de alto precio, y no
disponible en la mayoría de los centros hospitalarios, y la ausencia de
ensayos clínicos que hayan demostrado una clara ventaja en su uso con
respecto a la ventilación mecánica convencional. Estos métodos ventilatorios se emplean en algunos centros hospitalarios fundamentalmente
como medida de rescate en casos con una mala evolución clínica con el
tratamiento convencional. Los métodos quizás más conocidos son el ECMO
(extracción extracorporea de CO2) [77, 78] y la insuflación
traqueal de gas [79, 80].
La
ventilación de alta frecuencia se basa en el empleo de volúmenes corrientes
mínimos que dan lugar a excursiones muy pequeñas de la presión alveolar,
con frecuencias respiratorias muy elevadas, mientras que se mantiene el
pulmón abierto con niveles elevados de PEEP. Esta técnica tiene una clara
base fisiopatológica como método ventilatorio protector del pulmón, sin
embargo hasta el momento sus resultado son muy dispares, claramente
mejores en el caso del SDRA en neonatos y además tiene una especial
dificultad, al igual que todos estos métodos alternativos, que supone la
necesidad de equipos especiales, que en general tienen un coste muy
elevado [81-85].
La
ventilación líquida parcial se basa en el empleo de agentes líquidos
biológicamente inertes con alta solubilidad para el oxígeno y dióxido de
carbono, y que no producen reacciones titulares al contacto. El agente más
usado es el perflubron, que tiene el potencial para mantener abiertas las
zonas pulmonares previamente colapsadas y deficientes en surfactante por
dos mecanismos: reducción de la tensión superficial en la interfase y por
la propia distensión física por la introducción en el espacio alveolar de
líquido no compresible [34, 86-88].
|
4. Desconexión
de la ventilación mecánica |
En ninguno
de los ensayos clínicos aletorizados realizados para valorar la eficacia
de los diferentes métodos de desconexión de la ventilación mecánica se ha
demostrado un comportamiento diferente de los pacientes con SDRA [89-95].
No se ha objetivado, una vez que estos pacientes han alcanzado una
situación clínica que permita plantearse su desconexión, ni un mayor
tiempo a la extubación, ni una mayor tasa de fracaso en la misma. Por
tanto el proceso de desconexión debe ajustarse a las pautas habituales.
Frecuentemente en los pacientes con SDRA se presenta la polineuropatía-miopatía
del paciente crítico, que asociada con la fibrosis pulmonar residual
condiciona en ocasiones la necesidad de un soporte ventilatorio
prolongado. Por el momento no se ha resuelto la controversia de si en
estos pacientes, cuando precisan soporte ventilatorio prolongado o
manifiestan dificultades para la desconexión, la traqueostomía acorta su
tiempo de ventilación mecánica sin empeorar su pronóstico a largo plazo
[96, 97].
Como
conclusión podemos establecer que el manejo de los parámetros
ventilatorios de los pacientes con LPA o SDRA debe ser individualizado en
función de sus datos de mecánica pulmonar. Una buena aproximación clínica
se obtiene de la observación de la curva de Presión-Volumen o del análisis
de las curvas dinámicas de presión. Como principios fundamentales del manejo
podemos tener en cuenta las siguientes líneas básicas:
-
Evitar la
tensión transestructural excesiva limitando la presión transpulmonar.
-
Evitar el
empleo de Pa superior a 30 cm de H2O.
-
Empleo de
un volumen corriente inferior a 10 ml/kg de peso ideal
-
Evitar el
colapso pulmonar, mediante el empleo de niveles adecuados de PEEP,
maniobras de reclutamiento pulmonar o posición de decúbito prono.
-
Hay un
posible efecto beneficioso asociado al empleo de los métodos de
ventilación mecánica controlados por presión.
-
Frutos-Vivar F, Nin N,
Esteban A. Epidemiology of acute lung injury and acute respiratory
distress syndrome. Curr.Opin.Crit Care 2004;10:1-6.
-
Doyle RL, Szaflarski N,
Modin GW, Wiener-Kronish JP, Matthay MA. Identification of patients with
acute lung injury. Predictors of mortality. Am.J.Respir.Crit Care
Med. 1995;152:1818-24.
-
Monchi M, Bellenfant F,
Cariou A, Joly LM, Thebert D, Laurent I et al. Early predictive
factors of survival in the acute respiratory distress syndrome. A
multivariate analysis. Am.J.Respir.Crit Care Med.
1998;158:1076-81.
-
Hudson LD, Milberg JA,
Anardi D, Maunder RJ. Clinical risks for
development of the acute respiratory distress syndrome.
Am.J.Respir.Crit Care Med. 1995;151:293-301.
-
Parker J, Hernández L,
Peevy K. Mechanisms of ventilator-induced lung injury. Crit Care Med
1993;21:131-43.
-
Bernard G, Artigas A,
Brigham K, et al. The American-Eureopean consensus conference on ARDS.
Definitions, mechanisms, relevant outcomes and clinical trial
coordination. Am J Respir Crit Care Med 1994;818-24.
-
Katzenstein AL, Bloor CM,
Leibow AA. Diffuse alveolar damage. the role
of oxygen, shock, and related factors. A review. Am.J.Pathol.
1976;85:209-28.
-
Marini J,.Gattinoni L.
Ventilatory management of acute respiratory distress syndrome: A
consensus of two. Crit Care Med 2004;32:250-5.
-
Ochs M, Nyengaard J, Jung A,
Knudsen L, Voigt M, Wahlers T et al.
The Number of Alveoli in the Human Lung. Am J Respir Crit Care Med
2004;169:120-4.
-
Dreyfuss D,.Saumon G.
[Experimental changes in the alveolo-capillary barrier induced by
artificial ventilation]. Schweiz.Med.Wochenschr. 1997;127:1023-9.
-
Dreyfuss D,.Saumon G.
[Deleterious effects of mechanical ventilation on the lower lung].
Rev.Mal Respir. 1995;12:551-7.
-
Dreyfuss D, Soler P,
Basset G. High inflation pressure pulmonary edema. Respective effects of
high airway pressure, high tidal volume, and positive end-expiratory
pressure. Am J Respir Crit Care Med 1988;1159-64.
-
Dreyfuss D, Soler P,
Saumon G. Mechanical ventilation induced pulmonary edema. Interaction
with previous lung alterations. Crit Care Med 1995;151:1568-75.
-
Kolobow T, Moretti MP,
Fumagalli R. Severe impairment in lung function induced by high peak
airway pressure during mechanical ventilation. An experimental study.
Am Rev Respir Dis 1987;135:312.
-
Colmenero R, Fernández
R., Fernández MA, Rivera R, Vazquez. PEEP and low tidal volume
ventilation reduce lung water in porcine pulmonary edema. Am J Respir
Crit Care Med 1997;155:964-70.
-
Goodman RB, Strieter RM,
Martin DP, Steinberg KP, Milberg JA, Maunder RJ et al.
Inflammatory cytokines in patients with persistence of the acute
respiratory distress syndrome. Am.J.Respir.Crit Care Med.
1996;154:602-11.
-
Chollet S, Jourdain B,
Gilbert C, Elbim C, Chastre J, Gourgerot MA. Interactions between
neutrophils and cytokines in blood and alveolar spaces during ARDS.
Am J Respir Crit Care Med 1996;153:594-601.
-
Matuschak GM. Liver-lung
interactions in criticall illnes. New Horiz. 1994;2:488-504.
-
Tremblay L, Valenza F,
Ribero P, Li J, Slutsky AS. Injurious
ventilatory strategies increase cytokines and c-fosm-RNA expression in a
isolated rat lung model. J Clin Invest 1997;99:944-52.
-
Broccard AF, Hatchkiss
JR, Kuwayama N. Consequences of vascular flow on lung injury induced by
mechanical ventilation. Am J Respir Crit Care Med
1998;157:1935-52.
-
Broccard AF, Vannay C,
Feihl F, Schaller MD. Impact of low pulmonary vascular pressure on
ventilator-induced lung injury. Crit Care Med 2002;30:2183-90.
-
Murphy NC, Tremblay L,
Engelberts JG, Slutsky AS, Romaschin A, Kavanagh BP. Adverse ventilatory
strategy causes pulmonary-to-systemic translocation of endotoxin. Am
J Respir Crit Care Med 2000;162:27-33.
-
Verbrugge SJ and Sorm V.
Lung overinflation without positive end expiratory pressure promotes
bacteremia after experimental klebsiella pneumoniae inoculation.
Intensive Care Med 1998(24), 172A.
-
Imai Y, Parodo J,
Kajikawa O, De Perrot M, Fischer S, Edwards V et al. Injurious
mechanical ventilation and end-organ epithelial cell apoptosis and organ
dysfunction in an experimental model of acute respiratory distress
syndrome. JAMA 2003;289:2104-12.
-
Brower RG,.Rubenfeld GD.
Lung-protective ventilation strategies in acute lung injury. Crit
Care Med 2003;31:S312-S316.
-
Whitehead T,.Slutsky AS.
The pulmonary physician in critical care: Ventilator induced lung
injury. Thorax 2002;57:635-42.
-
Ware LB,.Matthay MA. The
acute respiratory distress syndrome. N Engl J Med
2000;342:1334-49.
-
Cordingley JJ,.Keogh BF.
The pulmonary physician in critical care. 8: Ventilatory management of
ALI/ARDS. Thorax 2002;57:729-34.
-
Rouby JJ, Lu Q, Goldstein
I. Selecting the right level of positive end-expiratory pressure in
patients with acute respiratory distress syndrome. Am J Respir Crit
Care Med 2002;165:1182-6.
-
Hubmayr RD. Perspective
on lung injury and recruitment: a skeptical look at the opening and
collapse story. Am J Respir Crit Care Med 2002;165:1647-53.
-
Gordo F, Algora A, Temprano S, Ruiz de Luna
R, Núñez R. Lesión pulmonar inducida por la ventilación mecánica: Empleo
de estrategias ventilatorias protectoras del pulmón. Revista Española
de Medicina Intensiva Online 2001;1.
-
Bateman ST, Doctor A,
Price B, Murphy MA, Thompson JE, Zurakowski D et al. Optimizing
intrapulmonary perfluorocarbon distribution: fluoroscopic comparison of
mode of ventilation and body position. Crit Care Med.
2001;29:601-8.
-
Greenspan JS, Wolfson MR,
Shaffer TH. Liquid ventilation: clinical
experiences. Biomed.Instrum.Technol. 1999;33:253-9.
-
Kacmarek RM. Liquid
ventilation. Respir Care Clin N Am 2002;8:187-209.
-
Derdak S, Mehta S,
Stewart TE, Smith T, Rogers M, Buchman TG et al. High-frequency
oscillatory ventilation for acute respiratory distress syndrome in
adults: a randomized, controlled trial.
Am.J.Respir.Crit Care Med. 2002;166:801-8.
-
Derdak S. High-frequency
oscillatory ventilation for acute respiratory distress syndrome in adult
patients. Crit Care Med 2003;31:S317-S323.
-
Frenckner B, Palmer P,
Linden V. Extracorporeal respiratory support and minimally invasive
ventilation in severe ARDS. Minerva Anestesiol. 2002;68:381-6.
-
Mehta S,.Hill N.
Noninvasive ventilation. Am J Respir Crit Care Med
2001;163:540-77.
-
International Consensus
Conference in Intensive Care Medicine: Noninvasive positive pressure
ventilation in Acute Respiratory Failure. Am J Respir Crit Care Med
2001;283-91.
-
ACCP consensus
conference. Mechanical ventilation. Chest 1993;104:1833-59.
-
Amato MB, Barbas CS,
Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G et al.
Effect of a protective-ventilation strategy on mortality in the acute
respiratory distress syndrome. N.Engl.J.Med. 1998;338:347-54.
-
Stewart TE, Meade MO,
Cook DJ, Granton JT, Hodder RV, Lapinsky SE et al. Evaluation of
a ventilation strategy to prevent barotrauma in patients at high risk
for acute respiratory distress syndrome. Pressure- and Volume-Limited
Ventilation Strategy Group. N.Engl.J.Med. 1998;338:355-61.
-
Brochard L, Roudot-Thoraval
F, Roupie E, Delclaux C, Chastre J, Fernandez-Mondejar E et al. Tidal volume reduction for prevention of
ventilator-induced lung injury in acute respiratory distress syndrome.
The Multicenter Trail Group on Tidal Volume reduction in ARDS.
Am.J.Respir.Crit Care Med. 1998;158:1831-8.
-
Brower RG, Shanholtz CB,
Fessler HE, Shade DM, White P, Jr., Wiener CM et al. Prospective,
randomized, controlled clinical trial comparing traditional versus
reduced tidal volume ventilation in acute respiratory distress syndrome
patients. Crit Care Med. 1999;27:1492-8.
-
Ventilation with lower
tidal volumes as compared with traditional tidal volumes for acute lung
injury and the acute respiratory distress syndrome. The Acute
Respiratory Distress Syndrome Network. N.Engl.J.Med.
2000;342:1301-8.
-
Petrucci N. Tidal volumes
in ARDS and meta-analysis. Am J Respir Crit Care Med
2003;167:935-6.
-
Eichacker P,
Gerstenberger E, Banks S, Cui X, Natanson C. Meta-analysis of acute lung
injury and Acute Respiratory Distress Syndrome Trials testing low tidal
volumes. Am J Respir Crit Care Med 2002;166:1510-4.
-
Eisner MD, Thompson T,
Hudson LD, Luce JM, Hayden D, Schoenfeld D et al. Efficacy of low
tidal volume ventilation in patients with different clinical risk
factors for acute lung injury and the acute respiratory distress
syndrome. Am.J.Respir.Crit Care Med. 2001;164:231-6.
-
Dellinger RP, Carlet J,
Masur H, Gerlach H, Calandra T, Cohen J et al. Surviving sepsis
campaign guidelines for management of severe sepsis and septic shock.
Crit Care Med 2004;32:858-73.
-
Puybasset L, Cluzel P,
Gusman P, Grenier P, Preteux F, Rouby JJ. Regional distribution of gas
and tissue in acute respiratory distress syndrome. I. Consequences for
lung morphology. CT Scan ARDS Study Group. Intensive Care Med.
2000;26:857-69.
-
Puybasset L, Gusman P,
Muller JC, Cluzel P, Coriat P, Rouby JJ. Regional distribution of gas
and tissue in acute respiratory distress syndrome. III. Consequences for
the effects of positive end-expiratory pressure. CT Scan ARDS Study
Group. Adult Respiratory Distress Syndrome. Intensive Care Med.
2000;26:1215-27.
-
Rouby JJ, Puybasset L,
Cluzel P, Richecoeur J, Lu Q, Grenier P. Regional distribution of gas
and tissue in acute respiratory distress syndrome. II. Physiological
correlations and definition of an ARDS Severity Score. CT Scan ARDS
Study Group. Intensive Care Med. 2000;26:1046-56.
-
Ranieri VM, Suter PM,
Tortorella C, De Tullio R, Dayer JM, Brienza A et al. Effect of
mechanical ventilation on inflammatory mediators in patients with acute
respiratory distress syndrome: a randomized controlled trial. JAMA
1999;282:54-61.
-
Meyer E, Barbas C, Grunauer
M, et al. PEEP at P flex can not guarantee a
fully open lung after a high pressure recruiting maneuver in ARDS
patients. Am J Respir Crit Care Med 1998;158:694A.
-
Sjostrand U,
Lichtwarck-Aschoff M, Nielsen JB. Different ventilatory approaches to
keep the lung open. Intensive Care Med 1995;21:1807-14.
-
Gattinoni L, Pelosi P,
Crotti S, Valenza F. Effects of positive end-expiratory pressure on
regional distribution of tidal volume and recruitment in adult
respiratory distress syndrome. Am J Respir Crit Care Med
1995;151:1807-14.
-
Blanch L, Fernandez R,
Lopez-Aguilar J. Recruitment maneuvers in acute lung injury. Respir
Care Clin N Am 2002;8:281-94.
-
Hess DR,.Bigatello LM.
Lung recruitment: the role of recruitment maneuvers. Respir.Care
2002;47:308-17.
-
Jardin F. Recruitment
maneuvers during lung protective ventilation in acute respiratory
distress syndrome. Am J Respir Crit Care Med 2003;167:92.
-
Esteban A, Anzueto A,
Frutos F, Alia I, Brochard L, Stewart TE et al. Characteristics
and outcomes in adult patients receiving mechanical ventilation: a
28-day international study. JAMA 2002;287:345-55.
-
Esteban A, Anzueto A, Alía I, Gordo F, et
al. How is Mechanical Ventilation Employed in the
Intensive Care Unit?. An International Utilization Review. Am J
Respir Crit Care Med 2000;161:1450-8.
-
Frutos F, Alía I, Lorenzo M, García J, Nolla
M, Ibañez J et al. Utilización de la ventilación mecánica en 72
unidades de cuidados intensivos en España. Med Intensiva
2003;27:1-12.
-
Esteban A, Alia I, Gordo F, de Pablo R,
Suarez J, Gonzalez G et al. Prospective
randomized trial comparing pressure-controlled ventilation and
volume-controlled ventilation in ARDS. For the Spanish Lung Failure
Collaborative Group. Chest 2000;117:1690-6.
-
Prella M, Feihl F,
Domenighetti G. Effects of short-term pressure-controlled ventilation on
gas exchange, airway pressures, and gas distribution in patients with
acute lung injury/ARDS: comparison with volume-controlled ventilation. Chest 2002;122:1382-8.
-
Rialp G,.Mancebo J. Prone
positioning in patients with acute respiratory distress syndrome.
Respir Care Clin N Am 2002;8:237-vii.
-
Rialp G. Efectos del decúbito prono en el
síndrome de distrés respiratorio agudo (SDRA). Med Intensiva
2003;27:481-7.
-
Wiener CM, Kirk W, Albert
RK. Prone position reverses gravitational
distribution of perfusion in dog lungs with oleic acid-induced injury. J.Appl.Physiol 1990;68:1386-92.
-
Albert RK, Leasa D,
Sanderson M, Robertson HT, Hlastala MP. The prone position improves
arterial oxygenation and reduces shunt in oleic-acid-induced acute lung
injury. Am.Rev.Respir.Dis.
1987;135:628-33.
-
Pelosi P, Bottino N,
Chiumello D, Caironi P, Panigada M, Gamberoni C et al. Sigh in supine and prone position during acute
respiratory distress syndrome. Am J Respir Crit Care Med
2003;167:521-7.
-
Breiburg AN, Aitken L,
Reaby L, Clancy RL, Pierce JD. Efficacy and safety of prone positioning
for patients with acute respiratory distress syndrome. J.Adv.Nurs.
2000;32:922-9.
-
Borelli M, Lampati L,
Vascotto E, Fumagalli R, Pesenti A. Hemodynamic and gas exchange
response to inhaled nitric oxide and prone positioning in acute
respiratory distress syndrome patients. Crit Care Med.
2000;28:2707-12.
-
Blanch L, Mancebo J, Perez M, Martinez M,
Mas A, Betbese AJ et al. Short-term effects of
prone position in critically ill patients with acute respiratory
distress syndrome. Intensive Care Med. 1997;23:1033-9.
-
Hering R, Wrigge H,
Vorwerk R, Brensing KA, Schroder S, Zinserling J et al. The
effects of prone positioning on intraabdominal pressure and
cardiovascular and renal function in patients with acute lung injury. Anesth.Analg.
2001;92:1226-31.
-
L'Her E, Renault A, Oger E,
Robaux MA, Boles JM. A prospective survey of
early 12-h prone positioning effects in patients with the acute
respiratory distress syndrome. Intensive Care
Med. 2002;28:570-5.
-
Gattinoni L, Tognoni G,
Pesenti A, Taccone P, Mascheroni D, Labarta V et al. Effect of prone positioning on the survival of
patients with acute respiratory failure. N.Engl.J.Med.
2001;345:568-73.
-
Mancebo J, Rialp G,
Fernandez R, Gordo F, Albert RK. Prone vs Supine position in ARDS
patients. Results of a randomized multicenter trial. . Am J Respir Crit
Care Med 2003:180A. Am J Respir Crit Care Med 2003;180A.
-
Wassermann J,.Mazer CD.
ECMO in adults: what is its role? Can.J.Anaesth. 1998;45:1044-8.
-
Macha M, Griffith BP,
Keenan R, Kawai A, Hattler BG, Fabrizio C et al. ECMO support for
adult patients with acute respiratory failure. ASAIO J.
1996;42:M841-M844.
-
Carter C, Adams AB, Stone
M, Bliss P, Hotchkiss JR, Marini JJ. Tracheal gas insufflation during
late exhalation efficiently reduces PaCO(2) in experimental acute lung
injury. Intensive Care Med. 2002;28:504-8.
-
Hoffman LA, Miro AM,
Tasota FJ, Delgado E, Zullo TG, Lutz J et al. Tracheal gas
insufflation. Limits of efficacy in adults with acute respiratory
distress syndrome. Am.J.Respir.Crit Care Med. 2000;162:387-92.
-
Abbasi S, Bhutani VK,
Spitzer AR, Fox WW. Pulmonary mechanics in preterm neonates with
respiratory failure treated with high-frequency oscillatory ventilation
compared with conventional mechanical ventilation. Pediatrics
1991;87:487-93.
-
Andersen FA, Guttormsen
AB, Flaatten HK. High frequency oscillatory ventilation in adult
patients with acute respiratory distress syndrome--a retrospective
study. Acta Anaesthesiol Scand 2002;46:1082-8.
-
Claridge JA, Hostetter RG,
Lowson SM, Young JS. High-frequency oscillatory ventilation can be
effective as rescue therapy for refractory acute lung dysfunction.
Am.Surg. 1999;65:1092-6.
-
Dembinski R, Max M,
Bensberg R, Bickenbach J, Kuhlen R, Rossaint R. High-frequency
oscillatory ventilation in experimental lung injury: effects on gas
exchange. Intensive Care Med. 2002;28:768-74.
-
Ferguson ND,.Stewart TE.
New therapies for adults with acute lung injury. High-frequency
oscillatory ventilation. Crit Care Clin 2002;18:91-106.
-
Deatherage L,.Biddle C.
Liquid ventilation innovations in ventilatory management. AANA.J.
1998;66:161-8.
-
Gauger PG, Pranikoff T,
Schreiner RJ, Moler FW, Hirschl RB. Initial experience with partial
liquid ventilation in pediatric patients with the acute respiratory
distress syndrome. Crit Care Med. 1996;24:16-22.
-
Hirschl RB, Croce M, Gore
D, Wiedemann H, Davis K, Zwischenberger J et al. Prospective,
randomized, controlled pilot study of partial liquid ventilation in
adult acute respiratory distress syndrome. Am.J.Respir.Crit Care Med.
2002;165:781-7.
-
Esteban A, Frutos F,
Tobin MJ, Alia I, Solsona JF, Valverdu I et al. A comparison of
four methods of weaning patients from mechanical ventilation. Spanish
Lung Failure Collaborative Group. N.Engl.J.Med. 1995;332:345-50.
-
Esteban A, Alia I, Tobin
MJ, Gil A, Gordo F, Vallverdu I et al. Effect of spontaneous
breathing trial duration on outcome of attempts to discontinue
mechanical ventilation. Spanish Lung Failure Collaborative Group.
Am.J.Respir.Crit Care Med. 1999;159:512-8.
-
Esteban A, Alia I, Gordo
F, Fernandez R, Solsona JF, Vallverdu I et al. Extubation outcome
after spontaneous breathing trials with T-tube or pressure support
ventilation. The Spanish Lung Failure Collaborative Group.
Am.J.Respir.Crit Care Med. 1997;156:459-65.
-
Brochard L, Rauss A,
Benito S, Conti G, Mancebo J, Rekik N et al. Comparison of three
methods of gradual withdrawal from ventilatory support during weaning
from mechanical ventilation. Am.J.Respir.Crit Care Med.
1994;150:896-903.
-
Babcock HM, Zack JE,
Garrison T, Trovillion E, Kollef MH, Fraser VJ. Ventilator-associated
pneumonia in a multi-hospital system: differences in microbiology by
location. Infect.Control Hosp.Epidemiol. 2003;24:853-8.
-
Kollef MH, Shapiro SD,
Silver P, St John RE, Prentice D, Sauer S et al. A randomized,
controlled trial of protocol-directed versus physician-directed weaning
from mechanical ventilation. Crit Care Med. 1997;25:567-74.
-
Ely EW, Meade MO, Haponik
EF, Kollef MH, Cook DJ, Guyatt GH et al. Mechanical ventilator
weaning protocols driven by nonphysician health-care professionals:
evidence-based clinical practice guidelines. Chest
2001;120:454S-63S.
-
Kollef MH. Tracheostomy
for respiratory failure: we need more answers. Chest
2004;125:7-9.
-
Kollef MH, Ahrens TS,
Shannon W. Clinical predictors and outcomes for patients requiring
tracheostomy in the intensive care unit. Crit Care Med.
1999;27:1714-20.
Federico Gordo Vidal
Fundación
Hospital Alcorcón, Madrid
©REMI,
http://remi.uninet.edu. Julio 2004.
Palabras clave:
Sepsis, Sepsis grave, Lesión pulmonar aguda, Síndrome de distrés
respiratorio agudo, Lesión pulmonar inducida por la ventilación mecánica,
Ventilación protectora.
Busque en REMI con Google:
Envía tu comentario para su
publicación |