|
1. Concepto
y epidemiología |
1.1 Concepto y
generalidades
La sepsis se define como el síndrome de respuesta inflamatoria sistémica
(SRIS) secundario a una infección [1].
En 1991 se intentó llegar a un consenso en las definiciones de infección,
bacteriemia, sepsis y shock séptico [2], que posteriormente fueron revisadas en el año
2001 [3]. La tabla I recoge la adaptación de estas definiciones para la edad pediátrica
[4-7].
|
Tabla I: Definiciones de sepsis en
niños (*)
|
| |
|
Infección: Respuesta inflamatoria a la presencia de microorganismos
en el organismo o a la invasión por estos microorganismos de tejidos
habitualmente estériles. |
|
|
|
|
Bacteriemia: Presencia de bacterias viables en la sangre. |
|
|
|
Síndrome de respuesta inflamatoria sistémica (SRIS): Respuesta del
organismo a diferentes agresiones (quemaduras, traumatismos, infección),
con la presencia de dos o más de los siguientes criterios:
- Temperatura rectal superior a 37,9º C o inferior a 36º C.
- Taquicardia: Frecuencia cardiaca superior a 2 desviaciones estándar
(DS) o mayor del percentil 90
para la edad.
- Taquipnea: Frecuencia respiratoria superior a 2 DS para la edad.
- Leucocitosis superior a 12.000, o leucopenia inferior a 4.000 o más
del 10% de formas inmaduras.
|
|
|
|
|
Sepsis: SRIS secundario a infección (cultivo positivo de alguna
localización o evidencia clínica de infección). |
|
|
|
|
Sepsis grave: Sepsis asociada a disfunción orgánica, manifestando
signos de hipoperfusión o hipotensión, como acidosis láctica, oliguria o
trastorno del nivel de conciencia. |
|
|
|
Shock séptico: Persistencia de hipotensión (presión arterial sistólica
inferior a 2 DS para la edad) con signos clínicos de hipoperfusión a pesar
de la administración de líquidos. |
|
|
|
(*) Adaptadas de referencias 3 y 7 |
|
|
La etiología, manifestaciones clínicas, diagnóstico y algunos aspectos del
tratamiento de la sepsis son diferentes en el niño y en el adulto. Además,
la sepsis neonatal tiene características específicas que justifican un
abordaje diferenciado, y por ello existe otro capítulo específico en este
mismo curso.
1.2
Incidencia
La sepsis es
una de las patologías más importantes en la edad pediátrica, con una
incidencia y mortalidad elevadas [7, 8].
Un 23 % de los niños ingresados en unidades de cuidados intensivos
pediátricos presentan sepsis, un 4 % sepsis grave y un 2 % shock séptico
[9].
Tanto en niños como en adultos la mortalidad aumenta progresivamente desde
el síndrome de respuesta inflamatoria sistémica al shock séptico, variando
según los estudios entre un 5 y un 55 % [6-8, 10].
1.3
Tipos de sepsis
La sepsis en el niño se puede clasificar, según el microorganismo causal, la
localización inicial de la infección o el origen de la misma, comunitario
o nosocomial. El 20 a 50 % de las sepsis en la infancia son de origen
nosocomial [1, 10];
el porcentaje varía según el nivel socieconómico del país y las
características del centro hospitalario. La sepsis supone casi un tercio de las
infecciones nosocomiales en los niños ingresados en unidades de cuidados
intensivos pediátricos [11, 12].
1.4
Factores de riesgo
Los factores de riesgo de sepsis más importantes en la infancia son [6, 7]:
-
La
edad: fuera del periodo neonatal, los lactantes tienen un riesgo más
elevado de padecer sepsis que los niños mayores. Se ha referido que hasta
el 81 % de los niños con sepsis son menores de un año [10]. Además en los lactantes la sepsis es más grave
y de curso más acelerado, debido a que el sistema inmunitario todavía no
está plenamente desarrollado.
-
La disminución de los mecanismos de defensa: los niños con
inmunodeficiencias congénitas o adquiridas (SIDA, esplenectomizados,
transplantados, pacientes oncológicos), o con malnutrición, presentan
mayor riesgo de sepsis, siendo en ellos la sepsis más grave y con mayor
mortalidad [6, 7].
-
La
realización de procedimientos y técnicas invasivas (cirugía de alto
riesgo, sondaje vesical, ventilación mecánica, alimentación parenteral
central, antibioterapia de amplio espectro y sobre todo la canalización de
vías centrales) son los factores de riesgo fundamentales de sepsis de
origen nosocomial [11-14]. El riesgo de sepsis
nosocomial es mayor en los neonatos que en los niños mayores [14].
La sepsis en el niño
puede ser producida por bacterias, hongos, virus y rickettsias, aunque la
etiología más frecuente es la bacteriana. La etiología varía según la edad
y su origen comunitario (tabla II) o
nosocomial (tabla III).
La
etiología de la sepsis de origen comunitario varía según los países. En
los últimos años la vacunación sistemática contra el Haemophilus
influenzae, meningococo y neumococo ha hecho disminuir
significativamente la incidencia de infecciones graves por estos
microorganismos
en niños.
La sepsis meningocócica
es la sepsis más grave en la edad pediátrica. Su incidencia es de
1-3/100.000 en los países industrializados. Más del 90% de la enfermedad a
nivel mundial está causada por tres serogrupos: el A es la causa de las
pandemias cíclicas en países del tercer mundo, mientras que los serogrupos
B y C producen la mayoría de los casos en los países industrializados.
Otros microorganismos frecuentes son Staphyloccocus aureus, Klebsiella pneumoniae,
Pseudomonas aeruginosa, Enterobacter spp., y Escherichia coli
[10].
|
Tabla II: Etiología de la sepsis
comunitaria en niños (*)
|
| |
|
Edad |
Microorganismo |
|
|
|
|
1 a 3 meses |
Haemophilus Influenzae
Streptococcus Pneumoniae
Neisseria meningitidis |
|
|
|
|
Más de 3 meses |
Neisseria meningitidis
Haemophilus Influenzae
Streptococcus Pneumoniae
Escherichia Coli
Salmonella spp.
Staphylococcus aureus
Streptococcus grupo A |
|
|
|
|
(*) Adaptado de referencia 7 |
|
|
La etiología de la sepsis nosocomial depende de la localización
inicial de la infección, la manipulación instrumental, y la ecología
previa del paciente y de la UCI pediátrica [11-14].
La tabla III recoge los gérmenes más frecuentes que producen sepsis en niños
según el foco primario de infección.
|
Tabla III: Etiología de la sepsis
nosocomial en niños según la puerta de entrada
|
| |
|
Foco |
Microorganismo |
|
|
|
|
Catéter |
Staphylococcus aureus
Staphylococcus epidermidis
Enterobacterias
Enterocococos |
|
|
|
|
Líquidos administrados |
Enterobacterias (Klebsiella, Serratia, Citrobacter,
Pseudomonas) |
|
|
|
|
Nutrición parenteral |
Staphylococcus epidermidis
Candida spp.
Staphylococcus aureus
Torulopsis glabrata
Otros (Malassezia furfur) |
|
|
|
|
Respiratorio |
Bacilos Gram negativos (Pseudomonas aeruginosa, Escherichia
coli, Serratia spp., Proteus mirabilis, Klebsiella
pneumoniae)
Cocos Gram positivos [menos frecuentes] (Staphylococcus
aureus, Streptococcus pneumoniae) |
|
|
|
|
Urinario |
Escherichia coli
Klebsiella pneumoniae
Enterobacter spp.
Proteus mirabilis
Pseudomonas aeruginosa
Candida albicans |
|
|
|
|
Peritoneal |
Enterobacterias (Escherichia coli, Klebsiella
spp., Enterobacter spp.) |
|
|
|
|
Cutáneo |
Staphylococcus aureus, Streptococcus grupo
A, Pseudomonas spp., otros bacilos Gram negativos |
|
|
|
|
(*) Adaptado de referencia 7 |
|
|
Las manifestaciones clínicas iniciales de la sepsis en el niño son más
sutiles y menos específicas cuanto menor sea el paciente, e inicialmente
puede ser muy difícil diferenciar entre un niño con una infección vírica
banal y el inicio de una sepsis bacteriana grave. El niño, sobre todo el
lactante, tiene una superficie proporcionalmente mayor que el adulto y
unos mecanismos de control de la temperatura menos desarrollados. La
respuesta térmica del niño ante la infección es exagerada, presentando
frecuentemente fiebre muy elevada o hipotermia. Además, el niño responde
rápidamente con taquicardia, taquipnea y vasoconstricción importante ante
distintos estímulos, pudiendo simular un cuadro clínico de sepsis. Por
ello, muchas situaciones y patologías no infecciosas (irritabilidad,
dolor, insuficiencia cardiaca, intoxicaciones, alteraciones metabólicas,
etc.) se manifiestan inicialmente con un cuadro clínico similar a la
sepsis.
Manifestaciones iniciales: los signos clínicos iniciales generales
de sepsis en el niño más frecuentes son el decaimiento, mal estado
general, coloración pálida-sucia de piel, fiebre o hipotermia, taquipnea,
taquicardia, alteración del estado de conciencia (irritabilidad o letargia).
A veces pueden asociarse vómitos o distensión abdominal [14].
Signos de localización: pueden acompañarse de signos específicos
del foco inicial o de infección focal metastásica.
Signos específicos: En algunas ocasiones existen signos típicos que
orientan al microorganismo causal, como el exantema petequial en el meningococo [15, 16].
Aunque el exantema petequial ya establecido del meningococo es muy
característico, el Haemophilus influenzae y algunas infecciones
víricas pueden presentar un exantema que inicialmente recuerda al
meningococo. En la sepsis por anaerobios pueden aparecen complicaciones
metastásicas, tromboflebitis e ictericia con más frecuencia que en otras
sepsis. La sepsis por Candida puede manifestarse de forma muy
variada generalmente indistinguible de una sepsis bacteriana, aunque el
cuadro más frecuente es una fiebre persistente y deterioro clínico en un
paciente que recibe antibioterapia de amplio espectro [14].
Shock
séptico: el shock séptico en el niño se manifiesta inicialmente por taquicardia, pulsos
débiles, oliguria, palidez y frialdad de la piel o retraso del relleno
capilar. Posteriormente aparece hipotensión con hipoperfusión de órganos
vitales como el sistema nervioso central (agitación, somnolencia o coma), riñón (oligo-anuria) o
pulmón (insuficiencia respiratoria). La mayor diferencia entre el adulto y
el niño es la gran rapidez de progresión de la sepsis, instauración del
shock y desarrollo de fallo multiorgánico que ocurren en el niño. La
rapidez de evolución es en general mayor cuanto menor es el niño.
El diagnóstico precoz de la sepsis es fundamental, ya que cada hora en que
el niño permanece en shock séptico aumenta al doble la mortalidad [17],
y
la rapidez del tratamiento es lo único que ha logrado disminuir de forma
significativa su morbilidad y la mortalidad [17, 18]. Sin embargo, no existe ninguna prueba
diagnóstica complementaria específica, por lo que la sospecha fundamental
debe estar fundamentada en la clínica. El diagnóstico es fácil en
la fase de shock séptico descompensado pero muy complicado en las fases
iniciales. Teniendo en cuenta que los lactantes
tienen mayor riesgo de desarrollar una sepsis fulminante es en éllos en
quienes es más importante realizar un diagnóstico precoz, mediante una
monitorización y vigilancia más continuadas.
Las pruebas complementarias más utilizadas en el diagnóstico de la sepsis
en el niño son:
4.1 Hemograma
-
Leucocitosis: (más de 10.000 leucocitos o más de 500 cayados por mm3. Es un signo muy poco sensible y específico ya que muchos procesos
infecciosos en la infancia causan leucocitosis y las sepsis más
fulminantes presentan leucopenia, que es signo de mal pronóstico [14, 19]. La presencia de granulaciones tóxicas en los leucocitos orienta a
infección bacteriana.
-
Plaquetas: la trombopenia es un signo poco sensible y específico, pero
sirve como indicador de gravedad de la sepsis.
4.2 Estudio de coagulación
-
Estudio de coagulación: se altera de forma
precoz, fundamentalmente en la sepsis meningocócica, desarrollándose una
coagulación intravascular diseminada, que es un marcador de mal
pronóstico [19]. Los tiempos de protrombina y parcial de tromboplastina activado se
alargan, el fibrinógeno puede estar inicialmente normal o aumentado,
pero en los casos terminales disminuye, y se produce un aumento de los
productos de degradación del fibrinógeno y del dímero D.
4.3 Gasometría
En los niños con shock
séptico se produce una acidosis, inicialmente metabólica, con aumento del
lactato secundaria a mala perfusión tisular y posteriormente mixta ya que
se añade hipoventilación. La acidosis y el exceso de bases son
indicadores de mal pronóstico en la sepsis en el niño, fundamentalmente en
la sepsis meningocócica [19].
4.4 Lactato y cociente lactato/piruvato
El
lactato sérico es un marcador sensible pero poco específico de
hipoperfusión tisular. Los niveles de lactato aumentan en los niños con
shock de cualquier etiología, en la hipoxia, hiperglucemia y
administración de adrenalina. A pesar de ello, es un buen marcador
pronóstico en los niños con shock séptico, y su evolución ayuda a valorar
la respuesta al tratamiento [20, 21].
4.5 Pruebas de localización de la
infección
Según el origen de la infección se deben realizar punción lumbar,
radiografía de tórax, ecografía abdominal, etc.
-
Hemocultivos: en un porcentaje muy elevado de los niños con sepsis
el hemocultivo es negativo [10].
En el lactante hay que tener en cuenta que el volumen de sangre necesario
para realizar los hemocultivos puede anemizarle, por lo que es muy
complicado realizar hemocultivos múltiples o seriados. En los niños con
sospecha de sepsis nosocomial y catéteres venosos centrales deben
realizarse hemocultivos cuantitativos pareados periféricos y de vías
centrales, cultivos de la piel del punto de infección y de las conexiones,
y del catéter si éste se retira para orientar el origen de la infección.
-
Otros cultivos: Gram del LCR y cultivo del LCR, aspirado
bronquial, urocultivo, etc.
-
En la sepsis meningocócica, la bacteria también se puede visualizar
en el Gram y cultivar en una biopsia obtenida por raspado de las lesiones
cutáneas, que no se altera por la utilización previa de antibióticos.
4.6 Otras pruebas diagnósticas
Existen
varios métodos diagnósticos que evalúan la respuesta inflamatoria del
huésped. Los más útiles en el diagnóstico de la sepsis en niños son la proteína C reactiva
y la procalcitonina [14].
-
Proteína
C reactiva: no es específica de la sepsis ya que puede aumentar en otros
procesos inflamatorios y en infecciones leves. Aumenta a las 24 horas, más
tarde que otros marcadores como las citoquinas o la procalcitonina, y
permanece elevada varios días incluso cuando la infección ha desaparecido.
Además sus niveles no se relacionan con la gravedad de la infección [14].
-
Procalcitonina: su concentración aumenta mucho en la sepsis en el
niño y los niveles se correlacionan con la gravedad de la respuesta
inflamatoria. Puede ser útil en la diferenciación entre infección
bacteriana y viral. La procalcitonina es más específica, precoz y sensible
que la proteína C reactiva [14, 22, 23].
Se eleva más en los niños con shock séptico que en los que solo presentan
sepsis [24],
y permanece elevada en los pacientes con sepsis y fallo multiorgánico
mientras que desciende en los que presentan sepsis y mejoran con
tratamiento antibiótico [25].
-
Otros marcadores: la eritropoyetina (probablemente debida a la hipoxia tisular) y la
interleukina 6 se elevan en los niños con sepsis y shock séptico [26]. También se encuentran niveles elevados de
metahemoglobina y de nitritos y nitratos en sangre por sobreproducción de
óxido nítrico [27], y de trombomodulina, como expresión de la
disfunción microcirculatoria y lesión endotelial [28]. Los niveles de hormona de crecimiento
están elevados y los del factor de crecimiento 1 similar a insulina
disminuidos, siendo mayor la alteración de los niveles en los niños que
fallecen que en los supervivientes [29].
4.7 Pruebas de función de
órganos vitales
En los niños con sepsis es necesario monitorizar periódicamente la función
de otros órganos vitales que frecuentemente se alteran de forma
secundaria. Por ello, es necesario realizar determinaciones periódicas, al
menos diariamente, de:
-
Bioquímica: electrolitos
(sodio, potasio, calcio total e iónico, fósforo, magnesio),
proteínas totales, albúmina, glucosa.
-
Función renal: creatinina, urea, ácido úrico, aclaramiento de
creatinina, sedimento e iones en orina.
-
Función
hepática: AST, ALT, bilirrubina total y fraccionada.
A pesar de los avances
terapéuticos, la mortalidad del shock séptico sigue siendo muy elevada. En niños el
tratamiento agresivo precoz de la sepsis con una antibioterapia adecuada y
expansión con líquidos y fármacos vasoactivos es el factor más importante
para disminuir la mortalidad [6, 15-17].
El tratamiento de la sepsis se centra en tres aspectos [6, 14, 30, 31]:
- Eliminación del microorganismo con tratamiento antibiótico o antifúngico.
- Tratamiento de las consecuencias de la respuesta inflamatoria.
- Mantenimiento de los órganos y sistemas dañados secundariamente.
5.1
Reanimación inicial en la primera hora (figura
1) [30]
El objetivo del tratamiento inicial de la sepsis es mantener una adecuada
perfusión y oxigenación de los tejidos para evitar el daño tisular y el
desarrollo de fallo multiorgánico [32].
En los niños con shock séptico el tratamiento debe intentar normalizar los
parámetros hemodinámicos, tensión arterial, relleno capilar menor de 2
segundos, temperatura de extremidades, diuresis (mayor de 1 ml/kg/h) y estado
mental [30].
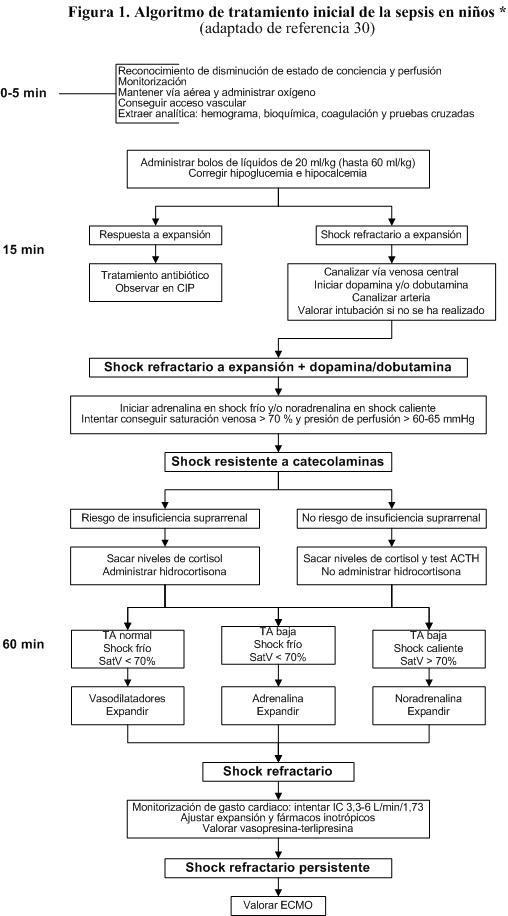
5.1.1. Monitorización inicial
Se debe realizar inicialmente monitorización continua de la frecuencia
cardiaca, frecuencia respiratoria, pulsioximetría TA no invasiva
inicialmente (invasiva si existe shock o la TA no se normaliza tras la
expansión de volumen inicial), diuresis (sonda vesical si existe shock),
estado de conciencia y
temperatura central y periférica.
5.1.2. Vía aérea y ventilación
Iniciar inmediatamente oxigenoterapia en gafas nasales o mascarilla para
mantener saturación superior al 95 % y valorar la necesidad de ventilación mecánica.
Se debe realizar intubación y ventilación mecánica precoz en los niños con
shock séptico, independientemente de la existencia de alteración del
estado de conciencia, insuficiencia respiratoria y los resultados de la
gasometría [6, 30-32]. La sedación para la intubación y la
ventilación mecánica pueden aumentar la hipotensión al producir depresión
miocárdica y aumentar la presión intratorácica con disminución del retorno
venoso. Sin embargo, la ventilación mecánica mejora el shock al disminuir
el trabajo miocárdico y el consumo de oxígeno.
Para la intubación se pueden utilizar fármacos con poco efecto depresor
miocárdico, como el etomidato o la ketamina.
5.1.3. Expansión de volumen
Accesos vasculares
Todos los niños con sepsis, sobre todo si están en
estado de shock, precisan expansión importante con líquidos. Para ello es
necesaria la canalización rápida de una vía venosa de grueso calibre (si
es posible dos), y/o una vía venosa central si existe shock. En los
lactantes en shock puede ser muy difícil la canalización de una vía venosa
periférica. En estos casos puede estar indicada inicialmente, previa
sedación por vía intranasal o rectal, la canalización de una vía intraósea
o una vía venosa central.
Volumen de líquidos
Se debe iniciar la expansión con bolos de líquidos
cristaloides o coloides de 20 ml/kg. La velocidad de expansión dependerá
del estado de shock. Puede ser necesario administrar hasta 60 ml/kg en los
primeros 10 min y hasta 200 ml/kg en la primera hora [6, 30-32].
Si no hay respuesta y la PVC es menor de 10-12 mmHg se realizará nueva
expansión y si la PVC es superior se iniciará la perfusión de fármacos
vasoactivos [32].
Tipo de líquidos (tabla IV)
Hay pocos
estudios que comparen la eficacia de los cristaloides y coloides en el
shock séptico en niños. Se puede iniciar la expansión con cristaloides
(suero salino o Ringer), ya que son accesibles, baratos y con escasos
efectos secundarios. Sin embargo, precisan mayor volumen que los coloides
para conseguir el mismo efecto expansor. El bicarbonato 1/6 M solo
se debe utilizar en shock con acidosis metabólica importante. Los
coloides se pueden utilizar en el shock
que no mejora con cristaloides, pero en muchas unidades de cuidados
intensivos pediátricos los utilizan como expansión inicial en el shock
séptico con hipotensión grave. En algunos estudios se ha utilizado
suero salino hipertónico al 3-6 % o dextrano-70
al 6 % más ClNa al 7,5 % [33, 34]. Los sueros hipertónicos tienen la ventaja
de conseguir igual expansión con menor volumen de líquidos (4 ml/kg) y
podrían mejorar la microcirculación [35].
Sin embargo, todavía hay escasa experiencia en niños [35],
hay que administrarlos por vía central debido a su elevada osmolaridad y
pueden producir hipernatremia e hipercloremia. El plasma fresco
congelado debe quedar reservado para los niños con shock y coagulopatía de
consumo, y el concentrado de hematíes
cuando el hematocrito sea inferior al 30 %.
|
Tabla IV: Líquidos utilizados en el
tratamiento del shock séptico en niños [*]
|
| |
|
Nombre |
Tipo |
Características |
Poder de expansión |
Volumen inicial |
Ventajas |
Efectos secundarios |
|
Suero salino isotónico
(0,9%) |
Cristaloide |
Líquido equilibrado con Na y Cl |
Moderado, corta duración |
20 ml/kg |
Barato, accesible, escasos efectos secundarios |
Aporte excesivo de Na |
|
Ringer lactato |
Cristaloide |
Líquido equilibrado con iones |
Moderado, corta duración |
20 ml/kg |
Barato, accesible, escasos efectos secundarios |
Aporte excesivo de lactato |
|
Suero salino hipertónico
3-7,5% |
Cristaloide |
Líquido con Na y Cl |
Alto |
4 ml/kg |
Barato, accesible, expansión potente con bajo volumen |
Escasa experiencia en niños,
hiperosmolar |
|
Bicarbonato 1/6 M |
Cristaloide |
Bicarbonato y sodio |
Moderado, corta duración |
20 ml/kg |
Barato, accesible, escasos efectos secundarios |
Aporte excesivo de sodio |
|
Dextranos |
Coloide |
Polímero de glucosa con o sin Na y Cl |
Alto, larga duración |
20 ml/kg |
Barato, accesible |
Volumen limitado, reacciones anafilácticas, coagulopatía, insuficiencia
renal |
|
Almidones |
Coloide |
Almidón con Na y Cl |
Alto, larga duración |
20 ml/kg |
Escasos efectos secundarios |
Leve alteración de la coagulación, hiperamilasemia |
|
Gelatinas |
Coloide |
Gelatina |
Alto, larga duración |
20 ml/kg |
Escasos efectos secundarios, volumen sin límite |
Rara reacción anafiláctica |
|
Albúmina |
Coloide |
Proteínas humanas en suero salino |
Alto, larga duración |
20 ml/kg |
Proteínas humanas, de larga duración |
Infección, cara, rara reacción anafiláctica |
|
Plasma fresco congelado |
Coloide |
Plasma humano |
Alto, larga duración |
15 ml/kg |
Aporta factores de coagulación |
Reacción anafiláctica,
infección, caro |
|
[*] Adaptado de referencia 32. Dextranos:
Rheomacrodex®, Macrodex®. Almidones: Elohes®,
Expafusín®. Gelatinas: Gelafundina®, Hemoce®. |
|
|
Fármacos vasoactivos (tabla V)
-
Efecto: mejoran la disfunción miocárdica y el gasto cardiaco.
Redistribuyen el flujo sanguíneo hacia los órganos vitales.
-
Indicaciones: en el shock séptico que no responde a la expansión inicial
con líquidos. En el niño deben utilizarse precozmente.
-
Tipos:
aunque existen muchos estudios que comparan la eficacia de los diferentes
fármacos vasoactivos en el shock no se ha demostrado claramente la
superioridad de ninguno de ellos. El fármaco más utilizado inicialmente en
niños es la dopamina a 5 mcg/kg/min [31, 32], que se aumenta de 5 en 5 mcg/kg/min
hasta 20 mcg/kg/min según la respuesta. Si no mejora se añade dobutamina
(5 -15 mcg/kg/min), adrenalina (0,05-2 mcg/kg/min) y/o noradrenalina
(0,05-2 mcg/kg/min) hasta conseguir una tensión arterial y una perfusión
tisular adecuadas.
|
Tabla V: Fármacos vasoactivos en el
shock séptico en la infancia [72]
|
| |
|
Fármaco |
Acción |
Dosis (mcg/kg/min) |
Presentación |
Efectos secundarios |
|
|
|
|
|
|
|
Dopamina |
<5: inotropo y vasodilatador esplácnico; 5-10: inotropo
>10: inotropo y vasoconstrictor |
5-20 |
1 ml = 20 mg
1 ml = 40 mg |
Taquicardia, hipertensión cefalea, arritmias, necrosis cutánea si
extravasación |
|
|
|
|
|
|
|
Dobutamina |
Inotropo. Vasodilatador y cronotropo leve |
5-20 |
20 ml = 250 mg |
Taquicardia a dosis altas, arritmias |
|
|
|
|
|
|
|
Adrenalina |
Inotropo y vasoconstrictor |
0,05-2 |
1 ml = 1 mg |
Taquicardia, arritmias, hipertensión, hemorragia cerebral |
|
|
|
|
|
|
|
Noradrenalina |
Vasoconstrictor potente |
0,05-2 |
10 ml = 10 mg |
Hipertensión, insuficiencia cardiaca |
|
|
|
|
|
|
|
Milrinona |
Inotropo débil y vasodilatador |
Bolo 50 mcg/kg en 15 min
0,4-0,8 |
1 ml = 1 mg |
Arritmia ventricular, hipotensión con el bolo |
|
|
|
|
|
|
|
Nitroprusiato |
VasodilatadoR |
0,5-1 |
5 ml = 50 mg |
Hipotensión, metahemoglobinemia, cefalea, intoxicación por tiocinanatos y
cianuro |
|
|
|
|
|
|
|
Vasopresina |
Vasoconstrictor |
0,03-0,2 u/kg/h |
1 ml = 20 u |
Isquemia cutánea |
|
|
|
|
|
|
|
Terlipresina |
Vasoconstrictor |
5-10 mcg/kg/h |
1 ml = 1 mg |
Isquemia cutánea |
|
|
5.1.4. Tratamiento antibiótico empírico
Se debe iniciar lo
antes posible, por vía intravenosa y a dosis altas, utilizando inicialmente
antibióticos de amplio espectro. El inicio de la antibioterapia no debe
retrasar nunca la reanimación inicial [6].
La tabla VI recoge la recomendación de
tratamiento empírico inicial de la sepsis comunitaria en niños.
|
Tabla VI: Tratamiento antibiótico
empírico de la sepsis
en niños mayores de un mes [7]
|
| |
|
Foco |
Antibiótico |
|
|
|
|
Ninguno, respiratorio o urinario |
Cefalosporina de 3ª generación (cefotaxima, ceftriaxona) |
|
|
|
|
Sistema nervioso central |
Asociar vancomicina o teicoplanina si se sospecha
neumococo resistente |
|
|
|
|
Abdominal |
Añadir metronidazol o clindamicina |
|
|
|
|
Ninguno en paciente tratado previamente con antibiótico empírico |
Imipenem |
|
|
5.1.5. Tratamiento de la insuficiencia
suprarrenal con corticoides [36]
La incidencia de insuficiencia suprarrenal en los niños con sepsis
varía dependiendo de la etiología, la gravedad del cuadro clínico y sobre
todo los criterios de definición de insuficiencia suprarrenal. Los niños
que presentan niveles bajos de cortisol y elevados de ACTH presentan peor
pronóstico [37].
Pocos niños presentan una insuficiencia suprarrenal absoluta (cortisol
basal < 25 mcg/dl). Sin embargo, los niveles de cortisol aunque normales o
elevados pueden ser insuficientes para el grado de estrés. Algunos autores
definen esta insuficiencia suprarrenal relativa como un aumento de
cortisol menor de 9 mcg/dl tras la
administración de 0,5 mcg/1,73 m2 de ACTH [38, 39].
Efecto: en algunos niños el tratamiento con corticoides
consigue una mejoría hemodinámica con aumento de la presión
arterial, de las resistencias vasculares, del gasto cardiaco y disminución
de la necesidad de catecolaminas [14, 32]. Además, en algún estudio en adultos con shock séptico el tratamiento con
corticoides ha logrado disminuir la mortalidad [40].
Indicaciones: en el momento actual los corticoides están indicados en los niños con sepsis que han
estado recibiendo previamente corticoides, en el shock refractario a
expansión y catecolaminas, en aquellos con sospecha de insuficiencia
suprarrenal (púrpura fulminante), y en los que tienen niveles basales
bajos de cortisol o que no responden a la estimulación con corticotropina
[14, 38].
Dosis: no se sabe cuál
es la dosis más adecuada para el tratamiento de la insuficiencia
suprarrenal secundaria a la sepsis. Las dosis utilizadas varían de 1-2 mg/kg/6-8
h de hidrocortisona hasta 2 mg/kg en bolo inicial, continuando con una
perfusión continua de 0,2 mg/kg/h [31, 38].
Se recomienda mantener el tratamiento durante 5 a 7 días o hasta la
resolución de cuadro clínico, con disminución progresiva posterior.
5.2 Estabilización secundaria
y tratamiento de las complicaciones
Los niños en shock séptico que no responden al tratamiento con líquidos
y/o fármacos vasoactivos desarrollan un fallo multiorgánico y tienen muy
mal pronóstico. Las alteraciones secundarias que aparecen más
frecuentemente en los niños con sepsis son la coagulopatía de consumo, la
insuficiencia renal aguda y el Síndrome de Dificultad Respiratoria Aguda (SDRA). Otras complicaciones son la isquemia y necrosis de territorios vacsulares
distales y la aparición de focos infecciosos metastásicos.
5.2.1. Monitorización secundaria
Tras la primera fase de resucitación, según
la respuesta del niño al tratamiento inicial es necesario valorar realizar
una monitorización más completa.
Monitorización del gasto cardiaco
La colocación de un catéter de Swan-Ganz
permite la monitorización hemodinámica más completa y valorar la respuesta
al tratamiento. Sin embargo, su colocación en niños pequeños es difícil y su utilización en adultos no ha demostrado mejorar el pronóstico del shock
y aumenta la incidencia de efectos secundarios. La medición del gasto por termodilución femoral arterial (PiCCO) o por dilución de litio (LIDDCO)
son métodos menos invasivos (solo requieren la canalización de una
arteria), que permiten medir el gasto cardiaco y las resistencias
vasculares de forma continua a partir de la curva arterial. Además, el PiCCO puede estimar el volumen de sangre torácica intravascular y
extravascular de forma intermitente. Estos métodos tienen buena
correlación con el Swan-Ganz, pero existe todavía escasa experiencia en niños [32, 41].
La saturación venosa mixta: mide indirectamente la oxigenación tisular,
aunque sus valores dependen del gasto cardiaco y la oxigenación arterial.
Puede ser utilizada como guía de tratamiento intentando alcanzar una
saturación venosa mayor del 70%, aunque este objetivo no ha demostrado su
validez pronóstica [6, 30].
Presión de perfusión tisular (PPT)
La diferencia entre la presión
arterial media (PAM) y la presión venosa central (PVC) refleja
indirectamente y de forma global la presión de perfusión tisular. Se ha
recomendado intentar mantener una PPT mayor de 60-65 cm H2O como
guía de tratamiento [30],
aunque no existen estudios que hayan validado este parámetro.
pH intramural gástrico
Permite detectar la fase inicial del shock,
ya que el intestino se afecta precozmente. Permite valorar la evolución,
aunque no existen estudios que hayan demostrado su utilidad como guía de
tratamiento de los niños con shock séptico [42].
Ecocardiografía transtorácica y/o transesofágica
Permite valorar
la anatomía cardiaca y estimar la volemia, la fracción de eyección y las
presiones pulmonares. Es una medida discontinua, que exige personal
específicamente entrenado, lo que limita su utilización rutinaria como
medida de monitorización en el shock séptico.
5.2.2. Estabilización cardiovascular
secundaria
Si con el tratamiento inicial no se consigue una estabilización del
paciente la actuación posterior dependerá de la monitorización realizada :
a) Si
no está monitorizado el gasto cardiaco: ajustar la noradrenalina (0,05-2 mcg/kg/min), adrenalina (0,05-2 mcg/kg/min) o dobutamina (5
-15 mcg/kg/min) para conseguir una TA normal, una saturación venosa en
aurícula derecha mayor de 70 % y una diuresis normal.
b) Si está
monitorizado el gasto cardiaco se debe intentar
conseguir un índice cardiaco entre 3,3 y 6 L/min/m2 [30].
Los intentos de conseguir valores supranormales de transporte de oxígeno
no han demostrado mejorar el pronóstico y pueden aumentar los efectos
secundarios.
-
Gasto cardiaco elevado y resistencias vasculares bajas: añadir o aumentar
la noradrenalina o adrenalina.
-
Gasto cardiaco bajo, tensión arterial baja, resistencias vasculares bajas,
normales o elevadas: añadir adrenalina.
-
Gasto cardiaco bajo, tensión arterial normal y resistencias periféricas
elevadas: adrenalina más vasodilatadores (milrinona o nitroprusiato).
Las asociaciones de fármacos vasoactivos más utilizadas en el shock
séptico en niños son la dopamina-adrenalina, dobutamina-dopamina, y
dobutamina-noradrenalina. Si se añade
adrenalina o noradrenalina, se puede ir subiendo progresivamente la dosis
de estos fármacos hasta normalizar la hemodinámica y entonces disminuir la dobutamina a 5-10 mcg/kg/min y la dopamina a 3-5 mcg/kg/min, aunque su
efecto sobre la circulación renal y esplácnica es muy discutido [6, 30-32]. La mayoría de estudios en adultos no han encontrado diferencias
entre las diferentes asociaciones de fármacos vasoactivos. La adrenalina
consigue una mejoría hemodinámica similar a la combinación de dobutamina y
noradrenalina, aunque produce un aumento transitorio de la concentración
de lactato y una disminución del pH intramural durante las primeras 24
horas de tratamiento, sin existir diferencias posteriores.
Fármacos alternativos: recientemente se ha referido que la
vasopresina en perfusión continua [43] y la terlipresina, su derivado de vida media prolongada,
administrada cada 4 horas o en perfusión
continua, pueden aumentar la tensión arterial en algunos niños con
shock séptico refractario a catecolaminas [44].
Estos fármacos aumentan la tensión arterial en
pacientes con shock séptico refractario a fármacos vasoactivos, y pueden
mejorar la perfusión de los órganos vitales. Existe todavía muy poca
experiencia con estos fármacos en el shock séptico, no estando definidas
sus dosis e intervalos más eficaces, y pueden aumentar el riesgo de lesiones isquémicas distales, ya que producen
una importante vasoconstricción cutánea.
ECMO: la oxigenación por membrana extracorpórea puede estar
indicada en los niños con shock refractario a otras medidas [31]. A pesar de que la coagulopatía de consumo, frecuente en el shock
séptico, aumenta el riesgo de sangrado grave con esta técnica, el pronóstico de los niños con sepsis que
precisan ECMO es similar al de los niños sin sepsis [6, 30, 31, 45].
5.2.3. Medidas generales
Mantener normotermia
La hipotermia es un factor de
riesgo de mortalidad en los pacientes sépticos [46]. Los niños, sobre todo los lactantes,
tienen mayor riesgo de hipotermia debido a su relativa mayor superficie
corporal y a un peor control de la regulación térmica. Por ello es
importante asegurar un ambiente térmico neutro y calentar de forma
activa si existe hipotermia [47].
Sedación y analgesia
Para adaptación a la ventilación mecánica y disminución del consumo
calórico [31]. En los niños con shock séptico es necesario titular las
dosis de sedantes cuidadosamente por el mayor riesgo de hipotensión.
Corrección de trastornos electrolíticos
-
Acidosis
metabólica: la acidosis secundaria a la hipoperfusión deprime la función
miocárdica y disminuye el efecto de los fármacos inotrópicos. En caso de
acidosis grave (pH inferior a 7,2), está indicada
la administración de bicarbonato 1M (1-2
mEq/kg/dosis) o la utilización de sueros bicarbonatados, aunque no se ha
demostrado claramente la eficacia de esta medida.
-
Hipocalcemia:
la hipocalcemia es frecuente en el shock séptico tanto en adultos [48]
como en niños [49],
y está relacionada con un aumento de los precursores de la calcitonina [48]. En estos pacientes la administración de calcio puede mejorar la tensión
arterial por efecto vasoconstrictor y la contractilidad ventricular, sin
incrementar las necesidades de oxígeno [50].
-
Alteraciones de la glucemia: la hipoglucemia
es más frecuente en lactantes pequeños [31].
En adultos y niños mayores críticamente enfermos la hiperglucemia se ha
asociado con mayor mortalidad [51, 52],
y en algunos estudios en adultos la corrección de la hiperglucemia de
estrés con perfusión de insulina ha mejorado el pronóstico [52].
Protección gástrica
Los niños con sepsis, sobre todo si presentan
coagulación intravascular diseminada tienen mayor riesgo de hemorragia
digestiva por lesión aguda de la mucosa gástrica. Por ello deben recibir
tratamiento profiláctico con ranitidina y/o sucralfato [53].
Nutrición
Salvo que exista daño intestinal grave se puede iniciar en las primeras
24-48 horas la nutrición enteral, sin pretender inicialmente alcanzar un
aporte calórico completo. La nutrición enteral es generalmente bien
tolerada, permite mantener la funcionalidad intestinal y disminuir el
riesgo de fallo multiorgánico [54].
Transfusión racional de hemoderivados
La transfusión de hematíes
aumenta el transporte de oxígeno a los tejidos, pero puede también liberar
gran cantidad de citokinas proinflamatorias. Aunque no existen estudios
comparativos el consenso de expertos recomienda mantener en los niños con
sepsis grave y shock séptico una Hb superior a 10 g/dl [31].
Tratamiento de las complicaciones respiratorias (SDRA)
El SDRA es una de las complicaciones más frecuentes en los niños con
sepsis grave. Su tratamiento es igual al de los niños con SDRA de otras
etiologías.
Tratamiento de la insuficiencia renal
Las técnicas de depuración extrarrenal continua no solo actúan depurando
urea y creatinina, sino que mejoran la hemodinámica al disminuir la
precarga y eliminar líquidos y mediadores inflamatorios. Estas técnicas
deben iniciarse precozmente en los niños con sepsis con diuresis
insuficiente, independientemente de las cifras de urea y creatinina, sin
esperar al desarrollo de una insuficiencia renal oligoanúrica. Algunos
estudios en adultos han encontrado que la utilización precoz de técnicas
de depuración extrarrenal venovenosa continua con altos volúmenes de ulltrafiltrado mejora el pronóstico de los pacientes críticos [55].
Sin embargo, esto no ha sido confirmado en otros estudios.
5.2.4. Antibioterapia
Tratamiento específico
Hay que tener en cuenta el microorganismo
causante, su sensibilidad a la antibioterapia, la localización del foco
causal, las características del paciente y la toxicidad del fármaco. En el
tratamiento de la sepsis de origen nosocomial cada UCIP debe conocer la
flora bacteriana predominante. Si existen gérmenes Gram negativos con beta
lactamasas de espectro ampliado no se pueden utilizar cefalosporinas de 3ª
generación. Se ha documentado una mayor tasa de mortalidad en pacientes
con sepsis tratados con antibióticos que se unen con alta afinidad a la
proteína 3 que liga a la penicilina (aztreonam, ceftazidima y cefotaxima),
ya que al administrarse estos antibióticos pueden liberar grandes
cantidades de endotoxina y agravar el cuadro clínico.
Duración del tratamiento
La duración del tratamiento antibiótico en la
sepsis del niño, fuera del periodo neonatal, debe ser de 7 a 10 días. En
la sepsis por Candida se debe mantener el tratamiento antifúngico 4 a 8 semanas.
Profilaxis de los contactos
A los contactos próximos de los niños con
sepsis meningocócica o por Haemophilus influenzae se les debe administrar
rifampicina 10 mg/kg/12 horas durante 2 días, o como alternativas ceftriaxona 125
mg/im en una sola dosis, o ciprofloxacino 10 mg/kg en una sola dosis oral.
5.2.5. Tratamiento de la coagulación
intravascular diseminada (CID)
El tratamiento de la CID en la sepsis es similar al de otras etiologías y
se basa en la reposición de plaquetas, factores de coagulación y
anticoagulantes consumidos para evitar o disminuir la microtrombosis y la
hemorragia.
Anticoagulantes
La proteína C humana activada recombinante (drotrecogina-alfa
activada) a dosis de 24 mcg/kg/h en perfusión continua durante 96 h, ha
demostrado disminuir en un 19% el riesgo relativo de muerte y en un 6 % la
mortalidad en un estudio multicéntrico en adultos con sepsis grave, siendo el efecto mayor en los
pacientes más graves [56].
Sin embargo, el fármaco aumenta el riesgo de sangrado en pacientes con
trombopenia, y un 2,5% presenta hemorragia intracraneal [56]. En niños existe todavía poca experiencia pero su farmacocinética,
seguridad e incidencia de efectos secundarios es similar a la descrita en
adultos [57].
En una serie de 8 niños con sepsis y púrpura sobrevivieron 6 sin secuelas
[58]. Otros anticoagulantes como la antitrombina III o la heparina no han
demostrado mejorar la morbimortalidad del shock séptico, y la heparina
aumenta el riesgo de sangrado en pacientes con coagulación intravascular
diseminada [59].
Plasmaféresis-plasmafiltración
Actúa depurando los mediadores inflamatorios y productos de la coagulación
y recambiándolos por plasma fresco congelado. Puede realizarse de forma
continua asociada o no a la hemodiafiltración [60], o intermitente en sesiones de 3 a 4 horas.
La aplicación de ambas técnicas de forma simultánea permite hacer diálisis
y balance negativo con la hemodiafiltración y recambio plasmático con
balance neutro de plasma. El recambio plasmático disminuye los
niveles circulantes de endotoxinas y citokinas, restaura los niveles de
inmunoglobulinas, factores de la coagulación, proteína C, antitrombina III
y la capacidad opsónica y bactericida del suero, mejorando la coagulación
intravascular diseminada y la hemodinámica [61]. Algunos estudios controlados en
adultos han encontrado mejoría de la supervivencia [62].
En niños, a pesar de que desde hace más de 20 años algunos autores
han utilizado la exanguinotransfusión y/o el recambio plasmático como
tratamiento del shock séptico todavía hay pocos estudios que hayan
evaluado la eficacia de esta técnica [60, 62-64].
Reeves comparó en 18 niños la hemofiltración con la plasmafiltración más
hemofiltración sin encontrar diferencias en la supervivencia entre ambas
técnicas [60].
Pearson ha tratado 21 niños con sepsis meningocócica de los que 16
sobrevivieron [64].
La técnica es en general bien tolerada, siendo los efectos secundarios más
importantes la hipotensión y la reacción anafiláctica, secundaria a la
infusión de plasma. La plasmafiltración continua y la
hemodiafiltración venovenosa puede utilizarse simultáneamente en niños
mayores con shock séptico, pero no existe experiencia en niños pequeños.
5.2.6. Inmunoterapia
Anticuerpos antimediadores
Múltiples estudios han analizado el efecto de la administración de
anticuerpos anti-endotoxinas, anticuerpos anti-factor de necrosis tumoral
o antagonistas de receptores de interleukina-1. A pesar de los buenos
resultados experimentales, ningún anticuerpo ha conseguido reducir
significativamente la mortalidad en estudios en humanos.
Inmunoglobulinas intravenosas
Aunque en algunos estudios el
tratamiento con inmunoglobulinas ha logrado disminuir la mortalidad de los
pacientes con sepsis, todavía no hay suficiente evidencia del efecto de
las inmunoglobulinas policlonales o monoclonales en los niños con shock
séptico [31, 65], por lo que actualmente su uso está restringido a
ensayos clínicos.
Factores de crecimiento
de granulocitos
En un estudio en neonatos con sepsis y neutropenia el
tratamiento con factor estimulador de colonias de macrófagos ha
demostrado mejorar la supervivencia. Sin embargo, no existen estudios que
analicen su efecto en niños fuera del periodo neonatal [31].
Dietas inmunomoduladoras
Algún trabajo en adultos ha referido una
mayor supervivencia de los pacientes tratados con dietas enterales
inmunomoduladoras [66]. No se ha realizado ningún estudio que evalúe este tipo de dietas en el
niño.
|
6. Pronóstico
de la sepsis en el niño |
6.1 Indicadores pronósticos
Aunque no existe ninguna manifestación clínica ni dato analítico
totalmente sensible ni específico, los signos más frecuentemente asociados
con mal pronóstico de la sepsis en el niño son: la edad menor de un año,
un corto periodo de tiempo desde el inicio del cuadro al ingreso, la
ausencia de meningitis, la presencia de lesiones cutáneas progresivas o
muy extendidas, el shock, una PCR moderadamente elevada o normal, la
ausencia de leucocitosis y la presencia de trombopenia, CID e
hipofibrinogenemia.
La sepsis meningocócica es la que tiene peor pronóstico. Su evolución
puede ser fulminante y llevar a la muerte en pocas horas. Además, una
considerable proporción de supervivientes sufren secuelas a largo plazo
fundamentalmente secundarias a isquemia de las extremidades y/o
afectación del sistema nervioso central [67].
6.2
Escalas de gravedad y de riesgo de mortalidad
Las escalas de
valoración de gravedad y riesgo de mortalidad general del niño
críticamente enfermo (PRIMS, PIM) son aplicables a los niños con sepsis.
Además, se han desarrollado diversas escalas de puntuación pronóstica
específica para la sepsis meningocócica. La puntuación de Glasgow para la
sepsis meningocócica [68], (tabla VII) y la de Castellanos [19] son las que tienen mejor capacidad pronóstica.
Una puntuación de Glasgow superior a 7 tiene una sensibilidad del 100 %,
especificidad del 75 % y valor predictivo positivo de mortalidad del 29
%, y una puntuación superior a 9 una sensibilidad del 100 %, especificidad del 88 %
y valor predictivo positivo de mortalidad del 46 % [68]. En
nuestro país se ha desarrollado una nueva puntuación pronóstica en un
estudio multicéntrico sobre una muestra de 192 niños ingresados en UCIP y
validada con otra muestra de 152 pacientes [19].
La puntuación incluye 7 variables:
cianosis (2 puntos), puntuación de escala de Glasgow inferior a 8 (2 puntos),
hipotensión refractaria (2 puntos), oliguria (1 punto), leucocitos
inferiores a 4.000
(1 punto), tiempo parcial de tromboplastina activado mayor de 1,5 veces el
control (1 punto), y exceso de bases superior a -10 mmol/L (1 punto). Esta nueva
puntuación tiene una mejor capacidad de discriminación pronóstica que el
PIM (ìndice pediátrico de mortalidad) y la escala de Glasgow para la
enfermedad meningocócica [19].
|
Tabla VII: Puntuación de Glasgow para
la sepsis meningocócica [68]
|
| |
|
Parámetro |
Puntuación |
Tensión arterial sistólica inferior a 75 mmHg y edad < 4 años ó
Tensión arterial sistólica inferior a 85 mmHg y edad > 4 años |
3 |
|
Temperatura diferencial superior a 3º C |
3 |
|
Escala de coma modificada inferior a 8 puntos o deterioro de 3 puntos en
una hora |
3 |
|
Deterioro en la hora anterior a aplicar la escala |
2 |
|
Ausencia de meningismo |
2 |
|
Púrpura extendida o equimosis |
1 |
|
Exceso de bases (capilar o arterial) superior a -8 |
1 |
|
PUNTUACIÓN TOTAL (MÁXIMA): 15 PUNTOS |
|
|
|
6.3 Sepsis y
Síndrome de disfunción multiorgánica (SDMO)
La sepsis puede
desencadenar un SDMO primario (producido por la propia infección y que
aparece precozmente) o secundario (debido a la respuesta inflamatoria por
parte del huésped que se desarrolla en los días siguientes). La sepsis es
la causa más frecuente de SDMO en los niños críticamente enfermos
(aproximadamente el 30% de los niños con sepsis sufren SDMO [69]. El SDMO
aparece en el 24 % de los pacientes con sepsis grave y en el 52 %
con shock séptico [70].
A diferencia del
adulto, en los niños la disfunción de los diversos órganos puede aparecer
de forma simultánea, el SDMO evoluciona más rápidamente, manifestándose en
las primeras 24 a 48 horas y el máximo número de órganos afectados se
alcanza a las 72 horas. Existe
una escala de disfunción multiorgánica recientemente validada para niños (PELOD),
que valora 6 alteraciones orgánicas (tabla VIII), y ha demostrado una buena
capacidad pronóstica [71].
|
Tabla VIII: Puntuación pediátrica
logística de disfunción multiorgánica (PELOD)
|
| |
|
Disfunción orgánica |
Puntuación |
|
|
0 |
1 |
10 |
20 |
|
Neurológico |
|
|
|
|
|
Escala de Glasgow y reacción pupilar |
12-15 y ambas reactivas |
7-11 |
4-6 o ambas fijas |
3 |
|
Cardiovascular |
|
|
|
|
Frecuencia cardiaca lpm: |
|
Menores de 12 años |
≤
195 |
- |
> 195 |
- |
|
12 o más años |
≤
150 |
- |
> 150 |
- |
|
|
y |
|
o |
|
|
Tensión arterial sistólica mm Hg: |
|
Menores de 1 mes |
> 65 |
- |
35-65 |
< 35 |
|
1 mes a 1 año |
> 75 |
- |
35-75 |
< 35 |
|
1 a 12 años |
> 85 |
- |
45-85 |
< 45 |
|
Mayores de 12 años |
> 95 |
- |
55-95 |
< 55 |
|
Renal |
|
|
|
|
|
Creatinina mg/dl: |
|
|
|
|
|
Menores de 7 días |
< 1,59 |
- |
≥ 1,59 |
- |
|
7 días a 1 año |
< 0,62 |
- |
≥ 0,62 |
- |
|
1 a 12 años |
< 1, 13 |
- |
≥ 1,13 |
- |
|
Mayores de 12 años |
< 1,6 |
- |
≥ 1,6 |
- |
|
Respiratorio |
|
|
|
|
|
paO2/FiO2 (mmHg) |
> 70 |
- |
≤ 70 |
- |
|
|
y |
|
o |
|
|
paCO2 (mmHg) |
≤ 88 |
- |
> 88 |
- |
|
|
y |
|
|
|
|
Ventilación mecánica: |
No |
Sí |
- |
- |
|
Hematológico |
|
|
|
|
|
Leucocitos (x106/L) |
> 4.500 |
1.500-4.400 |
< 1.500 |
- |
|
|
y |
o |
|
|
|
Plaquetas (x106/L) |
> 35.000 |
< 35.000 |
- |
- |
|
Hepático |
|
|
|
|
|
AST (UI/L) |
< 950 |
≥ 950 |
- |
- |
|
|
y |
o |
|
|
|
Actividad de protrombina (INR) |
> 60% (< 1,4) |
≤ 60% (≥ 1,4) |
- |
- |
|
|
|
|
|
|
|
[Tomada de referencia 71]. Se elige la puntuación más alta en cada
disfunción orgánica. La escala de Glasgow se aplica solo a pacientes con
sospecha o confirmación de alteración neurológica aguda; se puntúa el peor
valor encontrado; si está sedado, se registra el valor previo a la
sedación. Reacción pupilar: pupilas no reactivas de más de 3 mm; no
valorar después de dilatación pupilar yatrogénica. Frecuencia cardiaca y
tensión arterial: no valorar durante el llanto o agitación yatrogénica.
paO2: arterial; paCO2: arterial, capilar o venoso. paO2/FiO2 no se puede
valorar en pacientes con cortocircuito intracardiaco, por lo que se
considera normal en niños con cardiopatías cianógenas. Ventilación
mecánica: ventilación mecánica invasiva. |
|
|
La
mortalidad del SDMO en niños varía entre el 50 y el 80 %. Las tasas de mortalidad
dependen de numerosos factores: definición de insuficiencia orgánica,
gravedad en el momento del ingreso, número de sistemas
orgánicos comprometidos, edad del paciente (mayor en
menores de 12 meses) [72]. Los
niños con fallo multiorgánico y sepsis tienen mayor mortalidad que los que
presentan SDMO sin sepsis [9, 70, 73],
y además, los niños con
sepsis que desarrollan SDMO tienen mayor mortalidad que los niños con
sepsis sin fallo multiorgánico [70, 72].
-
La sepsis tiene una elevada incidencia y mortalidad en el niño.
-
El diagnóstico inicial de la sepsis en el niño es más complicado
que en el adulto, debido a que muchas otras alteraciones producen
inicialmente la misma sintomatología.
-
En general, la evolución del cuadro séptico es mucho más rápida en
el niño que en el adulto, y mayor cuanto menor es la edad del mismo.
-
Los factores de riesgo más importantes de mortalidad de la sepsis en el
niño son la edad menor de un año, la rapidez en la progresión del
cuadro de shock y la coagulopatía, la presencia de leucopenia y acidosis
metabólica y el desarrollo de fallo multiorgánico.
-
El único factor que ha demostrado mejorar significativamente la
mortalidad de la sepsis en el niño es el diagnóstico y tratamiento
agresivo precoz.
-
El tratamiento inicial del niño con shock séptico durante la
primera hora puede precisar la expansión con un volumen muy importante de
líquidos (hasta 200 ml/kg).
-
Se debe iniciar tratamiento precoz con fármacos vasoactivos
(dopamina, adrenalina, noradrenalina), si el niño no responde a las
primeras expansiones con volumen.
-
En los niños con shock refractario a fármacos vasoactivos debe
plantearse el tratamiento con corticoides, calcio,
vasopresina-terlipresina, o ECMO.
-
Todavía no existen estudios comparativos que analicen el efecto de
la proteína C sobre la mortalidad en el niño con sepsis grave.
-
El tratamiento de sostén (normotermia, corrección de las
alteraciones electrolíticas, sedación, nutrición enteral precoz,
profilaxis de la hemorragia digestiva) y el tratamiento precoz de las
complicaciones (SDRA, insuficiencia renal aguda, coagulación intravascular
diseminada) pueden contribuir a la disminución de la mortalidad tardía de
la sepsis en el niño.
-
Matot I, Sprung CHL. Definition of
sepsis. Intensive Care Med 2001; 27: S3-S9.
-
Bone RC, Balk RA, Cerra FB, Dellinger RP,
Fein AM, Knaus WA, Schein RM, Sibbald WJ. Definitions for sepsis and
organ failure and guidelines for the use of innovative therapies in
sepsis. The ACCP/SCCM Consensus Conference Committee. American College
of Chest Physicians/Society of Critical Care Medicine. Chest 1992; 101:
1644-1655.
-
Levy MM, Fink M, Marshall JC et al. 2001
SCCM/ESICM/ACCP/ATS/SIS international sepsis definitions conference.
Intensive Care Med. 2003; 29: 530-538.
-
Saéz-Llorens X, McKracken G. Sepsis
syndrome and septic shock in pediatrics: current concepts of
terminology, pathophysiology and management. J Pediatr 1993; 123:
497-508.
-
Hayden WR. Sepsis terminology in
pediatrics. J Pediatr 1994; 124: 657-658.
-
Carcillo J. Pediatric septic shock and
multiple organ failure. Crit Care Clin 2003; 19: 413-440.
-
Bueno Campaña M, Echavarri Olavarría F.
Sepsis. En Manual de Cuidados Intensivos Pediátricos 2ª ed. López-Herce
J, Calvo C, Lorente M, Baltodano A eds. Publimed 2004; 30: 273-279.
-
Kutko MC, Calarco MP, Flaherty MB,
Helmrich RF, Ushay HM, Pon S, Greenwald BM. Mortality rates in pediatric
septic shock with and without multiple organ system failure. Pediatr
Crit Care Med 2003; 4: 333-337.
-
Proulx F, Fayon M, Farrell CA, Lacroix J,
Gauthier M. Epidemiology of sepsis and multiple organ dysfunction
syndrome in children. Chest 1996; 109: 1033-1037.
-
Ribeiro AM, Moreira JL. Sepsis in
childhood: epidemiological profile and microbiologic diagnosis. J
Pediatr (Rio J) 1999; 75: 39-44.
-
Richards MJ, Edwards JR, Culver DH,
Gaynes RP. Nosocomial infections in pediatric intensive care units in
the United States. National Nosocomial Infections Surveillance System.
Pediatrics 1999;103: e39.
-
Raymond J, Aujard Y. Nosocomial
infections in pediatric patients: a European, multicenter prospective
study. European Study Group. Infect Control Hosp Epidemiol 2000; 21:
260-263.
-
Ballesteros D, De la Cal MA, Calvo C,
Vázquez JM. Infección nosocomial. En Manual de Cuidados Intensivos
Pediátricos 2ª ed. López-Herce J, Calvo C, Lorente M, Baltodano A eds.
Publimed 2004; 34: 318-325.
-
Rowin ME, Patel VV, Christenson JC.
Pediatric intensive care unit nosocomial infections: epidemiology,
sources and solutions. Crit Care Clin 2003; 19: 473-487.
-
Welch SB, Nadel S. Treatment of
meningococcal infection. Arch Dis Child 2003; 88: 608-614.
-
Pollard AJ, Britto J, Nadel S, De Munter
C, Habibi P, Levin M. Emergency management of meningococcal disease.
Arch Dis Child 1999; 80: 290-296.
-
Han YY, Carcillo JA, Dragotta MA, Bills
DM, Watson RS, Westerman ME, Orr RA. Early reversal of pediatric-neonatal
septic shock by community physicians is associated with improved
outcome. Pediatrics 2003; 112: 793-799.
-
Booy R, Habibi P, Nadel S, de Munter C,
Britto J, Morrison A, Levin M; Meningococcal Research Group. Reduction
in case fatality rate from meningococcal disease associated with
improved healthcare delivery. Arch Dis Child 2001; 85: 386-390.
-
Castellanos-Ortega A, Delgado-Rodriguez
M, Llorca J, Sánchez Burón P, Mencía Bartolomé S, Soult Rubio A, Milano
Manso G, Domínguez Sampedro P, Blanco Montero R, Rodríguez Núñez A,
Zambrano Pérez E, Rey Galán C, López Negueruela N, Reig Saenz R. A new
prognostic scoring system for meningococcal septic shock in children.
Comparison with three other scoring systems. Intensive Care Med. 2002;
28: 341-351.
-
Dugas MA, Proulx F, de Jaeger A, Lacroix
J, Lambert M. Markers of tissue hypoperfusion in pediatric septic shock.
Intensive Care Med 2000; 26: 75-83.
-
García Sanz C, Rupérez Lucas M, López-Herce
Cid J, Vigil Escribano D, Garrido Cantarero G. Valor pronóstico de la
puntuación PIM (índice pediátrico de mortalidad) y del ácido láctico en
niños críticamente enfermos. An Esp Pediatr 2002; 57: 394-400.
-
Prat C, Domínguez J, Rodrigo C, Giménez
M, Azuara M, Blanco S, Ausina V. Use of quantitative and
semiquantitative procalcitonin measurements to identify children with
sepsis and meningitis. Eur J Clin Microbiol Infect Dis 2004; 23:
136-138.
-
Enguix A, Rey C, Concha A, Medina A, Coto
D, Dieguez MA. Comparisonof procalcitonin with C-reactive protein and
seroamyloid for early diagnosis of bacterial sepsis in critically ill
neonates and children. Intensive Care Med 2001; 27: 211-215.
-
Van der Kaay DC, De Kleijn ED, De Rijke
YB, Hop WC, De Groot R, Hazelzet JA. Procalcitonin as a prognostic
marker in meningococcal disease. Intensive Care Med 2002; 28: 1606-1612.
-
Han YY, Doughty LA, Kofos D, Sasser H,
Carcillo JA. Procalcitonin is persistently increased among children with
poor outcome from bacterial sepsis. Pediatr Crit Care Med 2003; 4:
21-25.
-
Krafte-Jacobs B, Bock GH. Circulating
erythropoietin and interleukin-6 concentrations increase in critically
ill children with sepsis and septic shock. Crit Care Med 1996; 24:
1455-1459.
-
Krafte-Jacobs B, Brilli R, Szabo C,
Denenberg A, Moore L, Salzman AL. Circulating methemoglobin and
nitrite/nitrate concentrations as indicators of nitric oxide
overproduction in critically ill children with septic shock. Crit Care
Med 1997; 25: 1588-1593.
-
Krafte-Jacobs B, Brilli R. Increased
circulating thrombomodulin in children with septic shock. Crit Care Med
1998; 26: 933-938.
-
Onenli-Mungan N, Yildizdas D, Yapicioglu
H, Topaloglu AK, Yuksel B, Ozer G. Growth hormone and insulin-like
growth factor 1 levels and their relation to survival in children with
bacterial sepsis and septic shock. J Paediatr Child Health 2004; 40:
221-226.
-
Carcillo JA, Fields AI, Task Force
Committee members. Clinical practice parameters for hemodynamic
support of pediatric and neonatal patients in septic shock. Crit Care
Med 2002; 30: 1365-1378.
-
Dellinger RP, Carlet JM, Masur H, Gerlach
H, Calandra T, Cohen J, Gea-Banacloche J, Keh D, Marshall JC, Parker MM,
Ramsay G, Zimmerman JL, Vincent JL, Levy MM; Surviving Sepsis Campaign
Management Guidelines Committee. Surviving sepsis campaign guidelines
for management of severe sepsis and septic shock. Crit Care Med 2004;
32: 858-873.
-
Flores González JC, López-Herce Cid
J.Shock. En Manual de Cuidados Intensivos Pediátricos 2ª ed. López-Herce
J, Calvo C, Lorente M, Baltodano A eds. Publimed 2004; 24: 215-225.
-
Oliveira RP, Velasco I, Soriano F,
Friedman G. Hypertonic saline resuscitation in sepsis. Crit Care 2002;
6: 418-423.
-
Muller L, Lefrant JY, Jaber S, Louart G,
Mahamat A, Ripart J, De La Coussaye JE, Eledjam JJ. Short term effects
of hypertonic saline during severe sepsis and septic shock. Ann Fr
Anesth Reanim 2004; 23: 575-580.
-
De Carvalho WB. Hypertonic solutions for
pediatric patients. J Pediatr (Rio J) 2003; 79 Suppl 2: S187-S194.
-
Casartelli CH, Garcia PC, Piva JP, Branco
RG. Adrenal insufficiency in children with septic shock. J Pediatr (Rio
J) 2003; 79 Suppl 2: S169-S176.
-
De Klein ED, Joosten KF, Van Rijn B,
Westerterp M, De Groot R, Hokken-Koelega AC, Hazelzet JA. low serum
cortisol in combination with high adrenocorticotrophic hormone
concentrations are associated with poor outcome in children with severe
meningococcal disease. Pediatr infect Dis J 2002; 21: 330-336.
-
López-Herce Cid J, Bustinza Arriortúa A,
Alcaraz Romero A, Brandstrup Azuero KB, Fernández García-Abril C,
Roncero Rubio M. Tratamiento del shock séptico con plasmafiltración y
hemodiafiltración continuas simultáneas. An Pediatr (Barc) 2003; 59:
491-496.
-
Cooper MS, Stewart PM. Corticosteroid
insufficiency in acutely ill patients. N Engl J Med 2003; 348: 727-734.
-
Annane D, Sébille V, Charpentier C et al.
Effect of treatment with low doses of hydrocortisone and fludocortisone
on mortality in patients with septic shock. JAMA 2002; 288: 862-871.
-
McLuckie A, Murdoch IA, Marsh MJ,
Anderson D. A comparison of pulmonary and femoral artery
thermodilution cardiac indices in paediatric intensive care patients.
Acta Paediatr 1996; 85: 336-338.
-
Calvo C, Ruza F, Lopez-Herce J, Dorao P,
Arribas N, Alvarado F. Usefulness of gastric intramucosal pH for
monitoring hemodynamic complications in critically ill children.
Intensive Care Med 1997; 23: 1268-1274.
-
Dunser MW, Wenzel V, Mayr AJ, Hasibeder
WR. Management of vasodilatory shock: defining the role of arginine
vasopressin. Drugs 2003; 63: 237-256.
-
Rodríguez-Núñez A, Fernández-Sanmartín M,
Martinón-Torres F, González-Alonso N, Martinón-Sánchez JM. Terlipressin
for catecholamine-resistant septic shock in children. Intensive Care Med
2004; 30: 477-480.
-
Goldman AP, Kerr SJ, Butt W, Marsh MJ,
Murdoch IA, Paul T, Firmin RK, Tasker RC, Macrae DJ. Extracorporeal
support for intractable cardiorespiratory failure due to meningococcal
disease. Lancet 1997; 349: 466-469.
-
Laupland KB, Davies HD, Church DL, Louie
TJ, Dool JS, Zygun DA, Doig CJ. Bloodstream infection-associated sepsis
and septic shock in critically ill adults: a population-based study.
Infection 2004; 32: 59-64.
-
López-Herce J, Cid J, Calvo Rey C,
Rupérez Lucas M, Brandstrup Azuero B. Tratamiento de la hipotermia e
hipertermia. En Manual de Cuidados Intensivos Pediátricos 2ª ed.
López-Herce J, Calvo C, Lorente M, Baltodano A eds. Publimed 2004; 57:
509-514.
-
Muller B, Becker KL, Kranzlin M,
Schachinger H, Huber PR, Nylen ES, Snider RH, White JC, Schmidt-Gayk H,
Zimmerli W, Ritz R. Disordered calcium homeostasis of sepsis:
association with calcitonin precursors. Eur J Clin Invest 2000; 30:
823-831.
-
Ruiz Magro P, Aparicio López C, López-Herce
Cid J, Martínez Campos M, Sancho Pérez L. Alteraciones metabólicas en
niños críticamente enfermos. An Esp Pediatr 1999; 51: 143-148.
-
Butt W. Choque séptico. Clin Pediatr
North Am (ed esp) 2001; 3: 621-648.
-
Srinivasan V, Spinella PC, Drott HR, Roth
CL, Helfaer MA, Nadkarni V. Association of timing, duration, and
intensity of hyperglycemia with intensive care unit mortality in
critically ill children. Pediatr Crit Care Med 2004; 5: 329-336.
-
Van den Berghe G, Wouters P, Weekers F,
Verwaest C, Bruyninckx F, Schetz M, Vlasselaers D, Ferdinande P, Lauwers
P, Bouillon R. Intensive insulin therapy in the critically ill patients.
N Engl J Med 2001; 345: 1359-1367.
-
López‑Herce J, Dorao P, Elola P, Delgado
MA, Ruza F, Madero R. Frequency and prophylaxis of upper
gastrointestinal hemorrhage in critically ill children: A prospective
study comparing the efficacy of almagate, ranitidine and sucralfate.
Crit Care Med 1992; 20: 1082‑1089.
-
Sánchez Sánchez C, López-Herce Cid
J, Carrillo Álvarez A, Bustinza Arriortúa A, Sancho Pérez L,
Vigil Escribano D. Nutrición enteral transpilórica en el niño
críticamente enfermo (I): técnica e indicaciones. An Pediatr (Barc)
2003; 59: 19-24.
-
Ronco C, Bellomo R, Homel P, Brendolan A,
Dan M, Piccinni P, La Greca G. Effects of different doses in continuous
veno-venous haemofiltration on outcomes of acute renal failure: a
prospective randomised trial. Lancet 2000; 356: 26-30.
-
Bernard GR, Vincent JL, Laterre PF.
Efficacy and safety of recombinant human activated protein C for severe
sepsis. N Engl J Med 2001; 344: 699-709.
-
Barton P, Kalil AC, Nadel S, Goldstein B,
Okhuysen-Cawley R, Brilli RJ, Takano JS, Martin LD, Quint P, Yeh TS,
Dalton HJ, Gessouron MR, Brown KE, Betts H, Levin M, Macias WL, Small
DS, Wyss VL, Bates BM, Utterback BG, Giroir BP. Safety,
pharmacokinetics, and pharmacodynamics of drotrecogin alfa (activated)
in children with severe sepsis. Pediatrics 2004; 113: 7-17.
-
Pettenazzo A, Malusa T. Use of protein C
concentrate in critical conditions: clinical experience in pediatric
patients with sepsis. Minerva Anestesiol 2004; 70: 357-363.
-
Warren BL, Eid A, Singer P, Pillay SS,
Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, Knaub S,
Keinecke HO, Heinrichs H, Schindel F, Juers M, Bone RC, Opal SM;
KyberSept Trial Study Group. Caring for the critically ill patient.
High-dose antithrombin III in severe sepsis: a randomized controlled
trial. JAMA 2001; 286: 1869-1878.
-
Reeves JH, Butt WW, Shann F, Layton JE,
Stewart A, Waring PM, Presneill JJ. Continuous plasmafiltration in
sepsis syndrome. Crit Care Med 1999; 27: 2096-2104.
-
McMaster P, Shann F. The use of
extracorporeal techniques to remove humoral factors in sepsis. Pediatr
Crit Care Med 2003; 4: 2-7.
-
Busund R, Koukline V, Utrobin U,
Nedashkovsky E. Plasmapheresis in severe sepsis and septic shock: a
prospective, randomised, controlled trial. Intensive Care Med 2002; 28:
1434-1439.
-
Reeves JH, Butt WW. Blood filtration in
children with severe sepsis: safe adjunctive therapy. Intensive Care Med
1995; 21: 500-504.
-
Pearson G, Khandelwal P,C, Naqvi N. Early
filtration and mortality in meningococcal septic shock? Arch Dis
Child 2000; 83: 508-509.
-
Alejandria MM, Lansang MA, Dans LF,
Mantaring JB. Intravenous immunoglobulin for treating sepsis and septic
shock. Cochrane Database Syst Rev. 2002; (1): CD001090.
-
Galbán C, Montejo JC, Mesejo A, Marco P,
Celaya S, Sánchez-Segura JM, Farré M, Bryg DJ.An immune-enhancing
enteral diet reduces mortality rate and episodes of bacteremia in septic
intensive care unit patients. Crit Care Med. 2000; 28: 643-648.
-
Thorburn K, Baines P, Thomson A, Hart CA.
Mortality in severe meningococcal disease. Arch Dis Child 2001; 85:
382-385.
-
Riordan FA, Marzouk O, Thomson AP, Sills
JA, Hart CA. Prospective validation of the Glasgow Meningococcal
Septicaemia Prognostic Score. Comparison with other scoring methods. Eur
J Pediatr. 2002; 16: 531-537.
-
Goh A, Lum L. Sepsis, severe sepsis and
septic shock in paediatric multiple organ dysfunction syndrome. J
Paediatr Child Health. 1999; 35: 488-492.
-
Sáez-Llorens X, Vargas S, Guerra F,
Coronado L. Application of new sepsis definitions to evaluate outcome of
pediatric patients with severe systemic infections. Pediatr Infect Dis J
1995; 14: 557-561.
-
Leteurtre S, Martinot A, Duhamel A,
Proulx F, Grandbastien B, Cotting J, Gottesman R, Joffe A, Pfenninger J,
Hubert P, Lacroix J, Leclerc F. Validation of the paediatric logistic
organ dysfunction (PELOD) score: prospective, observational, multicentre
study. Lancet 2003; 362: 192-197.
-
Forero J. Síndrome de disfunción orgánica
múltiple. En Manual de Cuidados Intensivos Pediátricos 2ª ed. López-Herce
J, Calvo C, Lorente M, Baltodano A eds. Publimed 2004; 36: 326-334.
-
Tantalean JA, León RJ, Santos AA, Sánchez
E. Multiple organ dysfunction syndrome in children. Pediatr Crit Care
Med. 2003; 4: 181-185.
Jesús López-Herce Cid
Hospital Gregorio Marañón, Madrid
©REMI,
http://remi.uninet.edu. Agosto 2004.
Palabras clave:
Sepsis, Sepsis grave, Shock séptico,
Cuidados Intensivos, Pediatría.
Busque en REMI con Google:
Envía tu comentario para su
publicación |