|
La sepsis y el
shock séptico cursan con una gran disminución de la resistencia vascular
sistémica y con una anómala distribución del flujo sanguíneo. En más del
90% de los pacientes tratados agresivamente con fluidoterapia hasta
asegurar la ausencia de hipovolemia, el gasto cardiaco es normal o
elevado. A pesar de ello, diversos estudios clínicos y experimentales han
demostrado que en la sepsis existe tanto una disfunción sistólica
biventricular, que se manifiesta por una fracción de eyección disminuida,
como una disfunción diastólica (compliancia ventricular anormal), con un
aumento de los volúmenes telesistólico y telediastólico. Este patrón
característico aparece en las primeras 24 horas del comienzo de la sepsis.
El mecanismo que causa estas alteraciones es complejo, aunque
probablemente no implica una isquemia miocárdica, ya que la producción de
lactato no se encuentra alterada en el lecho coronario. Estudios en
animales han implicado a numerosos factores, como edema miocárdico,
alteraciones del sarcolema, alteraciones en el metabolismo del calcio y
producción de mediadores inflamatorios.
El volumen
intravascular efectivo está reducido en los pacientes sépticos y es la
causa principal de su inestabilidad hemodinámica; en los pacientes que no
han recibido una carga de líquidos apropiada, el shock séptico puede
presentarse como un estado hipodinámico, con gasto cardiaco disminuido.
Son múltiples los factores que causan esta disminución del volumen
intravascular. La disminución del tono vascular afecta tanto al lecho
arterial como al venoso, dando lugar a congestión de los vasos de gran
capacitancia. Esta disminución es mayor en las zonas afectadas por la
inflamación, en las cuales hay además una mayor apertura de los shunts
arteriovenosos, disminuyendo así el área transversal del lecho capilar
total. Los cambios en el tono varían de un lecho vascular a otro,
resultando en una anómala distribución del flujo sanguíneo. Existe además
una disminución de la sensibilidad a las catecolaminas, dando lugar a un
aumento en la liberación de estas sustancias y a una regulación a la baja
de los receptores alfa-adrenérgicos. Existe un aumento de la permeabilidad
capilar que favorece la fuga de líquido hacia el tercer espacio. También
hay una alteración de la permeabilidad de la membrana celular al sodio que
favorece el flujo de líquido hacia el espacio intracelular, probablemente
mediada por el TNF alfa [1].
En todas las
formas de shock distributivo las concentraciones de catecolaminas
plasmáticas están muy elevadas y el sistema renina-angiotensina activado.
La vasodilatación parece pues debida a un fallo del músculo liso vascular
para contraerse.
Parece que los
mecanismos que producen vasodilatación y resistencia a los vasopresores
son hasta cierto punto comunes en todos los tipos de shock distributivo.
Hay en especial tres que se consideran especialmente implicados: la
activación de los canales de potasio sensibles al ATP en la membrana
plasmática de las células musculares vasculares, la activación de la forma
inducible de la sintetasa del óxido nítrico y la deficiencia de
vasopresina [2].
La
disrregulación de la síntesis de óxido nítrico causa defosforilación de
la miosina y vasodilatación. Además, la síntesis de óxido nítrico y la
acidosis metabólica activan los canales de potasio dependientes de ATP y
de calcio en la membrana plasmática de las células musculares vasculares;
ésto resulta en una hiperpolarización de la membrana que impide que el
calcio entre en las células (mecanismo mediado por la noradrenalina y la
angiotensina II) y la producción de vasoconstricción.
A pesar de la
hipotensión, las concentraciones plasmáticas de vasopresina son bajas en
el shock establecido, probablemente por una liberación masiva de esta
hormona en las fases iniciales con vaciamiento de los depósitos. Esto hace
que los niveles sean insuficientes para mantener una presión arterial
normal a través de varios mecanismos, en uno de los cuales está de nuevo
implicado el óxido nítrico, ya que la vasopresina tiene una acción opuesta
a éste sobre los canales de potasio ATP-dependientes. A causa de este
déficit de vasopresina, no hay regulación a la baja de sus receptores como
ocurre con los adrenérgicos, y la vasopresina exógena tiene acción sobre la
presión arterial a dosis que no afectan a sujetos sanos [2].
Aunque el gasto
cardiaco está aumentado en la sepsis, el flujo no está distribuido
uniformemente en los diversos lechos vasculares. Existe una reducción del
flujo en el músculo miocárdico y esquelético y, sobre todo, en estómago,
duodeno, intestino delgado y páncreas. El flujo en los lechos cerebral y
renal suele estar preservado.
La reducción
del flujo de la mucosa ileal y gástrica es un hallazgo constante en la
sepsis. El intestino es muy sensible a la disminución de la perfusión
tisular, y el mecanismo de contracorriente hace a los villi especialmente
sensibles a la isquemia. Ciertos estudios han vinculado este fenómeno con
la disfunción orgánica progresiva, causada por la traslocación bacteriana
[1].
Tras los
estudios de Shoemaker [30, 32] se asumió que los pacientes sépticos tenían
un déficit de oxígeno, oculto o no, considerándose las elevadas cifras de
lactato presentes en ellos como un marcador de este déficit. Estas cifras
han sido usadas además para identificar a los pacientes que podrían
beneficiarse del tratamiento destinado a incrementar el transporte de
oxígeno. Sin embargo, estudios recientes sugieren que ambos postulados son
incorrectos.
La sepsis es un
estado hipercatabólico en el que hay un aumento del trasporte de glucosa
hacia la célula, con aumento de la glucólisis, la gluconeogénesis y la
glucogenolisis. La glucólisis se realiza con mayor rapidez que la
necesaria para el metabolismo oxidativo y, así, parte del piruvato
producido no puede ser metabolizado en el ciclo de Krebs, acumulándose y
convirtiéndose en lactato. Esto se considera actualmente como la causa
principal de la elevación de las cifras de lactato, hipótesis que estaría
avalada porque la relación L/P es normal en la sepsis [33], mientras que
numerosos estudios clínicos y experimentales han sido incapaces de
demostrar un aumento del consumo de oxígeno en pacientes o animales
adecuadamente resucitados con líquidos. Estos datos cuestionan la validez
científica del tratamiento encaminado a aumentar el trasporte de oxígeno
a unos niveles surpranormales en pacientes sépticos. De hecho, hay al
menos cuatro estudios que sugieren que este enfoque puede ser perjudicial
[34-37].
|
2. Tratamiento
hemodinámico |
2.1 Principios
básicos
El shock
séptico requiere una reposición de volumen rápida y vigorosa.
Recientemente, el estudio de Rivers y col. [6] demostró un aumento de la
supervivencia de los pacientes tratados agresivamente durante las primeras
seis horas, incluso antes de su ingreso en una UCI. El algoritmo utilizado
para el tratamiento de estos pacientes se muestra en la figura 1. Aunque
el modo de realizar este tratamiento precoz puede ser discutido, parece
indudable que la disminución de la mortalidad está directamente
relacionada con la agresiva y precoz reposición de líquidos. Así, la
principal diferencia entre los pacientes incluidos en el grupo de
tratamiento precoz y los controles fue una media de administración de
fluidos de unos 1.500 mL más durante las primeras seis horas [38].
El tratamiento
debería guiarse mediante parámetros que reflejen la perfusión orgánica y
tisular. Así, la reposición de volumen debe mantenerse hasta alcanzar
objetivos clínicos que reflejen el volumen intravascular. El trasporte de
oxígeno debe garantizarse manteniendo una saturación arterial y una
concentración de hemoglobina adecuadas, usando agentes vasoactivos para
alcanzar objetivos fisiológicos y clínicos.
Los pacientes
con sepsis grave o shock séptico deben tratarse en una unidad de cuidados
intensivos. Deben tener monitorizado el ECG de forma continua, así como la
pulsioximetría y la diuresis. De manera intermitente pero frecuente, deben
realizarse pruebas de laboratorio como gases arteriales, ionograma,
hemograma, estado de la coagulación y concentración de lactato. En los
estados de shock, la medición de la presión arterial mediante manguito es
poco fiable, obligando a la medición directa mediante cateterización de una
arteria. Estos catéteres también permiten medidas latido a latido, de
manera que las decisiones terapéuticas se basan en información inmediata y
reproducible. También facilitan la administración de grandes volúmenes de
líquido y de agentes vasoactivos e inotrópicos. La cateterización derecha
del corazón puede ser necesaria para la valoración de aquellos pacientes
que no han respondido adecuadamente a la reposición de volumen, ya que los
cambios hemodinámicos en el shock séptico ocurren rápidamente y la
evaluación no invasiva frecuentemente estima de manera incorrecta las
presiones de llenado y el gasto cardiaco.
2.2 Objetivos
del soporte hemodinámico en los pacientes sépticos
Dado que el
shock representa un fallo del sistema circulatorio para mantener un
adecuado transporte de oxígeno y el metabolismo oxidativo, causando
disfunción celular y orgánica, el objetivo último del tratamiento debe ser
la restauración de la perfusión tisular y la normalización del metabolismo
celular. El shock séptico es un tipo de shock distributivo y la
hipoperfusión es debida no sólo a la hipotensión, sino también a una
distribución anómala de un gasto cardiaco que suele estar aumentado. Por
tanto, el tratamiento hemodinámico debe considerar el estado de la
circulación tanto global como regional. Esta complejidad de la
hemodinámica en la sepsis hace que los objetivos terapéuticos sean mucho
más difíciles de definir que en otros tipos se shock en los que la
hipoperfusión global es la patología predominante. Para complicar aún más
las cosas, los mediadores de la sepsis pueden perturbar el metabolismo
celular, conduciendo a una utilización del oxígeno y de otros nutrientes
de forma inadecuada, a pesar de una correcta perfusión, por eso no se
puede esperar que la corrección de las alteraciones hemodinámicas corrija
totalmente esas otras alteraciones.
Aunque la
complejidad del shock séptico ha producido mucha confusión y controversia,
es posible formular una aproximación básica a su tratamiento hemodinámico,
centrándose en que los principios básicos son más importantes que las
recomendaciones específicas, que irán cambiando a medida que la
fisiopatología de la sepsis vaya siendo mejor comprendida. De esta manera,
aunque puede discutirse qué parámetros reflejan más eficazmente los
efectos del tratamiento hemodinámico, está bastante claro que esos efectos
pueden seguirse mediante una combinación de parámetros. De igual manera,
aunque los objetivos específicos sean discutibles, el principio de que
deben definirse los objetivos del tratamiento y evaluar los resultados de
manera dinámica no lo es. A pesar de la evolución del tratamiento a medida
que se conoce mejor la fisiopatología de la sepsis, la noción de que el
tratamiento debe dirigirse hacia objetivos definidos y específicos
permanece como un principio fundamental [4].
2.2.1 Índices
de perfusión global
El principal
índice de perfusión global es la presión arterial media, preferiblemente a
la sistólica, ya que refleja mejor la presión de perfusión orgánica. La
hipotensión se define por unas cifras menores a 60 mm Hg, aunque
los pacientes previamente hipertensos pueden sufrir hipoperfusión orgánica con
cifras inferiores en 40 mm Hg a su presión habitual, incluso aunque estas
sean superiores a 60 mm Hg.
Otros
indicadores de hipoperfusión global son la oliguria, la alteración del
sensorio, el retraso en el relleno capilar y la frialdad cutánea.
Aunque, debido
a que refleja también alteraciones metabólicas, las cifras de lactato
arterial no reflejan exactamente la hipoxia tisular, el aumento de su
concentración tiene un valor pronóstico comprobado. La tendencia de la
concentración de lactato es un mejor indicador que un valor aislado, y es
un indicador pronóstico más fiable que otras variables derivadas del
oxígeno [25].
La saturación
de oxígeno de la sangre venosa mixta es un indicador del balance entre el
transporte y el consumo de oxígeno. Su valor depende del gasto cardiaco,
el consumo de oxígeno, la concentración de hemoglobina, y la saturación de
oxígeno arterial. El valor normal en pacientes críticos es del 70%, pero
en la sepsis puede estar elevada debido a una mala distribución del flujo
sanguíneo. En pacientes con unas demandas de oxígeno estables, en ausencia
de hipoxia y de anemia, la disminución de la saturación venosa mixta
refleja un descenso del gasto cardiaco. Se considera que unas cifras
menores al 65% indican hipoperfusión, aconsejándose mantenerla al 70% [4].
2.2.2 Índices
de perfusión regional
Se valora la
perfusión regional mediante índices de función orgánica. Así, como signos
de hipoperfusión de los órganos correspondientes se consideran los signos
de isquemia miocárdica (miocardio), la oliguria y la elevación de las
cifras de urea y creatinina plasmática (riñón); las alteraciones de la
conciencia (encéfalo), el aumento de la concentración de transaminasas,
LDH y bilirrubina y la disminución de la concentración de albúmina y
factores de la coagulación (hígado), las úlceras de estrés, el íleo y la malabsorción (intestino).
Sin embargo,
todos estos signos pueden ser debidos también a disfunción orgánica debida
a mediadores tóxicos de la sepsis, por lo que se han buscado métodos de
medir la perfusión regional más directamente. La investigación se ha
enfocado especialmente en la circulación esplácnica por su sensibilidad a
la hipoxia y porque el incremento de la permeabilidad intestinal por la
isquemia puede causar traslocación bacteriana.
Dentro de los
métodos más sencillos para valorar la perfusión esplácnica está la
tonometría gástrica, en especial la medición de la pCO2 de la mucosa
gástrica, que se considera más fiable que el pH intramucoso, ya que éste
se artefacta con el bicarbonato arterial [26].
Debido a que la
pCO2 intramucosa está influida parcialmente por la paCO2, se ha propuesto como principal variable de interés de la
tonometría gástrica la diferencia entre ambas, a pesar de que tampoco esta
variable es una medida directa de la hipoxia de la mucosa gástrica. Aunque
la tonometría ha demostrado ser un buen predictor pronóstico en el
paciente crítico, su utilidad como guía del tratamiento en el shock
séptico no se ha demostrado. Recientemente con la capnografía sublingual,
una técnica que es menos invasiva y más fácil de usar, se han conseguido
medidas de la pCO2 tisular que se correlacionan bien con las obtenidas
mediante topometría gástrica [40].
2.3 Tratamiento
de reposición de volumen
El objetivo de
la reposición de volumen es la restauración de la perfusión tisular y la
normalización del metabolismo oxidativo. El aumento del gasto cardiaco y
del transporte de oxígeno es dependiente de la expansión de volumen. Esta
expansión debe iniciarse con bolos encaminados a conseguir objetivos
clínicos como una frecuencia cardiaca, una presión arterial media y una
diuresis mínimas. La monitorización invasiva es necesaria cuando esos
objetivos no se alcanzan rápidamente o cuando las reservas fisiológicas
del paciente están comprometidas.
Esta
administración de volumen suele conducir a una anemia con cifras de
hemoglobina entre 8 y 10 g/dL, que generalmente es bien tolerada. Pueden
ser necesarias, no obstante, transfusiones de concentrados de hematíes en
pacientes con enfermedad coronaria previa, con acidosis láctica que no
remite o con desaturación de oxígeno venoso mixto (menos del 70%). No hay
datos que permitan recomendar la transfusión para alcanzar un determinado
nivel de transporte de oxígeno.
La PVC objetivo
debe ser más elevada cuando el paciente se encuentra sometido a
ventilación mecánica para compensar los efectos de la presión
intratorácica aumentada.
No existe
consenso sobre cuál es el mejor parámetro que refleja la presión de
llenado del ventrículo izquierdo. El más fácil de obtener y que puede ser
suficiente durante las primeras horas es la PVC, aunque son ampliamente
conocidas las condiciones que la invalidan como parámetro fiable. La
presión de enclavamiento o presión capilar pulmonar ha sido empleada
durante años para la monitorización de la función del ventrículo
izquierdo, pero su valor se ha puesto en entredicho desde que un estudio
demostró un aumento de la mortalidad de los pacientes críticos asociada al
uso del catéter se Swan Ganz [27].
Este aumento,
si es que es real, puede ser debido a una mala valoración de los
factores que influyen sobre las cifras de la PCP, como la PEEP y la
presencia de patología pulmonar, como a una mala identificación de la
curva de PCP, una mala posición de la punta del catéter, distinta de la
zona 3B de West o, incluso a un mal entrenamiento en el uso de este
catéter. Recientemente se ha propuesto como nuevo índice el agua pulmonar
extravascular, ya que su medición no se afecta por la ventilación mecánica
ni por las alteraciones pulmonares, pero aún no hay estudios suficientes
en pacientes sépticos para recomendarla rutinariamente [28].
Restaurar la
presión de perfusión tisular es el objetivo inicial principal. Se
considera que una reposición de líquidos agresiva es el mejor tratamiento
inicial para la inestabilidad cardiovascular, de hecho, la hipotensión a
menudo se controla con líquidos solos. Los requerimientos líquidos
iniciales superan frecuentemente los 10 litros de cristaloides o los 4
litros de coloides en las primeras 24 horas.
Las
líneas maestras del tratamiento del shock séptico no han variado apenas
en los últimos treinta años. La primera sistematización del tratamiento
del shock séptico fue el enfoque VIP, que con modificaciones menores
continúa vigente en la actualidad. Posteriormente llamado VIP/PS, las
letras corresponden al acrónimo de "ventilation", "infusion", "pump", "pharmacological"
y "specific". Estas siglas sirven de regla mnemotécnica para la secuencia
de prioridades de maniobras diagnósticas y terapéuticas en la que se basa
el tratamiento general del shock: asegurar la ventilación y la
oxigenación, administrar líquidos para conseguir un relleno vascular
adecuado, restablecer la función cardiaca ("pump"), mejorar la perfusión
con fármacos y establecer el tratamiento específico del foco [3].
La mayoría de
los pacientes tienen un déficit de volumen intravascular importante y
requieren de gran cantidad de líquidos para normalizarlo. La repleción del
volumen en los pacientes con shock séptico produce una significativa
mejoría de la función cardiaca y del transporte de oxígeno, mejorando así
la perfusión tisular y revirtiendo el metabolismo anaeróbico. A pesar de
la depresión miocárdica inducida por la sepsis, el índice cardiaco puede
mejorar de un 25% a un 50% y en aproximadamente el 50% de los pacientes
sépticos que están hipotensos inicialmente, la administración de volumen
sola puede corregir la hipotensión y la inestabilidad hemodinámica. En la
sepsis puede haber un aumento del volumen del espacio intersticial debido
al aumento de la permeabilidad capilar, pero el relleno del tercer
espacio, que puede ser importante en el shock hipovolémico, no lo es tanto
en el shock séptico.
La importancia
práctica de la complejidad de la hemodinámica en la sepsis es que los
objetivos terapéuticos del tratamiento son mucho más difíciles de definir
que en otras formas de shock en los que la hipoperfusión global domina la
fisiopatología. En éstos, los índices de perfusión regional se
correlacionan bien con los de perfusión global, y ambos pueden usarse para
monitorizar la efectividad del tratamiento. Sin embargo, en el shock
séptico hay además una alteración del metabolismo celular que origina una
inadecuada utilización del oxígeno y de otros nutrientes a pesar de una
correcta perfusión, por lo que no se puede esperar que el tratamiento hemodinámico corrija por sí solo esas anomalías. Tampoco se puede esperar
que los índices de perfusión global reflejen lo que ocurre en los órganos
afectados. Por ello, el tratamiento debe ser controlado mediante la
monitorización de una combinación de parámetros. El relleno vascular se
puede conseguir mediante el empleo de soluciones cristaloides, coloides o
con concentrados de hematíes [4].
El tratamiento
inicial de la sepsis grave debe comenzar tan pronto como se reconozca el
síndrome y no debe ser retrasado hasta el ingreso en la UCI. La elevación
del lactato arterial identifica a aquellos pacientes no hipotensos en los
cuales ya hay hipoperfusión tisular. Durante las primeras seis horas los
objetivos iniciales deberían ser, según el trabajo de Rivers y las
recomendaciones de la SCCM [5]:
-
Una presión venosa central
de 8 a 12 mm Hg
-
Una presión arterial media
de 65 mm Hg
-
Una saturación venosa mixta
o venosa central superior al 70%
-
Una diuresis de 0,5 mL/Kg/h
Estas
recomendaciones se basan en los hallazgos de un ensayo clínico
aleatorizado publicado en 2001, en el cual se consiguió una mejora de la
supervivencia a los 28 días mediante esos objetivos [6]. El algoritmo de
tratamiento seguido en ese ensayo puede verse en la figura 1. No obstante,
en pacientes sometidos a ventilación mecánica, es recomendable ponerse
como meta una PVC más elevada (de 12 a 15 mm Hg) para contrarrestar los
efectos de una presión intratorácica más elevada. Este debe ser el
objetivo también cuando existe una presión intraabdominal elevada [4].
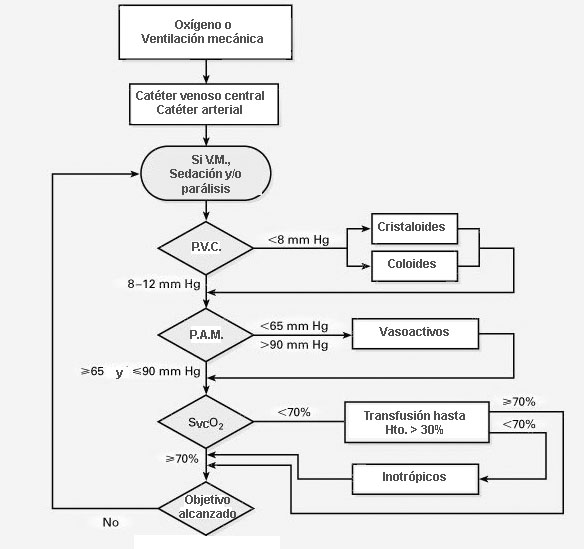
Mientras que se
considera imprescindible la medición directa de la presión arterial
mediante un catéter intraarterial, las saturaciones de oxígeno venosa
central y de cava superior se consideran equivalentes y son igualmente
aceptables las mediciones continuas y las intermitentes mediante
muestras remitidas al laboratorio, aunque estas últimas pueden obligar a
múltiples extracciones sanguíneas durante las primeras horas [5].
Se consideran
signos de efectividad del tratamiento en cuanto a relleno intravascular,
el descenso de la frecuencia cardiaca y la tendencia al descenso de los
niveles plasmáticos arteriales de lactato. En el ensayo citado estos
objetivos se procuraban alcanzar mediante la administración secuencial de
fluidos, concentrado de hematíes y dobutamina [6].
La carga
inicial de líquidos recomendadas es de 500 a 1.000 mL de cristaloides o de
300 a 500 mL de coloides durante 30 minutos, que se repiten hasta
conseguir una presión sanguínea y una diuresis adecuada o hasta que
existan signos de sobrecarga de volumen. Típicamente se necesitan unos
volúmenes de 6 a 10 litros de cristaloides o de 2 a 4 litros de coloides
[7].
Esta carga
inicial de volumen es independiente de la necesidad posterior de mantener
un alto ritmo de perfusión de líquidos, y necesita una evaluación más
estrecha de los parámetros hemodinámicos y de la situación clínica del
paciente para evitar la producción de un edema pulmonar. Debido a la venodilatación y al aumento de la permeabilidad capilar, la administración
agresiva de líquidos debe continuar frecuentemente más allá de las
primeras horas y es inevitable que se produzca un balance hídrico muy
positivo. Este balance no es de utilidad para juzgar las necesidades de
líquidos del paciente durante este periodo [4].
2.3.1 Elección de la
solución
Aunque la
controversia entre coloides y cristaloides es tan antigua como el
tratamiento del shock y existen bastante ensayos clínicos y metaanálisis
que los comparan, pocos de ellos se han hecho exclusivamente con pacientes
en shock séptico y los resultados son difíciles de valorar. Recientemente
se ha publicado el estudio SAFE, realizado con casi 7.000 pacientes
críticos que fueron resucitados aleatoriamente con suero salino o albúmina
al 4%. No se encontraron diferencias significativas entre las dos
soluciones en cuanto a mortalidad a los 28 días, aunque hubo una tendencia
a una menor mortalidad, no estadísticamente significativa, en los
pacientes sépticos tratados con albúmina al 4% [8]. Por ello, no se
recomienda un tipo de solución en especial y la elección debe basarse en
otras consideraciones, como el precio o la capacidad de que se disponga
para administrar grandes volúmenes en poco tiempo. Hay que tener en cuenta
que los coloides tienen un volumen de distribución mucho menor y que por
tanto, se necesita menos cantidad para alcanzar los objetivos.
El incremento
en el gasto cardiaco y el transporte de oxígeno es proporcional a la
expansión de volumen alcanzada. Cuando los objetivos hemodinámicos son los
mismos, ambos tipos de soluciones son igualmente efectivas, aunque se
requieren de dos a cuatro veces más volumen con cristaloides que con
coloides y el periodo de tiempo necesario para alcanzar los objetivos
hemodinámicos puede ser algo más largo.
2.3.1.1
Cristaloides
Como
cristaloides se consideran equivalentes la solución de Ringer lactato y el
suero salino al 0,9%. El lactato contenido en la solución de Ringer es
rápidamente metabolizado y no afecta significativamente al uso de las
concentraciones de lactato plasmático como marcador pronóstico. El volumen
de distribución de ambas soluciones es el compartimiento extracelular y,
en condiciones ideales, un 25% permanece en el espacio intravascular,
mientras que el resto se distribuye en el espacio extravascular. Se
calcula que un litro de cristaloides proporciona una expansión de volumen
intravascular de 100 a 200 mL. Las cantidades que son típicamente
necesarias durante las primeras 24 horas del tratamiento del shock séptico
son del rango de los 6 a los 10 litros y dan lugar a hemodilución y a
disminución de la presión oncótica plasmática.
Aunque la
experiencia en el shock séptico es limitada, se han empleado también
soluciones salinas hipertónicas que tienen la ventaja teórica de mejorar
la contractilidad cardiaca y la dilatación precapilar, aunque con el
riesgo de producir una situación de hipertonicidad [4].
2.3.2.2
Coloides
Hay varias
soluciones disponibles, pero las más empleadas son la albúmina, el plasma
fresco congelado y el hidroxietilalmidón.
La
concentración orgánica de albúmina es de 4 a 5 g/Kg, de los cuales un 40 o
45% está en el espacio intravascular y un 55 o 60% en el espacio
extravascular. En determinados casos, como en el shock séptico, puede
darse una distribución anómala. La semivida plasmática es de 19 días. Su
síntesis y catabolismo están regulados por feed-back. La eliminación es
principalmente intracelular mediante proteasas lisosómicas. Durante las
dos horas siguientes a la infusión, menos del 10% del volumen infundido
abandona el espacio intravascular en condiciones normales. Como
consecuencia, aumenta el volumen de la primera a tercera hora después de
la administración. Un litro de una solución al 5% (que tiene una presión
oncótica de 18 a 20 mm Hg) proporciona una expansión de volumen de 500 a
1000 mL. Cuando se usa a concentraciones mayores, como al 20%, la
expansión de volumen depende de la movilización de líquido del espacio
intersticial, pero esta movilización puede ser mucho menor de la esperada
en situaciones de aumento de la permeabilidad vascular, como ocurre en la
sepsis, por lo que es recomendable usarla al 5% (en el estudio SAFE se
empleó al 4%). El único preparado de albúmina disponible en España
contiene 100 mL de una solución al 20% pero normalmente, el servicio de
Farmacia hospitalaria puede hacer soluciones al 5%.
Los
hidroxietilamidones son coloides artificiales derivados de un almidón
céreo compuesto casi por completo por amilopeptina. El hidroxietilalmidón,
además de su efecto como expansor plasmático, produce un incremento del
gasto cardiaco, de la presión arterial y del índice del trabajo
ventricular. También afecta a la activación endotelial a través de
mecanismos poco conocidos. En los pacientes con sepsis reduce la
liberación de moléculas de adhesión, comparado con la albúmina, quizás por
reducción del daño y de la activación celular endotelial. Puede causar
disminución del factor VIII de manera dosis-dependiente, así como
prolongación del tiempo parcial de tromboplastina, acciones que pueden ser
debidas a dilución de factores. Puede tener efecto inmunosupresor por
depósito a largo plazo de las partículas de hidroxietilalmidón de mayor
peso molecular en el sistema retículoendotelial.
El
hidroxietilalmidón al 6% es equivalente a la albúmina al 5% en cuanto a
cantidad de líquido necesario para la resucitación hemodinámica [4].
2.3.2.3
Concentrado de hematíes
En ausencia de
otras circunstancias como una enfermedad coronaria, hemorragia o acidosis
láctica, la transfusión de concentrado de hematíes no está indicada con
cifras de hemoglobina superiores a 7 g/dL y el objetivo debería ser
mantenerlas entre 7 y 9. Esto viene avalado por un ensayo clínico que
demostró que el umbral de los 7 g/dL no se asocia con un aumento de la
mortalidad y que cifras entre 7 y 9 son adecuadas para la mayoría de los
pacientes críticos. Aunque las transfusiones aumentan el transporte de
oxígeno, esto no suele corresponderse con un aumento del consumo en los
pacientes sépticos [9, 10].
Esta
recomendación no incluye la resucitación inicial del shock séptico, en la
cual el objetivo es un hematocrito de al menos el 30% en aquellos
pacientes que tienen una saturación venosa central de oxígeno baja.
Es importante
tener en cuenta que la sangre envejecida puede ocasionar por la mayor
rigidez de sus hematíes, un descenso del pH gástrico intramucoso y puede
acentuar las anomalías reológicas presentes en la sepsis. Las
transfusiones tienen además un conocido efecto inmunosupresor.
2.3.2.4 Plasma
fresco congelado
No hay estudios
que valoren la utilidad del plasma como tratamiento volumétrico en
ausencia de alteraciones de la coagulación. Aunque las disponibilidades y
el precio del plasma varían de un país a otro, las sociedades de
hematología solo recomiendan su empleo en casos de coagulopatía con
déficits documentados de factores de la coagulación (aumento del tiempo de protrombina o del INR o del tiempo parcial de tromboplastina) y ante la
presencia de hemorragia o la necesidad de una intervención quirúrgica [4].
2.3.3
Complicaciones del tratamiento volumétrico
La infusión de
líquido en las cantidades tratadas no está exenta de riesgos. Las
complicaciones más frecuentes son los edemas pulmonar y sistémico. La
producción de estos edemas se relaciona con tres factores:
-
Aumento
de la presión hidrostática
-
Disminución de la presión oncótica
-
La
alteración de la permeabilidad vascular que se produce en el shock
séptico.
La importancia
del mantenimiento de la presión oncótica plasmática es la principal
mantenedora de la larga controversia entre coloides y cristaloides. En
estudio experimentales ya antiguos, el descenso de la presión oncótica originó un flujo de líquido hacia el espacio extracelular en los
pulmones y disminuyó el nivel de presión hidrostática necesario para que
aumentara el agua pulmonar extravascular. Estos hallazgos no han podido
reproducirse en todos los estudios clínicos que lo han intentado y parece
que no se produciría un aumento del agua pulmonar extravascular mientras
que las presión capilar pulmonar se mantenga en niveles bajos. Por ello,
cuando se necesitan elevar esas presiones para mejorar la función cardiaca
los coloides pueden tener una ventaja teórica al mitigar el flujo de
líquido al espacio extravascular.
De un 30% a un
60% de los pacientes en shock séptico desarrollan un SDRA. En esta
situación, en la que la permeabilidad vascular está aumentada, las
partículas coloidales podrían emigrar al intersticio y favorecer al
retención de líquidos en él, empeorando el edema y la función pulmonar.
Sin embargo, tampoco se ha observado esta situación teórica en los ensayos
clínicos practicados [4].
El edema
sistémico es una complicación muy frecuente en la sepsis y en el shock
séptico. Este edema puede reducir la disponibilidad celular de oxígeno al
aumentar la distancia entre de difusión del oxígeno hasta las células,
pero esto no ha sido comprobado en estudios clínicos [4].
2.4.
Vasopresores
Cuando la
administración de líquidos no consigue restaurar la presión arterial ni la
perfusión de los órganos, deben emplearse agentes vasopresores. También
pueden ser necesarios transitoriamente durante la administración de
volumen, antes de conseguir un relleno vascular suficiente, cuando la
hipotensión pone en riesgo la supervivencia. Aunque estos fármacos pueden
disminuir el flujo de sangre en algunos órganos, su efecto final depende
de la suma de sus efectos directos (vasoconstricción) y del aumento
conseguido en la presión de perfusión de los diferentes órganos afectados.
Cuando la autorregulación ha fallado, como ocurre en el shock séptico, el
flujo depende de la presión de una manera lineal y la perfusión de los
órganos comprometidos debe asegurarse mediante el aumento de la presión
arterial.
Aunque el
vasopresor puede tener además un efecto inotrópico positivo, desde un
punto de vista práctico, su acción debe titularse para conseguir una
presión arterial media suficiente sin deteriorar el volumen sistólico. Si
esto ocurriera, debe disminuirse la dosis y considerarse el uso de
dobutamina. Si es el ventrículo derecho el afectado por la perfusión del
agente vasoactivo, deben mantenerse las resistencias vasculares pulmonares
en el nivel más bajo posible compatible con la restauración de la
hemodinámica sistémica normal [13].
Durante la
perfusión de agentes vasoactivos debe prestarse particular atención a sus
efectos sobre los lechos renal y gastrointestinal. La diuresis y el
aclaramiento de creatinina aumentan normalmente a medida que aumenta la
presión arterial media, como atestiguan cierto número de ensayos clínicos.
La presión media adecuada que debe conseguirse depende de las cifras
previas del paciente y puede ser tan elevada como 75 mm Hg, sin embargo,
se aconseja mantenerla al mínimo requerido para restablecer la diuresis,
lo cual suele conseguirse con cifras entre 60 y 65 mm Hg [14].
El tracto
gastrointestinal, especialmente su lecho vascular y la integridad de la
mucosa intestinal, tienen un papel clave en la patogénesis del fallo
multiorgánico en la sepsis. El efecto de los diferentes agentes
vasoactivos sobre la circulación esplácnica varía, lo cual puede tener una
importancia teórica en la selección del fármaco.
Como agentes
vasoconstrictores se han utilizado la dopamina, la noradrenalina, la
adrenalina, la fenilefrina y la vasopresina principalmente. Sin embargo,
como fármacos de primera línea se consideran exclusivamente a los dos
primeros. No hay estudios de alta calidad que permitan recomendar una u
otra y así, la discusión sobre cual es la mejor en el shock séptico dura
ya años.
2.4.1 Dopamina
La dopamina se
introdujo en la década de 1960 y ha sido el agente vasoactivo más
ampliamente usado en las UCI desde que el trabajo de Goldberg mostró una
mejoría en la supervivencia a corto plazo en la sepsis y en el shock
cardiogénico [15].
La dopamina es
un betaadrenérgico más potente que la noradrenalina, que aumenta el gasto
cardiaco y la presión arterial mediante un aumento del volumen sistólico y
de la frecuencia cardiaca. Además, aumenta selectivamente la perfusión de
los lechos renal y esplácnico. Esta catecolamina endógena afecta a los
receptores de las catecolaminas de manera diferente de una manera dosis
dependiente. A un ritmo de perfusión de 0,5 a 2 μg/Kg/min tiene efectos
predominantemente dopaminérgicos; de 2 a 5 μg/Kg/min la acción es
predominantemente dopaminérgica (del 80% a 100%) pero empieza a haber
efectos betaadrenérgicos; de 5 a 10 μg/Kg/min los efectos son
predominantemente betaadrenérgicos y comienzan a aparecer efectos alfa y
ambos efectos están presentes a dosis entre 10 y 20 μg/Kg/min. Sin embargo,
es importante tener en cuenta que esos rangos de dosis no son valores de
corte en los cuales unos receptores se activan a expensas de otros, sino
rangos dentro de los cuales predomina un efecto u otro con amplia
variación interindividual. Además, el aclaramiento plasmático de la
dopamina es mucho menor en el paciente crítico y hay también una
considerable variación interindividual entre la correlación de los niveles
plasmáticos y la tasa de infusión [16].
La dopamina es
muy efectiva para aumentar la presión arterial media en pacientes que
siguen hipotensos tras una adecuada reposición de volumen. Dado que este
aumento se debe principalmente a un aumento del gasto cardiaco, la
dopamina puede ser especialmente útil en pacientes con función cardiaca
comprometida. Sin embargo, sus efectos taquicardizante y arritmogénico son
más prominentes que con otros vasopresores. La dopamina también aumenta la
presión capilar pulmonar, por aumento del retorno venoso, y el shunt
intrapulmonar, probablemente porque el aumento del gasto cardiaco reabre
capilares de zonas poco ventiladas.
El trabajo de
Goldberg también sugería un efecto protector sobre la función renal de las
dosis bajas de dopamina y así, este fármaco ha sido ampliamente usado en
la UCI para proteger al riñón de la hipoperfusión. Este efecto ha sido
repetidamente cuestionado a medida que se comunicaban en ensayos
realizados con voluntarios sanos cada vez más efectos adversos y hoy día
el uso de la dopamina a bajas dosis como protección renal no tiene lugar
en el tratamiento del shock [17, 18].
Datos recientes
ponen también en duda que la dopamina tenga efecto protector sobre la
perfusión esplácnica, e indican que incluso puede tener un efecto negativo
sobre el consumo de oxígeno en el área esplácnica [19].
Entre los
efectos indeseables de la dopamina que se han ido documentando a lo largo
del tiempo, destacan la supresión de la función hormonal de la hipófisis
anterior, agravando la incapacidad para el anabolismo de los pacientes
sépticos, el deterioro de la función inmune y la depresión de la actividad
de los centros respiratorios [20].
2.4.2.
Noradrenalina
La
noradrenalina es un potente agonista alfa1-adrenérgico con menor efecto
beta que la dopamina. Aumenta la presión sanguínea principalmente mediante
el aumento de las resistencias vasculares sistémicas con menores efectos
sobre la frecuencia cardiaca y el volumen sistólico que la dopamina.
Tradicionalmente se ha restringido el uso de la noradrenalina en el shock
por temor a producir una excesiva vasoconstricción que pudiera dar lugar a
una hipoperfusión de los órganos, dejándose como un vasoconstrictor de
segunda fila que se usaba cuando otros fallaban. Estos temores no se han
visto confirmados en estudios recientes y actualmente se consideran a las
dos aminas como fármacos de primera línea en el tratamiento del shock
[21, 22].
La
noradrenalina además, tiene un efecto vasopresor más potente que la
dopamina y es más efectiva que ésta para recuperar la presión arterial en
los pacientes sépticos. Produce menos taquicardia y no afecta a la función
hipofisaria ni a la respiratoria. Sólo hay un ensayo clínico aleatorizado
que compare directamente la noradrenalina con la dopamina e incluye un
bajo número de pacientes (sólo 32). En él, la noradrenalina a 1,5 μg/Kg/min
fue efectiva en un 93% de los casos para normalizar y mantener la
hemodinámica normal, mientras que la dopamina a dosis de 10 a 25 μg/Kg/min,
sólo lo fue en un 31% de los casos [41].
En pacientes
hipotensos con hipovolemia, como en el shock hipovolémico, los efectos
vasoconstrictores de la noradrenalina pueden producir isquemia renal. En
el shock séptico hiperdinámico, sin embargo, la noradrenalina tiene un
efecto mayor sobre la arteriola eferente del glomérulo que sobre la
aferente, aumentando la fracción de filtración. Así, algunos estudios han
mostrado que la noradrenalina sola o en combinación con la dobutamina,
aumenta la diuresis, el aclaramiento de creatinina y el aclaramiento
osmolar en pacientes con shock séptico [42-45].
En un estudio
se ha observado un descenso en las cifras de lactato en pacientes tratados
con este fármaco [41]. El conjunto de estos datos sugieren que la
noradrenalina no empeora la oxigenación tisular en el shock séptico y que
incluso puede mejorarla.
En cuanto a los
efectos sobre la circulación esplácnica, los datos son contradictorios,
aunque los correspondientes a los estudios más modernos muestran que, a
pesar de la reducción en el flujo esplácnico que puede producirse, el
consumo de oxígeno no varía y el pHi de la mucosa gástrica se eleva [45].
2.4.3.
Vasopresina
La vasopresina
es un vasopresor que tiene además efecto antidiurético, gastrointestinal
y termorregulador, además de estimular la secreción de corticosteroides.
A concentraciones bajas induce vasodilatación en la circulación cerebral,
coronaria y pulmonar. En el shock séptico hay un aumento precoz
transitorio de su concentración plasmática, seguido rápidamente por una
disminución a niveles muy bajos comparados con otras causas de
hipotensión. El empleo de vasopresina reduce las necesidades de otros vasopresores, aumenta la diuresis y disminuye las resistencias vasculares
pulmonares. Las dosis de más de 0,04 unidades por minuto pueden dar lugar a
efectos adversos, probablemente relacionados con vasoconstricción
excesiva. Los estudios existentes hasta la fecha son pequeños y enfocados
a objetivos fisiológicos, por lo que su empleo no se puede recomendar como
rutinario hasta que no se realicen ensayos clínicos con objetivos clínicos
como fallo de órganos o mortalidad [24].
Todos los
estudios realizados hasta la fecha menos uno han empleado como fármaco la
arginina-vasopresina humana. La lisina-vasopresina o terlipresina, que es
la vasopresina presente en el cerdo, se ha probado en un pequeño ensayo
clínico en pacientes con shock séptico refractario a las catecolaminas, a
la hidrocortisona y al azul de metileno, observándose una mejoría de la
presión arterial durante las primeras cinco horas y permitiendo la
retirada total o parcial de las catecolaminas [46].
2.4.4
Complicaciones del tratamiento vasopresor
Todas las
catecolaminas pueden producir taquicardia, especialmente en pacientes a
los que no se ha administrado un volumen de líquidos adecuado. Igualmente
pueden producir otras taquiarritmias. En pacientes con enfermedad
coronaria, la producción de vasoconstricción coronaria puede dar lugar a
un síndrome isquémico e incluso a un infarto, especialmente con la
vasopresina.
Cuando la
disfunción miocárdica es significativa, una vasoconstricción excesiva
puede dar lugar a una disminución del volumen sistólico del ventrículo
izquierdo, del gasto cardiaco y del transporte de oxígeno. Si esto ocurre,
debe disminuirse la dosis del vasopresor y considerarse el uso de
dobutamina. La vasoconstricción también puede dar lugar a isquemia de los
miembros y a necrosis distales.
La
administración de fármacos vasoactivos puede empeorar el flujo esplácnico,
dando lugar a úlceras de estrés, íleo, malabsorción e incluso necrosis
mesentérica [32]. La integridad de la mucosa intestinal es una clave en la
patogénesis del fallo multiorgánico. Debe intentar evitarse por ello los
episodios de acidosis intramucosa, que puede detectarse por un descenso
del pHi o un ascenso de la pCO2 de la mucosa gástrica, medidos
mediante tonometría gástrica, aunque no hay estudios que demuestren un
descenso de la mortalidad con el tratamiento dirigido por estas
mediciones.
2.5.
Inotrópicos
Debido a la
complejidad etiológica de la depresión miocárdica en la sepsis, su
tratamiento es también complejo. Es aconsejable la medida del gasto
cardiaco, aunque esa medida debe ser interpretada en el contexto clínico
de cada paciente. Así, aunque el shock séptico es un estado hiperdinámico,
los pacientes con patología cardiaca previa pueden tener limitada su
capacidad para aumentar el gasto cardiaco, de manera que un gasto normal o
incluso algo disminuido, puede suponer una respuesta hiperdinámica. Por
ello, el gasto debe valorarse dentro del conjunto de otros índices de
perfusión global.
Así, cuando la
hipoperfusión global se manifiesta por una saturación venosa mixta de
oxígeno disminuida, esta medida debe seguirse como índice de la eficacia
del tratamiento inotrópico. Igualmente, aunque la hiperlactacidemia de la
sepsis y el shock séptico tienen un origen complejo, el descenso de las
cifras de lactato que sigue a la instauración del tratamiento inotrópico
es un fiable índice de buen pronóstico.
Aunque los
pacientes sépticos están hipercatabólicos y pueden requerir niveles
elevados de trasporte de oxígeno para mantener su metabolismo oxidativo,
la teoría de la “dependencia patológica del oxígeno” formulada en los años
ochenta está actualmente desacreditada. Aunque el índice cardiaco y el de
transporte de oxígeno se correlacionan bien con la supervivencia, no está
claro si la mejoría en esos índices son la causa de la supervivencia o,
por el contrario, representan solamente marcadores pronósticos. Por ello,
no se recomienda elevar el índice cardiaco hasta unos valores
arbitrariamente predefinidos. Más aún, dos amplios ensayos clínicos en
pacientes con sepsis grave no han conseguido demostrar ningún beneficio
con el aumento del transporte de oxígeno hasta unos niveles supranormales
[11, 12]. El objetivo del tratamiento inotrópico debe ser mantener un
índice cardiaco adecuado, una presión arterial media y una diuresis
suficiente y una saturación venosa mixta de oxígeno que asegure la
inexistencia de hipoperfusión tisular.
Como agentes
inotrópicos, se han utilizado en el shock séptico la dopamina, la
dobutamina, el isoproterenol y la adrenalina, pero sólo los dos primeros
se consideran de utilidad actualmente, utilizándose solos o en
combinación.
La dopamina,
como se ha demostrado en varios estudios clínicos, aumenta el índice
cardiaco de los pacientes en shock séptico en un rango que va del 4% al
44%. Este aumento se hace principalmente a expensas de un aumento de la
frecuencia cardiaca y en un rango de dosis entre los 3 y los 12 μg/Kg/min. A
mayores dosis no se consiguen aumentos lineares de la función cardiaca
[47].
La dobutamina
es la mezcla racémica de dos isómeros, el isómero D con efectos
adrenérgicos β1 y β2 y el isómero L con efectos
adrenérgico α1 y β1. El efecto predominante es
inotrópico por la estimulación de los receptores β1.
Las dosis
ensayadas en el shock séptico varían entre los 2 y los 28 μg/Kg/min,
habiéndose conseguido un aumento del índice cardiaco del 12% al 61%. La dobutamina mejora la función de ambos ventrículos de manera semejante, a
diferencia de la dopamina que actúa principalmente mejorando la función
izquierda [48].
La dobutamina
no tiene influencia en la distribución del flujo sanguíneo, por lo que el
objetivo principal de su uso es aumentar la presión de perfusión en todos
los órganos, especialmente en riñones e intestino delgado.
Otros agentes
inotrópicos, como la adrenalina, el isoproterenol o algunos inhibidores de
la fosfodiesterasa han sido probados en el shock séptico, pero los
estudios son escasos y con pocos pacientes y se han usado en combinación
con otros agentes, por lo que no se pueden establecer conclusiones sobre
su utilidad.
2.5.1
Complicaciones del tratamiento inotrópico
En pacientes
sépticos en los que el tratamiento de reposición líquida ha sido
insuficiente, todos los agentes inotrópicos pueden causar taquicardia u
otras arritmias. En pacientes con enfermedad coronaria, el aumento en el
consumo de oxígeno miocárdico puede precipitar un síndrome isquémico
miocárdico. Además, una dosificación excesiva puede ocasionar una necrosis
en bandas, independientemente de la presencia de enfermedad coronaria.
La
administración de agentes inotrópicos con actividad vasopresora puede
empeorar el flujo sanguíneo en el lecho esplácnico [32, 49].
La base del
tratamiento hemodinámico del shock séptico sigue siendo una infusión
adecuada de volumen. Un estudio reciente confirma además que el comienzo
precoz de este tratamiento influye sobre la mortalidad de manera
significativa. En este estudio se aplicaron otras medidas terapéuticas,
pero la principal diferencia entre el grupo tratado y el de control fue la
cantidad de líquidos administrados durante las primeras seis horas. Los
fármacos vasopresores de elección siguen siendo la dopamina y la
noradrenalina, mientras que la dobutamina es el agente inotrópico de
elección. Aunque el tratamiento del paciente con sepsis grave o shock
séptico debe comenzarse lo antes posible, estos pacientes deben ser
ingresados en una UCI, ya que la complejidad de la monitorización que
necesitan para su tratamiento, la rapidez con que deben realizarse los
cambios en el tratamiento y la agresividad de éste, implican medios que
solo en una UCI están disponibles.
-
Marik PE,
Varon J. The hemodynamic derangements in sepsis: implications for
treatment strategies. Chest 1998;
114:
854-860.
[Texto
completo]
-
Landry DW,
Oliver JA. The pathogenesis of vasodilatory shock. N Engl J Med 2001;
345:
588-595.
[Texto
completo]
-
Sierra R. Sepsis grave y
shock séptico: aspectos etiopatogénicos, fisiopatológicos, clínicos y
terapéuticos. Tercer Congreso Internacional de Medicina Crítica en
Internet, 2001 [Texto
completo]
-
Practice
Parameters for Hemodymamic Support of Sepsis in Adult Patients Crit Care
Med 1999; 27:
639-660.
[Texto
completo]
-
Surviving
Sepsis Campaign Guidelines for management of severe sepsis and septic
shock Crit Care Med 2004; 32:
858-873. [Texto
completo]
-
Rivers E,
Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, Peterson E,
Tomlanovich M; Early Goal-Directed Therapy Collaborative Group. Early
goal-directed therapy in the treatment of severe sepsis and septic
shock. N Engl J Med
2001; 345: 1368-1377. [Texto
completo]
-
Rackow EC,
Falk JL, Fein IA, Siegel JS, Packman MI, Haupt MT, Kaufman BS, Putnam D.
Fluid resuscitation in circulatory shock: a comparison of the
cardiorespiratory effects of albumin, hetastarch, and saline solutions
in patients with hypovolemic and septic shock.
Crit Care Med 1983; 11: 839-850.
[Resumen
Medline]
-
Finfer S,
Bellomo R, Boyce N, French J, Myburgh J, Norton R; SAFE Study
Investigators. A comparison of albumin and saline for fluid
resuscitation in the intensive care unit.
N Engl J Med 2004; 350: 2247-2256. [Resumen
Medline]
-
Hebert PC,
Wells G, Blajchman MA, Marshall J, Martin C, Pagliarello G, Tweeddale M,
Schweitzer I, Yetisir E. A multicenter, randomized, controlled clinical
trial of transfusion requirements in critical care. Transfusion
Requirements in Critical Care Investigators, Canadian Critical Care
Trials Group. N Engl J Me 1999;
340:
409-417. Erratum in: N Engl J Med 1999;
340:
1056.[Texto
completo]
-
Lorente JA, Landin L, De
Pablo R, Renes E, Rodriguez-Diaz R, Liste D. Effects of blood
transfusion on oxygen transport variables in severe sepsis. Crit Care
Med 1993; 21: 1312-1318.[Resumen
Medline]
-
Gattinoni L,
Brazzi L, Pelosi P, Latini R, Tognoni G, Pesenti A, Fumagalli R. A trial
of goal-oriented hemodynamic therapy in critically ill patients. SvO2
Collaborative Group. N Engl J Med 1995;
333:
1025-1032. [Texto
completo]
-
Hayes MA,
Timmins AC, Yau EH, Palazzo M, Hinds CJ, Watson D. Elevation of systemic
oxygen delivery in the treatment of critically ill patients.
N Engl J Med 1994; 330: 1717-1722. [Texto
completo]
-
Martin C,
Perrin G, Saux P, Papazian L, Gouin F. Effects of norepinephrine on
right ventricular function in septic shock patients.
Intensive Care Med 1994; 20: 444-447. [Resumen
Medline]
-
Martin C, Eon
B, Saux P, Aknin P, Gouin F. Renal effects of norepinephrine used to
treat septic shock patients.
Crit Care Med 1990; 18: 282-285. [Resumen
Medline]
-
Goldberg LI.
Dopamine--clinical uses of an endogenous catecholamine.
N Engl J Med 1974; 291: 707-710.
-
Debaveye YA,
Van den Berghe GH.Is there still a place for dopamine in the modern
intensive care unit? Anesth Analg 2004;
98:
461-468. [Resumen
Medline]
-
Richer M, Robert S, Lebel M. Renal hemodynamics during norepinephrine
and low-dose dopamine infusions in man.
Crit Care Med 1996; 24: 1150-1156.
[Resumen
Medline
-
Power DA, Duggan J, Brady
HR.
Renal-dose (low-dose) dopamine for the treatment of sepsis-related and
other forms of acute renal failure: ineffective and probably dangerous.
Clin Exp Pharmacol
Physiol Suppl 1999; 26: S23-S28. [Resumen
Medline]
-
Neviere R,
Mathieu D, Chagnon JL, Lebleu N, Wattel F.The contrasting effects of
dobutamine and dopamine on gastric mucosal perfusion in septic patients.
Am J Respir Crit Care Med 1996;
154:
1684-1688.
[Resumen
Medline]
-
Marik PE,
Mohedin M. The contrasting effects of dopamine and norepinephrine on
systemic and splanchnic oxygen utilization in hyperdynamic sepsis.
JAMA 1994; 272: 1354-1357. [Resumen
Medline]
-
Holmes CL,
Walley KR. Bad medicine: low-dose dopamine in the ICU.
Chest 2003; 123: 1266-1275.
[Texto
completo]
-
Martin C,
Papazian L, Perrin G, Saux P, Gouin F. Norepinephrine or dopamine for
the treatment of hyperdynamic septic shock?
Chest 1993; 103: 1826-1831.
[Resumen
Medline]
-
Martin C,
Viviand X, Leone M, Thirion X. Effect of norepinephrine on the outcome
of septic shock. Crit Care Med 2000; 28: 2758-2765. [Resumen
Medline]
-
Sharma VK,
Dellinger RP; SCCM. International Sepsis Forum. The International Sepsis
Forum's controversies in sepsis: my initial vasopressor agent in septic
shock is norepinephrine rather than dopamine.
Crit Care 2003; 7: 3-5.
[Texto completo]
-
Holmes CL,
Patel BM, Russell JA, Walley KR. Physiology of vasopressin relevant to
management of septic shock.
Chest 2001; 120: 989-1002.
[Texto
completo]
-
Friedman G,
Berlot G, Kahn RJ, Vincent JL.Combined measurements of blood lactate
concentrations and gastric intramucosal pH in patients with severe
sepsis. Crit Care
Med 1995; 23: 1184-1193. [Resumen
Medline]
-
Friedman G,
Berlot G, Kahn RJ, Vincent JL.Combined measurements of blood lactate
concentrations and gastric intramucosal pH in patients with severe
sepsis. Crit Care
Med 1995; 23: 1184-1193. [Resumen
Medline]
-
Connors AF Jr, Speroff T,
Dawson NV, Thomas C, Harrell FE Jr, Wagner D, Desbiens N, Goldman L, Wu
AW, Califf RM, Fulkerson WJ Jr, Vidaillet H, Broste S, Bellamy P, Lynn
J, Knaus WA.
The
effectiveness of right heart catheterization in the initial care of
critically ill patients.
SUPPORT Investigators.
JAMA 1996; 276: 889-897. [Resumen
Medline]
-
Bindels AJ,
van der Hoeven JG, Graafland AD, de Koning J, Meinders AE. Relationships
between volume and pressure measurements and stroke volume in critically
ill patients. Crit
Care 2000; 4: 193-199. [Texto
completo]
-
Heyland DK,
Cook DJ, King D, Kernerman P, Brun-Buisson C. Maximizing oxygen delivery
in critically ill patients: a methodologic appraisal of the evidence.
Crit Care Med 1996; 24: 517-524. [Resumen
Medline]
-
Shoemaker WC,
Appel PL, Waxman K, Schwartz S, Chang P. Clinical trial of survivors'
cardiorespiratory patterns as therapeutic goals in critically ill
postoperative patients.
Crit Care Med 1982; 10: 398-403.
[Resumen
Medline]
-
Shoemaker WC,
Appel PL, Kram HB, Waxman K, Lee TS. Prospective trial of supranormal
values of survivors as therapeutic goals in high-risk surgical patients.
Chest 1988; 94: 1176-1186.
[Resumen
Medline]
-
Levy B,
Bollaert PE, Charpentier C, Nace L, Audibert G, Bauer P, Nabet P, Larcan
A. Comparison of norepinephrine and dobutamine to epinephrine for
hemodynamics, lactate metabolism, and gastric tonometric variables in
septic shock: a prospective, randomized study.
Intensive Care Med 1997; 23: 282-287. [Resumen
Medline]
-
Gammaitoni C,
Nasraway SA. Normal lactate/pyruvate ratio during overwhelming
polymicrobial bacteremia and multiple organ failure.
Anesthesiology 1994; 80: 213-216.
[Resumen
Medline]
-
Tuchschmidt J,
Fried J, Astiz M, Rackow E. Elevation of cardiac output and oxygen
delivery improves outcome in septic shock.
Chest 1992; 102: 216-220.
[Resumen
Medline]
-
Yu M, Levy MM,
Smith P, Takiguchi SA, Miyasaki A, Myers SA. Effect of maximizing
oxygen delivery on morbidity and mortality rates in critically ill
patients: a prospective, randomized, controlled study.
Crit Care Med 1993; 21: 830-838.
[Resumen
Medline]
-
Hayes MA,
Timmins AC, Yau EH, Palazzo M, Hinds CJ, Watson D. Elevation of systemic
oxygen delivery in the treatment of critically ill patients.
N Engl J Med 1994; 330: 1717-1722. [Resumen
Medline] [Texto
completo]
-
Gattinoni L,
Brazzi L, Pelosi P, Latini R, Tognoni G, Pesenti A, Fumagalli R. A
trial of goal-oriented hemodynamic therapy in critically ill patients.
SvO2 Collaborative Group. N Engl J Med 1995;
333:
1025-1032. [Resumen
Medline]
[Texto
completo]
-
Marik PE,
Varon J. Goal-directed therapy for severe sepsis. N Engl J Med 2002;
346:
1025-1026. [Resumen
Medline]
-
Marik PE.
Sublingual capnography: a clinical validation study. Chest 2001;
120:
923-927. [Resumen
Medline]
[Texto
completo]
-
Marik PE,
Sibbald WJ. Effect of stored-blood transfusion on oxygen delivery in
patients with sepsis. JAMA 1993;
269:
3024-3029. [Resumen
Medline]
-
Martin C,
Papazian L, Perrin G, Saux P, Gouin F. Norepinephrine or dopamine for
the treatment of hyperdynamic septic shock? Chest 1993;
103:
1826-1831.
[Resumen
Medline]
-
Desjars P,
Pinaud M, Bugnon D, Tasseau F. Norepinephrine therapy has no deleterious
renal effects in human septic shock. Crit Care Med 1989;
17:
426-429. [Resumen
Medline]
-
Fukuoka T,
Nishimura M, Imanaka H, Taenaka N, Yoshiya I, Takezawa J. Effects of
norepinephrine on renal function in septic patients with normal and
elevated serum lactate levels. Crit Care Med.1989;
17:
1104-1107. [Resumen
Medline]
-
Marin C, Eon
B, Saux P, Aknin P, Gouin F. Renal effects of norepinephrine used to
treat septic shock patients. Crit Care Med 1990;
18:
282-285. [Resumen
Medline]
-
Marik PE,
Mohedin M.The contrasting effects of dopamine and norepinephrine on
systemic and splanchnic oxygen utilization in hyperdynamic sepsis. JAMA
1994;
272:
1354-1357. [Resumen
Medline]
-
O'Brien A,
Clapp L, Singer M. Terlipressin for norepinephrine-resistant septic
shock. Lancet 2002;
359:
1209-1210. [Resumen
Medline]
-
Schreuder WO,
Schneider AJ, Groeneveld AB, Thijs LG. Effect of dopamine vs
norepinephrine on hemodynamics in septic shock. Emphasis on right
ventricular performance. Chest 1989;
95:
1282-1288. [Resumen
Medline]
-
Jardin F,
Sportiche M, Bazin M, Bourokba A, Margairaz A. Dobutamine: a hemodynamic
evaluation in human septic shock. Crit Care Med 1981;
9:
329-332.
[Resumen
Medline]
-
Day NP, Phu NH,
Bethell DP, Mai NT, Chau TT, Hien TT, White NJ.The effects of dopamine
and adrenaline infusions on acid-base balance and systemic haemodynamics
in severe infection. Lancet 1996;
348:
219-223. [Resumen
Medline]
-
Hollenberg SM,
Ahrens TS, Annane D, Astiz ME, Chalfin DB, Dasta JF, Heard SO, Martin C,
Napolitano LM, Susla GM, Totaro R, Vincent JL, Zanotti-Cavazzoni S.
Practice parameters for hemodynamic support of sepsis in adult patients:
2004 update. Crit Care Med 2004;
32:
1928-1948. [Resumen
Medline]
Ramón Díaz-Alersi Roseti
Hospital Puerto Real, Cádiz
©REMI,
http://remi.uninet.edu. Noviembre 2004.
Palabras clave:
Sepsis, Sepsis grave, Shock séptico,
Tratamiento hemodinámico, Dopamina, Dobutamina, Noradrenalina,
Vasopresina, Albúmina, Fluidoterapia.
Busque en REMI con Google:
Envía tu comentario para su
publicación |