|
N. meningitidis fue descubierta en
1887 por Anton Weiselbaum, quien inicialmente le dio el nombre de
Diplococcus intracellularis, aunque probablemente su existencia sea
mucho más antigua. La primera descripción clínica de la meningitis
meningocócica se debe a Vieusseux, en 1905.
Es un diplococo Gram-negativo aerobio, que
coloniza la mucosa nasofaríngea humana sin provocar enfermedad con mucha
frecuencia. Se clasifica atendiendo a las diferencias estructurales de
diversos componentes: capsulares, proteínas de la membrana externa,
porinas y lipopolisacárido. Solemos utilizar la clasificación más
sencilla, atendiendo a los serogrupos, categorización imperfecta porque no
tiene en cuenta el fenómeno de transferencia genética que permite el
intercambio interbacteriano de genes para la síntesis capsular, pero es
útil en la práctica clínica. Las técnicas y clasificaciones más
sofisticadas tienen su aplicación en el campo de la investigación
epidemiológica. Más del 90% de los casos de enfermedad meningocócica se
deben a 5 serogrupos: A, B, C, Y o W-135.
N. meningitidis es una de las
principales causas de meningitis bacteriana, sepsis grave y shock séptico
en todo el mundo, si bien la mayoría de las infecciones por este
microorganismo únicamente conducen a un estado de portador asintomático.
Se estima que alrededor del 10% de la población en circunstancias no
epidémicas es portadora de este microorganismo [1],
existiendo una importante variación según la edad de los pacientes: menos
del 3% en niños menores de 4 años, del 24 al 37 % en jóvenes de 15 a 24
años, e inferior al 10% en los pacientes de edad avanzada
[2]. Las tasas de
colonización aumentan en entornos cerrados, como estructuras militares,
universidades y convivientes de casos primarios. El estado de portador
puede ser transitorio, de mayor o menor duración, crónico o intermitente.
Dado que el meningococo es un patógeno
humano estricto, se cree que la principal fuente de infección son los
portadores asintomáticos. La transmisión se realiza de persona a persona,
a través de las secreciones respiratorias.
Causa enfermedades esporádicas, brotes
generalmente impredecibles comunitarios y más raramente nosocomiales
[3,
4,
5,
6,
7], así como grandes
epidemias. Actualmente, en los países económicamente desarrollados la
mayoría de los casos esporádicos y epidémicos se deben a los serogrupos B
y C. Las epidemias recurrentes en África subsahariana y otras regiones
desfavorecidas suelen estar causadas por microorganismos del serogrupo A.
Según estimaciones de la Organización
Mundial de la Salud (OMS), anualmente se declaran hasta más de 500.000
casos de enfermedad meningocócica, y se producen al menos 50.000
fallecimientos en todo el mundo. Estas cifras son variables y se
incrementan dramáticamente ante la existencia de una gran epidemia. En los
países no industrializados, sobre todo en el llamado “cinturón de la
meningitis subsahariano” las epidemias de enfermedad meningocócica son
frecuentes y de gran magnitud. Durante los diez primeros meses del año
2000, solamente en África se comunicaron más de 40.000 casos de enfermedad
meningocócica [8].
La incidencia anual globalmente hablando de
los casos esporádicos es de 1 a 2 casos por 100.000 habitantes, aunque en
determinadas regiones como el África subsahariana la incidencia de los
casos aislados es mayor. En Europa es de 1-3 casos por 100.000 habitantes
y en España, donde representa la causa más frecuente de meningitis
bacteriana, se han declarado 2,34 casos por 100.000 habitantes en la
temporada 2002-2003 [9].
La incidencia en los brotes y en los casos relacionados se sitúa en 5 a 10
casos por 100.000, y en las epidemias y pandemias se dispara desde 10
hasta
más de 1.000 casos por 100.000.
La mayor tasa de ataque se da en los 3 a 9
meses de vida, con 10 a 15 casos por 100.000 por año, existiendo un
segundo pico de incidencia en los adolescentes. El entorno socioeconómico
desfavorable parece ser un factor de riesgo para desarrollar la
enfermedad, probablemente por ser más frecuente el hacinamiento
[10,
11,
12]. También se
cree que la exposición al humo del tabaco puede ser un factor de riesgo.
Los brotes y epidemias se han producido sobre todo en épocas en que existe
una alta incidencia de infecciones virales y en el caso del cinturón
subsahariano con la estación seca. La tasa de ataque secundaria en los
contactos es de 400 a 1.000 por 100.000 cohabitantes. En los centros
escolares la cifra es mucho menor, de 2 a 4 por 100.000 expuestos.
Generalmente los casos secundarios surgen en las dos primeras semanas tras
la detección del caso índice, pero pueden aparecer incluso meses después.
Durante los años ochenta del siglo pasado,
el serogrupo predominante en España fue el B. En la década posterior (a
partir de 1995) asistimos a un aumento en la incidencia de la enfermedad
en general y en la debida al serogrupo C en particular, si bien con
importantes variaciones interregionales [13].
Este aumento en la incidencia del serogrupo C llevó a la difusión de la
vacunación, primero con una vacuna polisacárida A+C en 1997 y
posteriormente en el 2000, con una vacuna conjugada frente al C, de mayor
efectividad.
La mayoría de las cepas recuperadas de
pacientes pertenecen a un número limitado de clones, mientras que las
procedentes de portadores tienen una gran diversidad genotípica, siendo
sólo unas pocas invasivas. En estos portadores, la colonización
orofaríngea adicional con otros microorganismos patógenos o comensales
puede inducir al intercambio genético, resultando en la aparición de
nuevas cepas de meningococo hipervirulentas [14].
El meningococo colonizador es internalizado
por las células no ciliadas de la mucosa. En ocasiones, por motivos aún no
aclarados, N. meningitidis invade la submucosa, pudiendo surgir la
bacteriemia y la diseminación metastásica, y con ellas las diferentes
formas clínicas de la enfermedad meningocócica.
Existe una importante investigación sobre
los factores de virulencia, básica para el desarrollo de nuevas
estrategias terapéuticas y de inmunización. Probablemente el principal
componente patogénico es la cápsula polisacárida, que proporciona al
meningococo protección antifagocítica y antibactericida. Otros factores
relevantes son: las proteínas de la membrana externa facilitadoras de la
adhesión, porina PorA y PorB; el lipooligosacárido que contiene el lípidoA
o endotoxina. Esta endotoxina es un mediador en el proceso de inducción de
citocinas con una potente acción proinflamatoria. Además de este efecto
indirecto, el meningococo invade directamente el endotelio que una vez
activado sintetiza factores procoagulantes y proadherentes.
|
4. Manifestaciones
clínicas |
La manifestación más frecuente de la
infección meningocócica es el estado de portador asintomático.
La enfermedad meningocócica se presenta
fundamentalmente como meningitis y sepsis, siendo actualmente la principal
causa de sepsis en niños en España. La neumonía es una forma clínica poco
frecuente, más incidente en adultos que en niños, generalmente descrita en
casos de transmisión nosocomial y de infección secundaria del personal
sanitario, cuya incidencia real no es bien conocida. Con mucha menor
frecuencia se han comunicado infecciones por N. meningitidis en
forma de bacteriemia persistente, bacteriemia transitoria asintomática,
exantema aislado no hemorrágico, y formas localizadas como parálisis de
nervios craneales aislada, epiglotitis, otitis, endocarditis,
pericarditis, conjuntivitis, artritis, endoftalmitis, osteomielitis,
uretritis y peritonitis.
Los pacientes con meningitis pueden haber
tenido un período prodrómico de 24 horas o más, siendo los síntomas
respiratorios de vías altas muy frecuentes. Los datos neurológicos son
superponibles a los de la meningitis bacteriana aguda de cualquier
etiología, salvo que coexista con meningococemia no transitoria y
aparezcan las características lesiones hemorrágicas. Un 10% de los
pacientes sufren también artritis secundaria a invasión articular directa.
El 10-30% de los pacientes sufren
meningococemia sin meningitis aparente. La coagulación intravascular
diseminada produce púrpura fulminante en hasta el 20% de los pacientes,
con consecuencias dramáticas (amputaciones y discapacidad funcional
permanente). Los pacientes con púrpura meningocócica sin evidencia de
infección meníngea tienen en general un peor pronóstico. La práctica
totalidad de los fallecidos por meningococemia fulminante tienen
hemorragias adrenales. Parece que la insuficiencia suprarrenal absoluta
“síndrome de Waterhouse-Friderichsen” es mucho menor que el déficit
parcial.
Algunos pacientes sufren una rara forma de
meningococemia crónica durante semanas o meses, que dejada a su evolución
puede en algún momento ocasionar meningitis aguda o sepsis fulminante.
Incluso con las mejores estructuras
sanitarias, fallecen alrededor del 10% de los pacientes y entre el 20-40%
de quienes desarrollan shock. Hasta el 15% de los pacientes que sobreviven
sufren secuelas neurológicas, como pérdida de audición, trastornos del
lenguaje, retraso mental o parálisis; o amputaciones de diversa
consideración. En España, las tasas de mortalidad varían entre regiones y
según la gravedad, pero en general se comunican tasas inferiores al 10%
[15].
La identificación precoz de la sepsis
meningocócica, el tratamiento precoz y adecuado y la posterior atención de
los pacientes graves en una unidad de cuidados intensivos son factores que
parecen asociarse de forma independiente con un mejor pronóstico
[16,
17].
Para intentar predecir la evolución de estos
pacientes se han aplicado diferentes escalas de gravedad tanto generales
como específicas, como el Paediatric Index of Mortality (PIM), la
Glasgow Meningococcal Septicaemia Prognostic Score (GMSPS) o la
Malley Score, que en general poseen una capacidad de predicción
inferior al 85%. Castellanos-Ortega y col. [18,
19] propusieron recientemente una
nueva escala específica para niños con sepsis meningocócica ingresados en
UCI pediátricas, que puede tener una buena capacidad predictiva. En el
análisis retrospectivo de los pacientes de 14 centros españoles los
autores encontraron que el desenlace de muerte podía predecirse de forma
fiable mediante la combinación de una serie de factores: cianosis,
puntuación de escala de Glasgow inferior a 8, hipotensión refractaria,
oliguria, leucopenia menor de 4.000 leucocitos/mm3, tiempo parcial de tromboplastina activado superior a 1,5 veces el control y exceso de bases
inferior a -10 mMol/L. Este esfuerzo
por encontrar escalas adecuadas pero a la vez sencillas de aplicar es
fundamental, sobre todo cuando disponemos de opciones terapéuticas con
riesgos asociados no desdeñables, cuya indicación aún es incierta, y que
por lo tanto exigen una correcta delimitación de los pacientes que con
mayor posibilidad se beneficiarán de su administración.
En un reciente estudio en pacientes adultos
ingresados en una Unidad de Cuidados Intensivos con meningitis bacteriana
aguda la gravedad registrada mediante la escala APACHE II en las primeras
24 horas fue el principal factor pronóstico y el único que demostró una
asociación independiente con los desenlaces adversos en el análisis
multivariante [20].
|
6. Diagnóstico
de las infecciones por meningococo |
El diagnóstico de la infección meningocócica
a menudo es difícil. La sospecha de meningitis se basa en la presencia de
síntomas y signos de infección, fundamentalmente fiebre, irritación
meníngea y afectación del sistema nervioso central. Sin embargo, esta
combinación sólo aparece en un tercio de los pacientes. Muchos enfermos
tienen patrones atípicos de presentación, siendo la disminución de
conciencia el más frecuente de ellos [21].
Las manifestaciones clínicas iniciales de la
sepsis meningocócica a menudo son inespecíficas, sobre todo en los niños
más pequeños. Los pacientes tienen con frecuencia: síntomas digestivos,
como náuseas, vómitos y dolor abdominal; mialgias; y semiología
cardiovascular según la gravedad. El exantema petequial o equimótico
resulta característico, pero no patognomónico ni universal y en cualquier
caso es tardío.
Los datos de laboratorio tampoco son
específicos. Suele haber trombocitopenia, elevación de los reactantes de
fase aguda, como la proteína C reactiva y dímero D. Sin embargo en los
casos más graves a veces la velocidad de sedimentación globular y la
proteína C reactiva sérica pueden ser normales o sólo ligeramente
elevadas.
La procalcitonina sérica está actualmente en
investigación como marcador precoz de la infección bacteriana localizada
incluyendo la meningitis [22,
23,
24], así como de la
sepsis en general y de la meningocócica en particular. De momento, los
resultados de los distintos estudios sobre infecciones en neonatos son
contradictorios, lo que se explica en parte por la heterogeneidad de los
pacientes incluidos en los trabajos publicados hasta la fecha
[25]. En los niños
la procalcitonina parece ser un buen índice diagnóstico y pronóstico de
infecciones bacterianas invasoras graves (sepsis, shock séptico o
meningitis) [26],
pero está aún por confirmar que su valor para distinguir entre SRIS (no
infeccioso) y sepsis sea superior al que pueda tener por ejemplo la
proteína C reactiva [27,
28].
El diagnóstico definitivo se obtiene mediante
el aislamiento del meningococo en el líquido cefalorraquídeo (LCR), la
sangre o el líquido sinovial, o por la detección de su ADN en líquidos
estériles.
Las técnicas de amplificación genómica no se
realizan rutinariamente, al carecer de utilidad en el manejo inicial.
Podrían tener indicación en casos en los que se precisa confirmación
diagnóstica no obtenida por otros métodos, por ejemplo por la desventaja
que pudiera entrañar el mantener un tratamiento antibiótico sin
diagnóstico microbiano en un determinado paciente. La tinción de Gram del
LCR detecta el microorganismo en el 85% de los casos, mientras que la
técnica de aglutinación para la detección del polisacárido capsular es
menos sensible, pero no parece afectarse por el tratamiento antibiótico,
como tampoco lo hacen los métodos de amplificación mediante la reacción en
cadena de la polimerasa (PCR), que aportan una elevada sensibilidad.
Idealmente, la punción lumbar (PL) se debe
realizar de inmediato sin que las pruebas de imagen previas hagan diferir
el inicio del tratamiento, salvo que se sospeche una lesión focal con
riesgo de producir herniación. La actitud más indicada es realizar una
rápida exploración neurológica, incluyendo la valoración del nivel de
conciencia, un fondo de ojo y la búsqueda de signos focales (hemiparesia,
disfasia, lesión de pares craneales). La existencia de signos focales,
edema de papila o disminución de conciencia, obliga a la realización de TC
urgente sin contraste, inmediatamente después de administrar una primera
dosis de manitol, dexametasona y antibiótico, por ese orden. La
realización de pruebas de imagen no debe diferir en ningún caso el inicio
del tratamiento antibiótico [21]. Un estudio reciente en adultos
identificó una serie de características clínicas que se asociaban
consistentemente con alteraciones en la TC [29]
y cuya detección, por tanto, sería indicación (grado de evidencia IIB)
para realizar TC tras administrar la combinación terapéutica mencionada
[30].
Las técnicas de imagen se usan principalmente
para descartar otras lesiones que pudieran ser la causa de signos
neurológicos focales o de disminución del nivel de conciencia, o cuando el
curso clínico ha sido subagudo o crónico. La existencia de lesiones
focales, como abscesos cerebrales, encefalitis y otras lesiones, aumenta
el riesgo de herniación cerebral, por lo que su hallazgo constituye una
contraindicación relativa a la realización de PL. El realizar
sistemáticamente pruebas de imagen en la atención inicial al paciente con
sospecha de meningitis aguda tiene el inconveniente de retrasar la punción
lumbar, poniendo al paciente en riesgo de demora del inicio del
tratamiento antibiótico, o llevando a iniciar éste antes de obtener LCR,
haciendo más probable la negatividad de los cultivos. Las técnicas de
imagen están indicadas antes de la realización de la PL en pacientes con
fiebre prolongada, signos o síntomas neurológicos focales, evidencia de
aumento de presión intracraneal (disminución de conciencia, edema de
papila). Después de la PL están indicadas para evaluar las puertas de
entrada y la presencia de focos parameníngeos, como senos paranasales,
otitis, mastoiditis o fracturas de base de cráneo. Además son útiles para
la detección de complicaciones de la meningitis bacteriana, como
hidrocefalia, infartos cerebrales, abscesos cerebrales, empiema subdural,
y trombosis de senos venosos (fig 1) [21].
Fig. 1.
Procedimiento diagnóstico-terapéutico inicial [21]
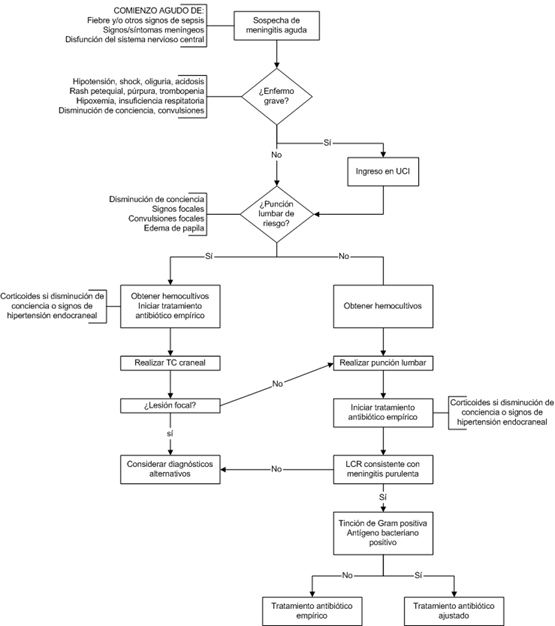
|
7. Tratamiento
de las infecciones por meningococo |
7.1. Tratamiento antibiótico empírico
La meningitis aguda meningocócica (y de otra
etiología) puede tener un curso fulminante. El inicio precoz del
tratamiento antibiótico empíricamente antes de que se desarrolle el
proceso inflamatorio sistémico puede ser un factor determinante de la
supervivencia y de la morbilidad. La principal dificultad es lograr el
reconocimiento precoz de la infección en los pacientes con síntomas y
signos clínicos inicialmente sutiles y/o inespecíficos.
Si el paciente presenta lesiones purpúricas
o alteraciones de conciencia de comienzo agudo, está indicada la
administración de una primera dosis de antibiótico (ceftriaxona o
cefotaxima) de forma inmediata, ambulatoria si es preciso, sin esperar al
traslado o a la toma de cultivos. Podemos hacer numerosas objeciones a
esta recomendación, entre otros motivos, por la posibilidad de
diagnósticos falsos positivos y el enmascaramiento del proceso real del
paciente. Es cierto que numerosas enfermedades a menudo virales y poco
importantes pueden cursar con exantema petequial y fiebre, pero ante un
niño con fiebre y petequias parece razonable considerar que tiene
meningococemia hasta descartarlo. La crítica más importante a esta
indicación es la baja rentabilidad de las pruebas microbiológicas en
muestras obtenidas tras iniciar el tratamiento, que puede dificultar el
tratamiento, habiéndose relacionado el tratamiento inadecuado en la
infección en general y en la sepsis en concreto con un peor pronóstico. Se
ha publicado que tras la administración parenteral de antimicrobianos, el
LCR se esterilizaría en unas 2-3 horas e incluso más rápido (en el caso
del meningococo en menos de 1 hora). Sin embargo, la mayoría de los datos
sobre los cultivos de LCR falsamente negativos proceden de estudios in
vitro o de estudios clínicos retrospectivos [31,
32,
33]. En un estudio
prospectivo se concluye que la probabilidad de negativización de las
pruebas microbiológicas aumenta con el pretratamiento, pero también que
las características citológicas y bioquímicas no se alteran
significativamente [34].
En otros estudios, mediante PCR se ha visto que la proporción de
aislamiento del ADN de N. meningitidis en LCR en los pacientes
tratados y los no tratados prehospitalariamente es similar, por lo que en
caso de duda y si resulta imprescindible aclarar el diagnóstico, una
prueba basada en PCR podría resolver la incertidumbre
[35].
Procurar obtener la confirmación
microbiológica es una recomendación firme, pero no tenemos evidencia
definitiva de que no obtener un diagnóstico microbiológico cierto incida
desfavorablemente en el pronóstico de los enfermos con enfermedad
meningocócica [36].
Ante un cuadro compatible con meningitis o sepsis grave meningocócica
parece lógico recomendar el inicio precoz de la antibioticoterapia
simultáneamente con las medidas de resucitación incluso sin
haber obtenido muestras para el diagnóstico, si ello supone demorar el
tratamiento más allá de una hora después de haber hecho el diagnóstico
clínico [37,
38,
39,
40,
41,
42,
43]. Las últimas
pautas de actuación clínica sobre sepsis y shock séptico nacidas del
consenso de once sociedades científicas instan, ante un cuadro de sepsis
grave/shock séptico de cualquier etiología, a iniciar la
antibioticoterapia empírica apropiada dentro de la primera hora con un
grado de evidencia de tipo E (opinión de
expertos) [44].
En los casos más leves no se pueden hacer
recomendaciones universales por ser los estudios de calidad moderada o
baja. De momento, hay que individualizar la decisión según el grado de
sospecha, la situación clínica de cada paciente y la disponibilidad de los
medios diagnósticos (por ejemplo, no en todos los hospitales pueden
realizarse Gram de LCR a cualquier hora del día).
En el ámbito hospitalario, en principio, no
debería haber impedimento para obtener al menos dos muestras para
hemocultivos rápidamente antes de la administración del antibiótico. En
cuanto a la PL y la obtención del LCR, reiterar que deberá realizarse
siempre que no suponga demorar el tratamiento.
Hasta la obtención de un dato
microbiológico, el tratamiento debe tener en consideración la edad del
paciente y sus factores de riesgo (enfermedades, situación inmune, etc.),
la posible puerta de entrada y otros datos epidemiológicos del entorno
que puedan aportar alguna información (existencia de un brote en la
comunidad, etc.). Según esto pueden recomendarse unas pautas iniciales
(tabla I):
|
Tabla I: Tratamiento empírico en
la sospecha de meningitis bacteriana
|
| |
|
Edad y/o factor predisponente |
Antibióticos |
|
0-4 semanas |
Ampicilina§ + cefotaxima |
|
4-12
semanas |
Ampicilina§ + cefotaxima + vancomicina* |
|
3 meses a
50 años |
Ceftriaxona o cefotaxima + vancomicina* |
|
Más de 50
años |
Ampicilina§ + ceftriaxona o cefotaxima + vancomicina* |
|
Alteración
de la inmunidad celular |
Ampicilina§ + ceftazidima o cefepima + vancomicina* |
|
Neurocirugía, trauma craneal, derivación de LCR |
Vancomicina*,¥ + ceftazidima o cefepima |
|
[§] La ampicilina se añade empíricamente en los grupos de pacientes con
riesgo de infección por Listeria. [*] La vancomicina se añade
empíricamente en áreas en que existe una tasa elevada de S. pneumoniae
resistente a penicilina, como ocurre en España, y [¥] cuando hay riesgo
de infección por S. aureus resistente a meticilina. |
|
|
|
|
Dosis y vía de administración de los antimicrobianos: Cefotaxima: 300 mg/kg/día, en 4-6
dosis, iv
Ceftriaxona: 4 g/día, en 1-2 dosis, iv
Ampicilina: 2 g/4 h, iv
Ceftazidima: 2 g/6-8 h, iv
Cefepima: 2 g/8 h, iv
Meropenem: 2 g/8 h, iv
|
|
|
7.2. Tratamiento antibiótico guiado por el Gram y los otros datos del
LCR (tabla II)
En nuestro medio, en paciente
inmunocompetentes con sospecha de meningitis comunitaria y sin
contraindicaciones alérgicas o de otro tipo, generalmente se inicia
tratamiento empírico con una cefalosporina de tercera generación (cefotaxima o ceftriaxona) y vancomicina. Si en el Gram se observan cocos
Gram negativos, con alta probabilidad se tratará de una infección
meningocócica y puede retirarse la vancomicina.
Salvo evidencia microbiológica o clínica que
haga recomendable o necesario modificar la pauta elegida empíricamente,
ésta se mantendrá durante 7 días. Sin embargo, la duración del tratamiento
como en muchas infecciones, es una recomendación en cierto modo
arbitraria. Se han publicado estudios en los que se obtienen similares
tasas de curación clínica y microbiológica con tratamientos más cortos, de
4-5 días, en pacientes con meningitis y/o sepsis meningocócica, sin
detectarse recidivas ni poderse atribuir muertes directas al uso de una
pauta corta. Esta actitud no puede recomendarse sistemáticamente, sobre
todo en los pacientes más graves, pero es una vía a tener en cuenta cuando
no hay otra posibilidad, como por desgracia sucede en regiones del mundo
con escasos recursos sanitarios y extensas y prolongadas epidemias
[45,
46,
47,
48].
Ante una tinción de Gram negativa o no
diagnóstica y un LCR con datos analíticos de meningitis bacteriana o
indeterminada, en principio debe mantenerse el tratamiento antibiótico
mientras se insiste en la investigación etiológica.
|
Tabla II: Tratamiento antibiótico
empírico teniendo en cuenta los resultados de la tinción de Gram
|
| |
|
Tinción de Gram |
Microorganismo sospechado |
Antibiótico recomendado |
|
Cocos Gram + |
S. pneumoniae |
Ceftriaxona o cefotaxima + vancomicina |
|
Cocos Gram - |
N. meningitidis |
Ceftriaxona o cefotaxima |
|
Bacilos Gram + |
L. monocytogenes |
Ampicilina + aminoglucósido |
|
Bacilos Gram - |
Enterobaceteriaceae, Pseudomonas |
Cefalosporina de amplio espectro† + aminoglucósido |
|
|
|
|
|
[†] En general, ceftriaxona o cefotaxima. Ceftazidima o cefepima cuando
es probable la infección por Pseudomonas (casos hospitalarios,
procedimientos neuroquirúrgicos, etc.). |
|
|
7.3. Tratamiento antibiótico una vez llega el cultivo
¿Debe
modificarse la elección empírica?
El tratamiento se modificará si es necesario
en función de los resultados de las técnicas rápidas de diagnóstico
(aglutinaciones y tinción de Gram), y de los resultados del cultivo y
antibiograma.
En el caso del meningococo, será difícil que
deba cambiarse de fármaco por resistencias si hemos optado por cefotaxima
o ceftriaxona. Lo que sí es prudente es retirar la vancomicina si la
hubiéramos pautado, tanto si se confirma la infección meningocócica, como
si se trata de un neumococo sensible a cefotaxima.
En el caso de que no se haya recuperado un
microorganismo, será la evolución clínica y bioquímico-citológica del LCR
la que oriente sobre la actitud terapéutica. Cuando no se obtiene una
respuesta a las 48 horas de haber iniciado el tratamiento, puede estar
indicado realizar una nueva punción lumbar, sobre todo si se ha
administrado dexametasona como adyuvante, por la posibilidad de un retardo
en la erradicación microbiológica en el LCR.
7.4. Tratamiento específico
Sensibilidad y resistencias de N. meningitidis
La penicilina G (18-24 millones de U al día)
intravenosa fue el tratamiento de elección de la meningitis meningocócica
hasta que la resistencia de N. meningitidis se convirtió en un fenómeno
frecuente.
Desde la década de los ochenta del siglo XX,
comenzaron a detectarse en todo el mundo cepas de Neisseria meningitidis
con sensibilidad disminuida a la penicilina. De momento, las resistencias
comunicadas son habitualmente intermedias (concentración mínima
inhibitoria, CMI, de 0,12 mg/L a 1 mg/L), y más infrecuentemente de alto
nivel [49].
En España, uno de los primeros países en alertar de este problema, un alto
porcentaje de las cepas aisladas (media del 30% de los aislamientos,
siendo en algunos estudios superiores al 50% de las cepas) poseen unas CMI
de penicilina superiores a 0,12 mg/L [50].
Hay varias hipótesis que tratan de explicar la aparición de esta
resistencia parcial. El intercambio horizontal de material genético entre
N. meningitidis y otras especies comensales de Neisseria con una marcada
resistencia a penicilina puede tener un papel etiológico.
El mecanismo de resistencia fundamental está
mediado cromosómicamente (codificado por el gen penA), y se traduce en un
cambio estructural en las proteínas fijadoras de penicilina (Penicillin-Binding
Proteins, PBP), con mayor frecuencia la 2 y la 3. Suele conferir
resistencia de bajo nivel, aunque la disminución de la afinidad por la PBP
1 puede condicionar mayores CMI. La disminución en la expresión de la
porina de clase 3 también podría causar una resistencia moderada o alta
[51].
La resistencia mediada por plásmidos y de alto nivel a β-lactámicos por
producción de β-lactamasas es un fenómeno muy infrecuente aún, aunque
posible.
Por ahora, prácticamente todas las cepas con
sensibilidad reducida a la penicilina, incluso aquellas con CMI > 1 mg/L,
permanecen sensibles in vitro a las cefalosporinas de tercera generación,
con CMI50 e incluso CMI90 muy bajas. En España, casi el 100% de las cepas
estudiadas, tanto del serogrupo C como de otros serogrupos, procedentes de
aislamientos clínicos y de portadores asintomáticos, son sensibles a
ceftriaxona y cefotaxima [52].
En otros países, la situación parece ser similar
[53,
54,
55].
Por eso, estas cefalosporinas de tercera generación continúan siendo los
antibióticos de elección en el tratamiento de la infección meningocócica.
Sin disponer de Gram de LCR, las pautas recomendadas en la tabla I, en
principio garantizan la cobertura del meningococo.
Meropenem intravenoso, a dosis de 1 g/8 h,
podría ser una opción adecuada al poseer una excelente actividad in vitro,
con un 100% de cepas de N. meningitidis sensibles
[56].
En cuanto a otras alternativas, no disponemos de evidencia clínica que
nos permita realizar recomendaciones definitivas, ya que no se han
realizado, por razones éticas, ensayos
aleatorizados que comparen cefalosporinas de tercera generación con
antibióticos “clásicos” o “nuevos”.
Un reciente metaanálisis de la Cochrane
concluye que la combinación de cloranfenicol y ampicilina puede ser tan
eficaz como la ceftriaxona [57],
si bien los estudios incluidos en la revisión son antiguos y eluden el
problema de la resistencia, que hasta hace poco era impensable en el caso
del cloranfenicol. Aún no parece ser un fenómeno frecuente, pero en
Francia y Vietnam se detectaron hace años cepas del serogrupo B con alto
nivel de resistencia por la producción de una acetiltransferasa [58].
Posteriormente, ha habido otras comunicaciones de resistencias con una
frecuencia de aislamiento realmente baja [59].
Hasta ahora, en el continente africano donde este antibiótico es utilizado
extensamente no se han detectado casos de resistencia de alto nivel a
cloranfenicol [60],
aunque las cepas africanas en las que se ha investigado este tipo de
resistencia no eran del serogrupo B, sino del A [61].
Es posible además que exista una infradetección por motivos estructurales,
y en cualquier caso la presión ejercida por el uso de cloranfenicol puede
llevar al desarrollo de resistencia a este antibiótico, que junto a las quinolonas (ciprofloxacino) y ampicilina, es una de las pocas alternativas
terapéuticas económicamente accesibles. En otros países del mundo, como
España, donde su uso es ocasional, es una opción a considerar en pacientes
que no pueden recibir cefalosporinas de tercera generación.
También hay alguna descripción de
resistencia intermedia o de alto nivel a otros antibióticos como
rifampicina [62,
63,
64],
pero en general la resistencia (salvo en lo que concierne a la penicilina)
es infrecuente aún; no es un microorganismo que cause grandes dificultades
en este sentido.
Las fluorquinolonas mantienen una buena
actividad frente al meningococo, y las nuevas, como moxifloxacino o gatifloxacino
poseen además una buena actividad frente a S.
pneumoniae. Su capacidad de penetración en el LCR es adecuada, por lo que
en principio podrían ser una alternativa. El mayor problema sería el de
delimitar sin dudas la incidencia y gravedad de los efectos tóxicos en la
población infantil, tema éste controvertido en la actualidad
[65].
En España se ha descrito ya una cepa de meningococo serogrupo B aislada
en el LCR de un niño con meningitis, con sensibilidad disminuida a
ciprofloxacino [66].
Previamente sólo se habían comunicado otros dos casos. La principal
preocupación es la posible emergencia de resistencia de N. meningitidis a fluorquinolonas de forma similar a cómo ha sucedido con
N. gonorrheae,
sobre todo teniendo en cuenta el uso inadecuado que con frecuencia se hace
de los antimicrobianos, y en este sentido hay que destacar que las quinolonas se administran probablemente con demasiada frecuencia para
erradicar el estado de portador o como quimioprofilaxis tras un supuesto
contacto.
Los aspectos relativos al tratamiento de
soporte, antibiótico y adyuvante de la sepsis grave y el shock séptico son
ampliamente descritos en otros capítulos de este curso.
La elevada mortalidad atribuible a la sepsis
meningocócica ha impulsado la investigación de numerosas terapias con la
intención de interrumpir o moderar los efectos proinflamatorios y
protrombóticos. Se han ensayado hemoderivados, como concentrado de
antitrombina III o plasma fresco congelado; anticoagulantes (heparina),
fibrinolíticos (rtPA), bloqueantes de endotoxinas como el rBPI21 [67],
proteína C activada, etc. Exceptuando el caso de la proteína C activada,
los resultados con el resto de tratamientos son aún inconsistentes y
controvertidos, si bien en algunos casos, las respuestas insuficientes
pueden relacionarse con una administración diferida de los tratamientos u
otras variables no definidas. Es pronto para valorar estas nuevas
terapias.
8.1 Corticoides
Los
datos de gran parte de los estudios clínicos sobre el valor de la
dexametasona en la meningitis bacteriana aguda han sido contradictorios y
no concluyentes, generando un debate permanente. Las guías clínicas más recientes consideran
este tratamiento, haciendo distinción por edades y etiologías en cuanto al
grado de recomendación y calidad de la evidencia [30]. En ausencia de nuevas evidencias en contra, los
corticoides deben administrarse en las meningitis graves, en especial en
los casos que cursan con disminución del nivel de conciencia,
independientemente de su etiología
[68].
Una
reciente revisión sistemática de la Cochrane [69]
concluía que aunque había una tendencia hacia el beneficio con el uso de
los corticoides en la meningitis bacteriana en términos de mortalidad y de morbilidad, no era posible hacer recomendaciones
definitivas. Poco después, los autores rectificaron sus conclusiones para
indicar claramente la dexametasona, movidos por los resultados del estudio
europeo publicado por Gans y col., en el que se encontró una
reducción del riesgo absoluto de mortalidad y de desenlaces clínicos
adversos en los pacientes adultos con meningitis
que habían sido tratados con dexametasona endovenosa
[70,
71].
En dicho estudio, el análisis de subgrupos mostró cómo los pacientes que obtuvieron mayor
beneficio fueron los clínicamente más graves, como cabía esperar.
Probablemente por ésto en el análisis por etiologías se encontró una
reducción de la tasa de mortalidad a las dos semanas en las meningitis
por Streptococcus pneumoniae, atribuible a una menor cantidad de
complicaciones sistémicas, fundamentalmente insuficiencia
“cardiorrespiratoria”, pero no se encontró un beneficio significativo en los
casos de meningitis meningocócica, subgrupo en que la
mortalidad fue menor (inferior al 10%) y el número de pacientes
incluidos fue pequeño. En general, en la situación de meningitis aguda, se
procederá a la administración de 10 mg cada 6 horas de dexametasona por vía
intravenosa, durante 4 días; instaurando la primera dosis inmediatamente
antes o coincidiendo con la primera dosis del antimicrobiano, con la intención de aminorar la intensa reacción
inflamatoria desencadenada por la lisis bacteriana.
Quizá la mayor duda que pueda plantearse a la indicación de los
corticoides en la meningitis es qué sucedería en aquellos pacientes en los
que no puedan emplearse cefalosporinas por resistencias u otros motivos y
que deban ser tratados con vancomicina, antibiótico con reducida
concentración en LCR tras su administración endovenosa, cuya penetración
se vería aún más mermada por el uso de los corticoides.
Las
nuevas evidencias [72,
73]
sobre la disminución de la mortalidad en los pacientes con shock séptico
tratados con dosis bajas de corticoides y la frecuencia con que
este microorganismo causa sepsis grave/shock séptico hacen que parezca
plausible ampliar esta recomendación a la infección por meningococo, hasta
nuevos datos. En el capítulo 29 se abordará en profundidad el tratamiento
con corticoides en el shock séptico.
8.2. Factor activador de plasminógeno
recombinante (rtPA)
Los datos sobre eficacia y sobre todo
beneficio/riesgo del uso de fibrinolíticos en pacientes con shock
meningocócico no son concluyentes. Pueden mejorar la situación
hemodinámica y disminuir la incidencia de trombosis, redundando en una
menor necesidad de amputaciones, pero aumentan el riesgo de hemorragias
graves, por lo que no puede hacerse otra recomendación salvo que su
indicación debe individualizarse [74,
75].
8.3.
Proteína C activada humana recombinante
La proteína C activada (PCA) humana
recombinante (drotrecogina-alfa [activada]) administrada
precozmente ha logrado disminuir la mortalidad de los pacientes adultos
con sepsis grave [76,
77,
78,
79].
En la sepsis meningocócica, los estudios
experimentales y la experiencia clínica muestran que la vía anticoagulante
de la proteína C se encuentra alterada e implicada en la fisiopatología
de la coagulación intravascular diseminada [80,
81].
Existe una reducción en la expresión de la trombomodulina y del receptor
de la proteína C de las células endoteliales de los vasos de la dermis,
surgiendo alteraciones de la coagulación en la mayoría de los pacientes.
De hecho, en la enfermedad meningocócica la actividad de la proteína C
está más disminuida que en otros tipos de sepsis. Esta disminución en la
activación de la proteína C se asocia a un estado proinflamatorio y
protrombótico, cuya intensidad se relaciona directamente con el pronóstico
desfavorable.
En cuanto a la aplicación específica en la
enfermedad meningocócica, inicialmente un estudio en fase II con
concentrados de proteína C (no activada)
sugirió que su uso en niños con púrpura fulminante favorecía la
recuperación del shock, y que su administración era segura
[82].
Posteriormente, se publicaron menores tasas de amputaciones que las
esperadas en estos pacientes (reducción del 30-50% a un 12%)
[83].
Hay alguna otra comunicación sobre series de casos pequeñas con buenos
resultados. Dado que la activación endotelial de la proteína C se
encuentra alterada en los pacientes con sepsis meningocócica, es de
suponer una mayor efectividad con la administración de proteína C activada
que con concentrados de proteína C.
La dosis recomendada de PCA humana
recombinante es 24 µg/kg/h en
infusión intravenosa continua durante 96 horas. Su uso está contraindicado
en la trombocitopenia de menos de 30.000 plaquetas/mm3, en la hemorragia
activa o en pacientes con alto riesgo de sangrado. Se ha señalado la
posibilidad de que exista un mayor
riesgo de hemorragia cerebral con la administración de PCA en los
pacientes con meningitis, pero la frecuencia de eventos adversos graves
sobre el sistema nervioso central (infartos y hemorragias juntos) es
similar al placebo, por lo que la meningitis no constituye una
contraindicación al uso de proteína C activada, que se debe emplear de
acuerdo a sus indicaciones aceptadas: sepsis grave de alto riesgo (fallo
de dos o más órganos, APACHE-II superior a 24 puntos en las 24 horas
previas, o shock séptico), en ausencia de contraindicaciones. Las bases y los
detalles de este tratamiento serán abordados en profundidad en el capítulo
28 del curso.
9.1.
Aislamiento
Además de las precauciones estándar, ante un
paciente ingresado con infección meningocócica, deben adoptarse las
llamadas “precauciones basadas en la transmisión”, al menos durante 24
horas tras iniciar el tratamiento antibiótico. Las medidas, orientadas a
evitar la transmisión por gotas incluyen: el aislamiento, sin necesidad de
presión negativa; mascarilla, protección ocular, bata, guantes y lavado de
manos.
9.2. Quimioprofilaxis
Se recomienda la quimioprofilaxis de los
contactos estrechos con un caso índice. Ceftriaxona (monodosis
intramuscular, de 250 mg en adultos y de 125 mg en niños) y rifampicina
oral (600 mg/12 h en adultos, 10 mg/kg/12 h en niños mayores de 1 mes y 5
mg/kg/12 h en niños menores de un mes, durante dos días), han demostrado
una eficacia similar en la erradicación del estado de portador
nasofaríngeo de cepas de N. meningitidis del serogrupo B. También son adecuadas las fluorquinolonas
orales, ciprofloxacino (500 mg), ofloxacino (400 mg) o levofloxacino (500
mg), en dosis única. No deben emplearse en mujeres embarazadas o niños. Cualquiera de estas pautas se administrará
lo antes posible tras la detección del caso índice.
Se recomienda que los pacientes recuperados
de una enfermedad meningocócica que no hayan sido tratados con una
cefalosporina de tercera generación (situación poco frecuente) reciban una
pauta de profilaxis antes de incorporarse a su ambiente habitual, para
asegurar la erradicación del estado de portador.
En el concepto de “contacto cercano” se
incluyen las personas que viven en el mismo hogar o que comparten espacios
reducidos a diario, y cualquiera que tenga una exposición directa a las
secreciones respiratorias. Los contactos casuales no tienen mayor riesgo
de adquirir la infección.
La posibilidad de favorecer el desarrollo de
resistencias en las especies de Neisseria hace imprescindible ser
juiciosos a la hora de indicar la profilaxis. Por ejemplo, en el caso de
los contactos escolares, generalmente sólo debe administrarse quimioprofilaxis a los compañeros en estrecho contacto con el caso índice.
Cuando en una misma aula se comunican dos casos la profilaxis se hará
extensiva a todos los alumnos y profesores de dicha clase. Si aparecen
tres o más casos en dos o más aulas está indicado ampliar la profilaxis a
todos los usuarios y trabajadores del centro.
9.3. Inmunización activa
Las vacunas antimeningocócicas polisacáridas
(como A+C, A+A+W-135, A+C+Y+W135) iniciaron su desarrollo en los años 70
del siglo pasado. Generalmente, son poco inmunógenas en los niños, que
requieren dosis repetidas para conseguir una protección que tampoco suele
ser duradera. Esta baja inmunogenicidad puede superarse añadiendo un
adyuvante proteico.
Las vacunas glucoconjugadas frente al
serogrupo C han demostrado ser muy eficaces y bien toleradas, por lo que
se han introducido en los calendarios vacunales [84].
Por eso, la investigación se ha focalizado en el desarrollo de preparados
conjugados, eficaces frente a los otros serogrupos importantes, como el A,
el Y, y el W-135 y parece que pronto podremos disponer de ellas.
En España ha habido una marcada
disminución de la incidencia del meningococo del serogrupo C mantenida en
el tiempo, desde la introducción de la vacunación sistemática tras la
epidemia de 1996-1997 [85].
En Madrid, la eficacia de inmunización registrada durante dos años de
monitorización post-campaña vacunal fue del 76,9% en personas de 18 meses
a 19 años y del 88,5% en población de 15 a 19 años. Se comprobó una
reducción en la tasa de infecciones graves por N. meningitidis del serogrupo C, pero como era de esperar se acompañó de un incremento del
aislamiento de meningococos del serogrupo B. También se ha constatado una
mayor incidencia de cepas resistentes a la penicilina [86].
Este patrón evolutivo epidemiológico se ha repetido en otras comunidades
de nuestro país [87,
88,
89].
Desafortunadamente, aún no disponemos de una
vacuna eficaz frente al meningococo del serogrupo B, principal implicado
en las formas clínicas invasoras. Existe una importante actividad
investigadora encaminada a encontrar la solución y se han sintetizado
varias vacunas, basadas en las vesículas de la membrana externa con una
eficacia aceptable, aunque la protección parece ser cepa-específica, por
lo que se están explorando otros posibles componentes antigénicos
[90,
91].
Los contactos estrechos de casos índice de
meningitis de serogrupo A o C además de recibir la profilaxis deben ser
vacunados.
La inmunización activa lleva aparejada una
incidencia no desdeñable de efectos adversos, aunque suelen ser de
gravedad leve-moderada, y los beneficios superan ampliamente los riesgos
[92].
9.4 Control de un brote
Un brote institucional o nosocomial se
define por la aparición de tres o más casos en un periodo de tiempo igual
o inferior a tres meses en personas que residan en la misma zona o tengan
una filiación común, sin ser contactos estrechos entre ellos: además se
debe cumplir que la tasa de ataque sea superior a 10 casos por 100.000, y
que las cepas de N. meningitidis sean genotípicamente idénticas
[93].
Debe considerarse la vacunación de la
población y en las instituciones, escuelas y hospitales además de la quimioprofilaxis masiva.
|
10. Enlaces
de interés sobre
Neisseria meningitidis |
-
Meningococcal disease. En:
[Neisseria.org]
-
Meningococcal disease. En: [CDC]
-
Neisseria meningitidis.
En: [WHO]
-
[Imágenes]
de casos clínicos de meningococemia; manifestaciones cutáneas.
-
Type and Duration of
Precautions Needed for Selected Infections and Conditions. En: Garner JS.
Guideline for Isolation Precautions in Hospitals. [CDC]
-
Neisseria.
Taxonomía. [NCBI]
-
[1] Stephens, DS.
Uncloaking the meningococcus: dynamics of carriage and disease. Lancet
1999; 353: 941–942. [Medline]
-
[2] Yazdankhah
SP, Caugant DA. Neisseria meningitidis: an overview of the carriage
state. J Med Microb 2004; 53: 821-832. [Medline]
-
[3] Gehanno JF,
Kohen-Couderc L, Lemeland JF, Leroy J. Nosocomial meningococcemia in a
physician. Infect Control Hosp Epidemiol. 1999; 20: 564-565. [Medline]
-
[4] Cohen MS,
Steere AC, Baltimore R, von Graevenitz A, Pantelick E, Camp B, Root RK.
Possible nosocomial transmission of group Y Neisseria meningitidis
among oncology patients. Ann Intern Med 1979; 91: 7-12. [Medline]
-
[5] Louie M,
Simor AE, Rachlis A, Louie L. Nosocomial Neisseria meningitidis:
molecular analysis of a clinical problem. Infect Control Hosp
Epidemiol 1997; 18: 203-204. [Medline]
-
[6] Riewerts
Eriksen NH, Espersen F, Laursen L, Skinhoj P, Hoiby N, Lind I.
Nosocomial outbreak of group C meningococcal disease. BMJ 1989; 298:
568-569. [Medline]
-
[7] Rose HD, Lenz
IE, Sheth NK. Meningococcal pneumonia. A source of nosocomial
infection. Arch Intern Med 1981; 141: 575-577. [Medline]
-
[8] OMS.
Meningococcal Disease Update. (3-1-2000)-(2-10-2000). [HTML]
-
[9] Larrauri A,
Cano R, García M, de Mateo S. Servicio de Vigilancia Epidemiológica.
Centro Nacional de Epidemiología. Instituto de Salud Carlos III.
Enfermedad meningocócica en España. Temporada 2002-2003. Impacto de la
vacuna conjugada en las tres temporadas posteriores a su introducción
en España. Boletín Epidemiológico Semanal 2004; 12 nº 2/13-24. [PDF]
-
[10] Fone DL,
Harries JM, Lester N, Nehaul L. Meningococcal disease and social
deprivation: a small area geographical study in Gwent, UK. Epidemiol
Infect 2003; 130: 53-58. [Medline]
-
[11] Stuart JM,
Middleton N, Gunnell DJ. Socioeconomic inequality and meningococcal
disease. Communicable Disease and Public Health 2002; 5: 327–328. [Medline]
-
[12] Williams
CJ, Willocks LJ, Lake IR, Hunter PR. BMC Public Health 2004; 4: 30. [Medline]
[HTML]
[PDF]
-
[13]
De Mateo Ontanon S. Meningococcal disease in Spain, 1990-1997. Change
in its epidemiological pattern. Rev Esp Salud Publica. 2000; 74:
387-396. [Medline]
[PDF]
-
[14]
Stollenwerk N, Maiden MC, Jansen VA. Diversity in pathogenicity can
cause outbreaks of meningococcal disease. Proc Natl Acad Sci USA 2004;
101: 10229-10234. [Medline]
-
[15] Domínguez
A, Cardeñosa N, Pañella H, Orcau A, Companys M, Alseda M, Oviedo M,
Carmona G, Minguell S, Salleras L; Working Group on the Study of
Meningococcal Disease in Catalonia, 1990-1997. The case-fatality rate
of meningococcal disease in Catalonia, 1990-1997. Scand J Infect Dis.
2004; 36: 274-279. [Medline]
-
[16] Booy R,
Habibi P, Nadel S, de Munter C, Britto J, Morrison A, Levin M;
Meningococcal Research Group. Reduction in case fatality rate from
meningococcal disease associated with improved healthcare delivery.
Arch Dis Child 2001; 85: 386-390. [Medline]
[HTML]
[PDF]
-
[17]
Thorburn K, Baines P, Thomson A, Hart CA. Mortality in severe
meningococcal disease. Arch Dis Child 2001; 85: 382-385 [Medline]
[HTML]
[PDF]
-
[18]
Castellanos-Ortega A, Delgado-Rodríguez M, Llorca J, Sánchez Burón P,
Mencía Bartolomé S, Soult Rubio JA, Milano Manso G, Domínguez Sampedro
P, Blanco Montero R, Rodríguez Núñez A, Zambrano Pérez E, Rey Galán C,
López Negueruela N, Reig Sáenz R. A new prognostic scoring system for
meningococcal septic shock in children. Comparison with three other
scoring systems. Intensive Care Med 2002; 28: 341-351. [Medline]
-
[19] De Lucas
García N. Nueva escala pronóstica para el shock séptico meningocócico
en niños. [REMI
2002; 2 (4): 345]
-
[20]
Flores-Cordero JM, Amaya-Villar R, Rincón-Ferrari MD, Leal-Noval SR,
Garnacho-Montero J, Llanos-Rodríguez AC, Murillo-Cabezas F. Acute
community-acquired bacterial meningitis in adults admitted to the
intensive care unit: clinical manifestations, management and
prognostic factors. Intensive Care Med 2003; 29: 1967-7193. [Medline]
-
[21] Palencia
Herrejón E, Sánchez Artola B. Infecciones del sistema nervioso
central. En: Protocolos SEMI. Enfermedades Infecciosas. Madrid:
Sociedad Española de Medicina Interna/SCM, 2004. [Capítulo
completo] [Libro
completo]
-
[22] Nathan BR,
Scheld WM. The potential roles of C-reactive protein and
procalcitonin concentrations in the serum and cerebrospinal fluid in
the diagnosis of bacterial meningitis. Curr Clin Top Infect Dis 2002;
22: 155-165. [Medline]
-
[23] Casado
Flores J, Blanco Quirós A. Procalcitonin. A new marker for bacterial
infection. An Esp Pediatr 2001; 54: 69-73. [Medline]
-
[24] Prat C,
Dominguez J, Rodrigo C, Gimenez M, Azuara M, Blanco S, Ausina V. Use
of quantitative and semiquantitative procalcitonin measurements to
identify children with sepsis and meningitis. Eur J Clin Microbiol
Infect Dis 2004; 23: 136-138. [Medline]
-
[25] van Rossum
AM, Wulkan RW, Oudesluys-Murphy AM. Procalcitonin as an early marker
of infection in neonates and children. Lancet Infect Dis 2004; 4:
620-630. [Medline]
-
[26]
Casado-Flores J, Blanco-Quiros A, Asensio J, Arranz E, Garrote JA,
Nieto M. Serum procalcitonin in children with suspected sepsis: a
comparison with C-reactive protein and neutrophil count. Pediatr Crit
Care Med 2003; 4: 190-195. [Medline]
-
[27] Carrol ED,
Newland P, Riordan FAI, Thomson APJ, Curtis N, Hart CA. Procalcitonin
as a diagnostic marker of meningococcal disease in children presenting
with fever and a rash. Arch Dis Child 2002; 86: 282–285. [Medline]
[HTML]
[PDF]
-
[28]
Giamarellos-Bourboulis EJ, Giannopoulou P, Grecka P, Voros D,
Mandragos K, Giamarellou H. Should procalcitonin be introduced in the
diagnostic criteria for the systemic inflammatory response syndrome
and sepsis? J Crit Care 2004; 19: 152-157. [Medline]
-
[29] Hasbun R,
Abrahams J, Jekel J, Quagliarello VJ. Computed tomography of the head
before lumbar puncture in adults with suspected meningitis. N Engl J
Med 2001; 345: 1727-1233. [Medline]
-
[30] Tunkel AR,
Hartman BJ, Kaplan SL, Kaufman BA, Roos KL, Scheld M. Practice
guidelines for the management of bacterial meningitis. Clin Infect Dis
2004; 39: 1267-1284. [HTML]
[PDF]
-
[31] Kanegaye
JT, Soliemanzadeh P, Bradley JS. Lumbar puncture in pediatric
bacterial meningitis: defining the time interval for recovery of
cerebrospinal fluid pathogens after parenteral antibiotic
pre-treatment. Pediatrics 2001; 108: 108: 1169-1174. [Medline]
[HTML]
[PDF]
-
[32] Kvalsvig
AJ, Unsworth DJ. Lumbar punctures and meningitis. Pediatrics 2002;
110: 1028. [HTML]
[PDF]
-
[33] Nigrovic
LE; Kuppermann N, McAdam AJ, Malley R. Cerebrospinal latex
agglutination fails to contribute to the microbiologic diagnosis of
pretreated children with meningitis. Pediatr Infect Dis J 2004; 23:
786-788. [Medline]
-
[34]
Elvira J, Garcia del Rio E, Chamorro J, Lopez Suarez A, Tinoco I,
Rodriguez Leal MC, Vara F, Garcia Tapia A, Giron Gonzalez JA. A
prospective study of meningitis diagnosed in a 3rd-level hospital
during a 1-year period. Rev Clin Esp 1999; 199: 576-582. [Medline]
-
[35] Balmer P,
Miller E. Meningococcal disease: how to prevent and how to manage.
Curr Opin Infect Dis 2002; 15: 275-281. [Medline]
-
[36]
Morant Gimeno A, Díez Domingo J, Gimeno Cardona C, Pereiro Berenguer
I, Brines Solanes J, Sauri Marti V. An analysis of prior antibiotic
treatment on the impact of meningococcal disease in children of the
Valencian Community. The Study Group of Invasive Diseases. An Esp
Pediatr 1999; 50: 17-20. [Medline]
-
[37]
Gutiérrez A, Ramos MA, Sanz JC, Bernal A, Agirrezabal J, Casado Y,
Martínez M. Bacterial meningitis in emergency medicine. Factors
associated with delay of antimicrobial therapy. Enferm Infecc
Microbiol Clin 1998; 16: 302-306. [Medline]
-
[38] Barquet N,
Domingo P, Cayla JA, González J, Rodrigo C, Fernández-Viladrich P,
Moraga-Llop FA, Marco F, Vázquez J, Saez-Nieto JA, Casal J, Canela J,
Foz M. Prognostic factors in meningococcal disease. JAMA
1997; 278: 491–496. [Medline]
-
[39]
Radetsky M. Duration of symptoms and outcome in bacterial meningitis:
an analysis of causation and the implications of a delay in diagnosis.
Pediatr Infect Dis J 1992 ; 11: 694-698; discussion 698-701. [Medline]
-
[40] Strang JR,
Pugh EJ. Meningococcal infections: reducing the case fatality rate by
giving penicillin before admission to hospital. Br Med J 1992; 305:
141–143. [Medline]
-
[41]
Begg N, Cartwright KA, Cohen J, Kaczmarski EB, Innes JA, Leen CL,
Nathwani D, Singer M, Southgate L, Todd WT, Welsby PD, Wood MJ.
Consensus statement on diagnosis, investigation, treatment and
prevention of acute bacterial meningitis in immunocompetent adults.
British Infection Society Working Party. J Infect 1999; 39: 1-15. [Medline]
-
[42] Aronin SI,
Peduzzi P, Quagliarello VJ. Community-acquired bacterial meningitis:
risk stratification for adverse clinical outcome and effect of
antibiotic timing. Ann Intern Med 1998; 129: 862-869. [Medline]
-
[43] Roznovsky
L, Krizova P, Struncova V, Dostal V, Plisek S, Kasal E, Burget I,
Chalupa P, Dlouhy P. Administration of antibiotics before admission in
patients with meningococcal disease. Cent Eur J Public Health 2003;
11: 14-18. [Medline]
-
[44] Surviving
Sepsis Campaign Guidelines for Management of Severe Sepsis and Septic
Shock. Crit Care Med 2004; 32: 858-873. [PDF]
-
[45] Marhoum El
Filali K, Noun M, Chakib A, Zahraoui M, Himmich H. Ceftriaxone versus
penicillin G in the short-term treatment of meningococcal meningitis
in adults. Eur J Clin Microbiol Infect Dis 1993; 12: 766–768. [Medline]
-
[46]
Lutsar I, Gontmacher A, Närska M, Rüütel V, Topman M, Ilves P, Siirde
T, Beilmann A. Infection. Five days of antibacterial therapy for
bacterial meningitis in children? 1995; 23: 113-118. [Medline]
-
[47] Cabellos
C, Viladrich PF, Verdaguer R, Pallares R, Liñares J, Gudiol F. A
single daily dose of ceftriaxone for bacterial meningitis in adults:
experience with 84 patients and review of the literature. Clin Infect
Dis 1995; 20: 1164–1168. [Medline]
-
[48] Briggs S,
Ellis-Pegler R, Roberts S, Thomas M, Woodhouse A. Short course
intravenous benzylpenicillin treatment of adults with meningococcal
disease. Int Med J 2004; 34: 383–387. [Medline]
-
[49] Cremades
Navalón I, Andrade Vivero G, Sánchez Artola B, Palencia Herrejón E.
Sepsis meningocócica con purpura fulminans. [REMI
2003; 3 (3): C2]
-
[50]
Latorre C, Gene A, Juncosa T, Muñoz C, González-Cuevas A. Neisseria
meningitidis: evolution of penicillin resistance and phenotype in a
children's hospital in Barcelona, Spain. Acta Paediatr 2000; 89:
661-665. [Resumen Medline]
-
[51] Orús P,
Viñas M. Mechanisms other than penicillin-binding protein-2
alterations may contribute to moderate penicillin
resistance in Neisseria meningitidis. Int J Antimicrob Agents 2001;
18: 113-119. [Medline]
-
[52]
Juncal AR, Pérez del Molino ML, Rodríguez I, Cid A, Guillan B, Pardo
F. Clinical and epidemiologic study of meningococcal meningitis in the
health region of Santiago de Compostela (1990-1997). Enferm Infecc
Microbiol Clin 1997; 15: 510-514. [Medline]
-
[53]
Richter SS, Gordon KA, Rhomberg PR, Pfaller MA, Jones RN. Neisseria
meningitidis with decreased susceptibility to penicillin: report from
the SENTRY antimicrobial surveillance program, North America, 1998-99.
Diagn Microbiol Infect Dis 2001; 41: 83-88. [Medline]
-
[54]
Antignac A, Ducos-Galand M, Guiyoule A, Pires R, Alonso JM, Taha MK.
Neisseria meningitidis strains isolated from invasive infections in
France (1999-2002): phenotypes and antibiotic susceptibility patterns.
Clin Infect Dis 2003; 37: 912-20. [Medline]
[HTML]
[PDF]
-
[55]
Australian Meningococcal Surveillance Programme. Annual report of the
Australian Meningococcal Surveillance Programme, 2002. Commun Dis
Intell 2003; 27: 196-208. [Medline]]
[HTML]
-
[56] van de
Beek D, Hensen EF, Spanjaard L, de Gans J, Enting RH, Dankert J.
Meropenem susceptibility of Neisseria meningitidis and Streptococcus
pneumoniae from meningitis patients in The Netherlands. J Antimicrob
Chemother 1997; 40: 895-897. [Medline]
[PDF]
-
[57] Prasad K,
Singhal T, Jain N, Gupta PK. Third generation cephalosporins versus
conventional antibiotics for treating acute bacterial meningitis.
Cochrane Database Syst Rev 2004 (2): CD001832. [Medline]
-
[58] Galimand
M, Gerbaud G, Guibourdenche M, Riou JY, Courvalin P. High-level
chloramphenicol resistance in Neisseria meningitidis. N Engl J Med
1998; 339: 868-874. [Medline]
-
[59]
Shultz TR, Tapsall JW, White PA, Ryan CS, Lyras D, Rood JI, Binotto E,
Richardson CJ. Chloramphenicol-resistant Neisseria meningitidis
containing catP isolated in Australia. J Antimicrob Chemother 2003;
52: 856-859. [Medline]
-
[60] Tondella
ML, Rosenstein NE, Mayer LW, Tenover FC, Stocker SA, Reeves MW,
Popovic T. Lack of evidence for chloramphenicol resistance in
Neisseria meningitidis, Africa. Emerg Infect Dis 2001; 7: 163-164. [Referencia Medline]
[HTML]
[PDF]
-
[61] Sow AI,
Caugant DA, Cisse MF, Hoiby EA, Samb A. Molecular characteristics and
susceptibility to antibiotics of serogroup A Neisseria meningitidis
strains isolated in Senegal in 1999. Scand J Infect Dis 2000; 32:
185-187. [Medline]
-
[62] Vázquez JA.
The resistance of Neisseria meningitidis to the antimicrobial agents:
an issue still in evolution. Rev Med Microbiol 2001; 12: 39-45. [PDF]
-
[63] Abadi FJ,
Carter PE, Cash P, Pennington TH. Rifampin resistance in Neisseria
meningitidis due to alterations in membrana permeability. Antimicrob
Agents Chemother. 1996; 40: 646-651. [Medline]
[PDF]
-
[64] Stefanelli
P, Fazio C, La Rosa G, Marianelli C, Muscillo M, Mastrantonio P.
Rifampicin-resistant meningococci causing invasive disease: detection
of point mutations in the rpoB gene and molecular characterization of
the strains. J Antimicrob Chemother 2001; 47: 219-222. [Medline]
[HTML]
[PDF]
-
[65] Danés I,
Arnau JM. ¿Es segura la administración de quinolonas en la edad
pediátrica? Med Clin 2001; 117: 676-677. [Medline]
[HTML]
[PDF]
-
[66] Alcalá B,
Salcedo C, De la Fuente L, Arreaza L, Uría MJ, Abad R. Enríquez R,
Vázquez JA, Motgé M, De Batlle J. Neisseria meningitidis showing
decreased susceptibility to ciprofloxacin: first report in Spain. J
Antimicrob Chemother 2004; 53: 409. [Medline]
-
[67] Giroir BP,
Scannon PJ, Levin M FRCP. Bactericidal/permeability-increasing
protein. Lessons learned from the phase III, randomized, clinical
trial of rBPI21 for adjunctive treatment of children with severe
meningococcemia. Rit Care Med Volume 2001; 29 (Suppl 1): S130-S135.
[Medline]
-
[68] Chaudhuri
A. Adjunctive dexamethasone treatment in acute bacterial meningitis.
Lancet Neurol 2004; 3: 54–62.[Medline]
[PDF]
-
[69]
van de Beek D, de Gans J, McIntyre P, Prasad K. Corticosteroids in
acute bacterial meningitis. Cochrane Database Syst Rev 2003 (3):
CD004305. [Resumen]
-
[70] de Gans J,
van de Beek D; European Dexamethasone in Adulthood bacterial
Meningitis Study Investigators. Dexamethasone in adults with bacterial
meningitis. N Engl J Med 2002; 347: 1549-1556. [Medline]
-
[71] van de
Beek D, de Gans J. Dexamethasone and pneumococcal meningitis. Ann
Intern Med 2004; 141:327. [Medline]
-
[72] Annane D,
Bellissant E, Bollaert PE, Briegel J, Keh D, Kupfer Y. Corticosteroids
for severe sepsis and septic shock: a systematic review and
meta-analysis. BMJ 2004; 329: 480-488. [Medline]
[HTML]
[PDF]
-
[73] Minneci
PC, Deans KJ, Banks SM, Eichacker PQ, Natanson C. Meta-Analysis: The
effect of steroids on survival and shock during sepsis depends on the
dose. Ann Intern Med 2004; 141: 47-56. [Medline]
-
[74] Zenz W,
Zoehrer B, Levin M, Fanconi S, Hatzis T, Knight G, Müllner M, Faust SN;
International Paediatric Meningococcal Thombolysis Study Group.Use of
recombinant tissue plasminogen activator in children with
meningococcal purpura fulminans: a retrospective study. Crit Care Med
2004; 32: 1777-1780. [Medline]
-
[75] López-Herce
Cid J. Administración de rtPA en niños con purpura fulminans
meningocócica. [REMI
2004; 4 (9): 783]
-
[76] Dhainaut
JF, Laterre PF, Janes JM, Bernard GR, Artigas A, Bakker J, Riess H,
Basson BR, Charpentier J, Utterback BG, Vincent JL; Recombinant Human
Activated Protein C Worldwide Evaluation in Sepsis (PROWESS) Study
Group. Drotrecogin alfa (activated) in the treatment of severe sepsis
patients with multiple-organ dysfunction: data from the PROWESS trial.
Intensive Care Med 2003; 29: 894-903. [Medline]]
-
[77] Dhainaut
JF, Laterre PF, LaRosa SP, Levy H, Garber GE, Heiselman D, Kinasewitz
GT, Light RB, Morris P, Schein R, Sollet JP, Bates BM, Utterback BG,
Maki D. The clinical evaluation committee in a large multicenter phase
3 trial of drotrecogin alfa (activated) in patients with severe sepsis
(PROWESS): role, methodology, and results. Crit Care Med 2003; 31:
2291-2301. [Medline]
-
[78] Bernard GR,
Margolis BD, Shanies HM, Ely EW, Wheeler AP, Levy H, Wong K, Wright TJ;
Extended Evaluation of Recombinant Human Activated Protein C United
States Investigators. Extended evaluation of recombinant human
activated protein C United Status Trial (ENHANCE US): a single-arm,
phase 3B, multicenter study of drotrecogin alfa (activated) in severe
sepsis. Chest 2004; 125: 2206-2216. [Medline]
-
[79] Palencia
Herrejón E. Proteína C activada en la sepsis grave. [REMI
2001 ; 1 (3): L1]
-
[80] Faust SN,
Levin M, Harrison OB, Goldin RD, Lockhart MS, Kondaveeti S, Laszik Z,
Esmon CT, Heyderman RS. Dysfunction of endothelial protein C
activation in severe meningococcal sepsis. N Engl J Med 2001; 345:
408-416. []Medline]
-
[81] Palencia
Herrejón E. En la sepsis meningocócica está alterada la activación
endotelial de la proteína C. [REMI
2001; 1 (8): 192]
-
[82] Rivard GE,
David M, Farrell C, Schwarz HP. Treatment of purpura fulminans in
meningococcemia with protein C concentrate. J Pediatr 1995; 126:
646-652. [Medline]
-
[83] White B,
Livingstone W, Murphy C, Hodgson A, Rafferty M, Smith OP. An
open-label study of the role of adjuvant hemostatic support with
protein C replacement therapy in purpura fulminans-associated
meningococcemia. Blood 2000; 96: 3719-3724. [[Resumen Medline]
[HTML]
[PDF]
-
[84] Comité
Asesor de Vacunas de la Asociación Española de Pediatría. Calendario
vacunal de la Asociación Española de Pediatría: recomendaciones 2004.
An Pediatr 2004; 60: 468-473. [PDF]
-
[85] Gutiérrez
MA, Ramírez R, García J, Moreno A, Hernando M, Arce A, Sendra JM,
Bueno R. Evolución de la enfermedad meningocócica en la Comunidad de
Madrid. Efectividad de la vacunación antimeningocócica A+C. Rev Esp
Salud Publica 2000; 74: 397-403. [Medline]
[PDF]
-
[86] Cercenado
E, Cuevas O, García-Escribano N, Bouza, E. The changing epidemiology
of severe infections caused by Neisseria meningitidis over the last 7
years. Clin Microb Infect 2003; 9 (Suppl 1): 196.
-
[87]
Pereiro I, Diez-Domingo J, Morant A, Gimeno C, Lerma M, San-Martin M,
Gonzalez
A; Group for the Study of Invasive Diseases. Epidemiological pattern
of meningococcal disease in Valencia, Spain. Impact of a mass
immunization campaign with meningococcal C polysaccharide vaccine.
Scand J Infect Dis 2001; 33: 581-584. [Medline]
-
[88] Malvar
Pintós A. Resultados del estudio de subdetección del meningococo en
sujetos vacunados en Galicia. Rev Esp Salud Publica 2000; 74: 381-386.
[Medline] [PDF]
-
[89] González
A, García J. Evaluación de la campaña de vacunación en Cantabria. Dos
años de evolución epidemiológica. Rev Esp Salud Pública 2000; 74;
405-411. [Medline]
[PDF]
-
[90] Pollard AJ,
Moxon FR. The meningococcus tamed? Arch Dis Child 2002; 87: 13-17.
[Medline]
[HTML] [PDF]
-
[91] Rüggeberg
JU, Pollard AJ. Meningococcal Vaccines. Pediatr Drugs 2004; 6:
251-266. [Medline]
-
[92]
De Abajo F, Álvarez Requejo A, Ayani I, Carrillo JA, Carvajal A,
Castillo JR, Cuchi T, Esteban Calvo C, Figueras A, García del Pozo J,
González S, González Ruiz M, Herrero FT, Hidalgo A, Giménez Guillén C,
Khalid H, Maciá Martínez MA, Madurga M, Margolles Martins M, Martí
Mallen M, de Diego IM, Martín-Serrano G, Montero D, Navarro M, Pedrós
C, Revilla Ramos F, Rueda AM, Sáenz P, Salgueiro E, Sánchez Sánchez A,
Sanz E, Torelló J, Tres Belzunegui JC, Vega T. Grupo de Investigación
sobre la vacuna antimeningocócica del Sistema Español de
Farmacovigilancia Seguridad de la vacuna antimeningocócica A+C. Datos
recogidos por el Sistema Español de Farmacovigilancia. Gac Sanit 1999;
13: 462-467. [Medline]
[HTML]
-
[93] Centers for Disease Control and Prevention.
Prevention and Control of Meningococcal Disease Recommendations of
the Advisory Committee on Immunization Practices (ACIP). MMWR 2000;
49(RR07); 1-10. [Medline]
[HTML]
[PDF]
Beatriz Sánchez Artola
Hospital Gómez Ulla, Madrid
©REMI,
http://remi.uninet.edu. Octubre 2004.
Palabras clave:
Meningococo, Sepsis meningocócica, Meningitis, Tratamiento antibiótico, Resistencia a
antibióticos, Sepsis grave, Shock séptico,
Cuidados Intensivos.
Busque en REMI con Google:
Envía tu comentario para su
publicación |