|
| |
|
Revista
Electrónica de Medicina Intensiva
Artículo nº C14. Vol 4 nº 11, noviembre 2004.
Autores: Ricard Jordà Marcos, Jose Ignacio Ayestarán Rota
|
[ Anterior ] [ Arriba ] [ Siguiente ]
|
|
Los catéteres intravasculares se han convertido en un
instrumento indispensable para nuestra práctica médica habitual,
principalmente en las UCI. Nos permiten un acceso vascular estable y seguro, a
través del cual administramos líquidos o medicación, extraemos muestras
para análisis o realizamos una monitorización hemodinámica. Para hacernos
una idea de la magnitud de su uso, en el estudio ENVIN del año 2003, sobre
6.047 pacientes con una estancia media de 7,68±8,63 días, se
contabilizaron 21.672 días de uso de catéter arterial, y 30.594 días de
catéter venoso central (CVC).
Su utilización no está exenta de complicaciones,
destacando por su frecuencia las infecciones relacionadas (IRC), tanto
locales como sistémicas. La dificultad en su diagnóstico y la sepsis
relacionada con el catéter (SC), con la implicación que ésta lleva en
cuanto a recambio fútil de catéteres, la morbi-mortalidad asociada y
aumento en la utilización de recursos, convierten a la infección
relacionada con catéter en un problema de primer orden en nuestra
actividad asistencial habitual. Recientemente, la SEIM y la SEMICYUC han
publicado los resultados de una excelente conferencia de consenso
sobre el tema [1]. En la tabla I se exponen las definiciones de las IRC.
|
Tabla I: Definiciones de las
infecciones relacionadas con catéter [1]
|
| |
|
| Infección
del punto de entrada |
- Clínicamente documentada: signos locales de
infección en el punto de entrada del catéter; enrojecimiento, induración,
calor y salida de material purulento.
- Microbiológicamente documentada: signos
locales de infección en el punto de entrada del catéter más un cultivo del
punto de entrada del catéter, pero sin bacteriemia concomitante.
- Colonización del
catéter: aislamiento significativo en punta de catéter (cultivo
cuantitativo o semicuantitativo) o en la conexión sin que existan signos
clínicos de infección en el punto de entrada del acceso vascular ni signos
clínicos de sepsis. |
| |
|
| Bacteriemia relacionada
con el catéter |
- Bacteriemia o funguemia
relacionada con el catéter (diagnóstico tras su retirada): aislamiento
del mismo microorganismo (especie e idéntico antibiograma) en el
hemocultivo extraído de una vena periférica y en un cultivo cuantitativo o
semicuantitativo de la punta del catéter en un paciente con cuadro clínico
de sepsis y sin otro foco aparente de infección (b).
- Bacteriemia o funguemia
relacionada con el catéter (diagnóstico sin retirada): cuadro clínico
de sepsis, sin otro foco aparente de infección, en el que se aísla el
mismo microorganismo en hemocultivos simultáneos cuantitativos en una
proporción superior o igual a 5:1 en las muestras extraídas a través de
catéter respecto a las obtenidas por venopunción.
- Bacteriemia o funguemia
probablemente relacionada con el catéter, en ausencia de cultivo de
catéter: cuadro clínico de sepsis, sin otro foco aparente de
infección, con hemocultivo positivo, en el que desaparece la
sintomatología a las 48 horas de la retirada de la línea venosa.
- Bacteriemia o funguemia
relacionada con el líquido de infusión: cuadro clínico de sepsis, sin
otro foco aparente de infección, con aislamiento del mismo microorganismo
en el líquido de infusión y en el hemocultivo extraído percutáneamente.
|
a: modificado de Ariza et al [1]
b: En caso de estafilococos coagulasa negativos (ECN) se exigirá el
aislamiento del microorganismo, al menos en 2 frascos de hemocultivo
periféricos. |
La bacteriemia relacionada con el catéter (BRC) es la
complicación infecciosa de más trascendencia por su frecuencia, gravedad y
pronóstico de los pacientes que presentan SC, y aunque la incidencia varía
según diferentes factores, relacionados tanto con el paciente como con el
tipo de catéter, la mayor parte están asociadas a la utilización de
catéteres venosos centrales (CVC) colocados en UCI, principalmente por las
características en su utilización y factores relacionados con su
inserción [2].
El indicador de infección relacionada con catéter
recomendado y utilizado en los principales estudios de vigilancia de
infección nosocomial, es la BRC. Su definición puede variar teniendo en
cuenta aspectos epidemiológicos, que incluyen la bacteriemia primaria
(origen desconocido), o clínicos (comprobación de la BRC con cultivos de
microorganismos iguales en el catéter y en hemocultivos). La CDC y la
JCAHO recomiendan que las tasas de BRC se expresen en episodios de BRC/1.000
días de catéter [3].
Aunque la incidencia de BRC ha disminuido en los
últimos años a unos 5,6 episodios/1.000 días de catéter, posiblemente por
mejor diseño y calidad de los catéteres, el número de pacientes con BRC
sigue siendo elevado. Esto es debido al mayor uso de CVC, su elevada
manipulación, a los avances en los métodos de diagnóstico microbiológico y
a la puesta en marcha de estándares de sistemas de vigilancia de infección
nosocomial [3, 4].
Se calcula que en USA se utilizan 15 millones de
catéteres/día (número de días de catéter de una población seleccionada en
un tiempo seleccionado) al año, lo que supone unas 80.000 BRC/año en UCI y
más de 250.000 BRC/año si se considera toda la población hospitalaria. Las
tasas varían según las especialidades, desde 2,9/1.000 en unidades de
cirugía cardiotorácica, a 7,8/1.000 en unidades de trauma y 8,5/1.000 en
unidades de quemados [3]. En un estudio prospectivo realizado en una UCI
quirúrgica en el que se controlaron 232 catéteres, Charalambous y col.
encontraron colonización (crecimiento inferior a 15 colonias) en el 17%, e IRC en el
34%, observando bacteriemia en el 11,2% de los 209 hemocultivos realizados
(en el subgrupo de colonizados se detectó en todos los casos otro foco
probable de infección, y en el 23% de los infectados el origen de la
bacteriemia era el CVC) [5]. En el conjunto de las bacteriemias nosocomiales, alrededor del 37% de las mismas está relacionada con los CVC
[6].
Como puede observarse en la Tabla II, en nuestro país,
según los datos del EPINE 1990-1999, también ha aumentado la frecuencia de
BRC en los últimos años, convirtiéndose en una de las infecciones
nosocomiales con más prevalencia en nuestros hospitales (11-22% de todas
las infecciones) [3, 7]. El estudio ENVIN que nos da información sobre
infección nosocomial en pacientes ingresados en UCI, pone de manifiesto
unas tasas de BRC (incluidas las BRC primarias) a lo largo de estos diez
últimos años, entre 2,05 y 4,5 episodios/1.000 días de catéter,
manteniéndose estable la incidencia a lo largo de los últimos cinco años
[8].
|
Tabla II: Incidencia de
bacteriemia relacionada con catéter
|
| |
| |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
| ENVIN* |
| BRC |
1,31 |
1,21 |
2,01 |
2,04 |
2,11 |
1,67 |
- |
- |
|
BP+BRC |
3,08 |
3,47 |
4,33 |
4,03 |
4,01 |
3,67 |
4,50 |
4,02 |
| EPINE** |
|
BRC |
4,12 |
3,77 |
3,68 |
3,19 |
4,51 |
4,16 |
4,19 |
4,28 |
|
BP+BRC |
10,01 |
10,4 |
11,25 |
9,89 |
10,8 |
10,33 |
9,72 |
11,18 |
|
*ENVIN: Estudio de incidencia en UCI
(BRCx1.000 días/catéter); **EPINE: Estudio de
prevalencia hospitalaria
(% del total de infecciones). BP: bacteriemia primaria; BRC: bacteriemia
secundaria a catéter. |
Los catéteres periféricos son los más utilizados pero
el riesgo de BRC es bajo, aunque no hay que olvidar la morbilidad anual
por complicaciones. Las infecciones aumentan si los catéteres son
utilizados para nutrición parenteral (hasta un 25%), siendo poco frecuentes en catéteres de
diálisis o Swan-Ganz, y mínimas en los catéteres arteriales [1, 2].
La repercusión de la BRC se traduce en un incremento en
la morbilidad en forma de aumento de estancia y de costos [9], y
probablemente de la mortalidad [6, 10, 11], aunque este apartado se mantiene
en discusión abierta [9, 12, 13].
Podemos considerar a la BRC un buen indicador de
control de infección nosocomial en UCI, estableciendo un valor aceptable
entre 4-6 episodios de BRC/1.000 días de CVC [1].
|
3. Etiopatogenia
y microbiología |
Conocer cual es la patogenia de la infección por CVC y
los microorganismos implicados más frecuentes que la producen, nos ayudará
a mejorar las estrategias de prevención y su tratamiento [14].
La vía de infección más frecuente de los CVC es
extraluminal, por migración de la flora de la piel a través del trayecto
cutáneo de fibrina alrededor del catéter (45%). La colonización
endoluminal se produce a través de las conexiones externas por
manipulación frecuente (26%) [15]. Menos usuales son las infecciones
producidas por vía hematógena desde otro punto de infección (3-10%),
aunque esta vía puede ser más importante en pacientes críticos ya sea por
contaminación de los líquidos de infusión (2%) o por formación de trombos
en la punta del catéter [16].
La colonización de un catéter depende de un proceso de
adhesión bacteriana mediada por una interacción físico-química
(interacción hidrofóbica, fuerzas de Van der Waals), que afecta también al
depósito de proteínas séricas en la superficie del catéter. La adhesión
varía según el material del catéter, siendo mayor en los de polivinilo o
látex siliconado y menor en los catéteres de poliuretano, polietileno o
teflón. A este primer paso, que es reversible, le sigue un proceso de
adherencia bacteriana mediante un sistema de adhesinas a diferentes
receptores como son el fibrinógeno o la fibrina. Mientras el
Staphylococcus epidermidis se une al catéter principalmente mediante
interacción hidrofóbica, la adhesión de Staphylococcus aureus o Candida
está estimulada por las proteínas séricas, siendo su adherencia mayor. Una
vez colonizado el catéter, los microorganismos forman la llamada biocapa
bacteriana, mediante una sustancia polimérica ("slime"), que protege a las
bacterias facilitando su adhesión y disminuyendo su sensibilidad a los
antibióticos, favoreciendo la aparición de resistencias [16].
|
Tabla III: Patógenos más
frecuentes en las bacteriemias (BP + BRC) (%)
|
| |
1996-1999 |
2000-2003 |
| |
NNIS |
EPINE |
ENVIN |
EPINE |
ENVIN |
| S. epidermidis |
|
14,4 |
27,3 |
18,4 |
22,7 |
| SCN |
37 |
20,1 |
12,6 |
15,1 |
18,9 |
| S. aureus* |
12,6 |
9,2 |
13,3 |
9,8 |
10,6 |
|
Enterococcus spp. |
13,5 |
5,9 |
9,4 |
6,1 |
8,5 |
| Pseudomonas aeruginosa |
4 |
4,8 |
6,9 |
5,5 |
6,9 |
|
Acinetobacter spp. |
- |
2,9 |
5,4 |
2,9 |
3,9 |
| Candida spp. |
8 |
4,4 |
2,6 |
5,7 |
4,8 |
| E. coli |
2 |
8,5 |
3,9 |
8,3 |
2,8 |
| Klebsiella spp. |
3 |
1,7 |
3,5 |
3,6 |
1,4 |
|
Enterobacter spp. |
5 |
1,7 |
|
2,7 |
|
| SARM** |
|
3,45 |
|
3,95 |
|
|
BP: bacteriemia primaria; BRC: bacteriemia relacionada con
catéter. NNIS, EPINE: estudios hospitalarios; ENVIN: estudio de incidencia
en UCI. * En NNIS y ENVIN se incluyen S. aureus tanto sensibles como
resistentes a meticilina. **SARM: S. aureus resistente a meticilina |
Aunque los microorganismos más frecuentes en las BRC
van variando a lo largo de los años, los cocos Gram positivos (CGP), sobre todo
Staphylococcus coagulasa negativos y el Staphylococcus epidermidis, siguen
siendo individualmente los más prevalentes (Tabla III), aunque en los
últimos años ha aumentando la incidencia de infecciones por Staphylococcus
aureus, dato importante por su capacidad para producir infecciones más
graves y con mayor mortalidad (8,2% frente 0,7% de Staphylococcus spp.). No
obstante se está observando un incremento tanto en las BRC por bacilos
Gram negativos (BGN), sobre
todo en pacientes inmunocomprometidos con catéteres tunelizados, como en
las infecciones por Candida spp. sobre todo en relación al uso de NPT (la
glucosa favorecería su capacidad para producir biocapa).
Las medidas de prevención constituyen
el pilar fundamental para reducir las complicaciones atribuibles a las BRC
y reducir el coste sanitario que suponen. Un importante número de factores
de riesgo no son modificables, ya que están en relación con la gravedad del
paciente (APACHE, inmunosupresión, número de diagnósticos al ingreso en
UCI, hospitalización prolongada). Pero existen otros, relacionados con el
catéter y su mantenimiento, sobre los que sí podemos influir [15]. En la
tabla IV se exponen los más destacables.
|
Tabla IV: Control de factores de
riesgo en las BRC
|
| |
|
| Factores de
riesgo |
Control |
| Gravedad del paciente |
No |
| Inexperiencia, colocación
difícil |
Enseñanza, entrenamiento,
supervisión por staff con experiencia |
| Tipo de catéter |
Teflón, poliuretano |
| Lugar de inserción |
Subclavia, mejor que
yugular, mejor que femoral |
| Medidas de barrera |
Máxima esterilidad |
| Colonización de la piel |
Clorhexidina 2%, apósito
con clorhexidina, catéter recubierto de antibiótico |
| Contaminación de la conexión |
Limitar número de luces, conexiones y
manipulación; conexiones con solución antiséptica |
| Catéteres de más de 7 días |
Catéter recubierto de
antibiótico, tunelización del catéter, apósito con clorhexidina |
|
|
La colocación de un CVC tiene un elevado riesgo de
potenciales complicaciones. La inexperiencia de la persona que pone el
catéter supone un factor de riesgo importante. Un buen programa
educacional reduce no sólo el riesgo de BRC sino el de otras
complicaciones mecánicas. La técnica de inserción de CVC o arterial debe
realizarse con las máximas medidas de asepsia, que incluyen un correcto
lavado de manos y la utilización de métodos de barrera estériles (mascarilla,
gorro, guantes y paños estériles). La preparación de la piel se consigue
mejor con clorhexidina al 2% que con povidona yodada o alcohol al 70%. Los
catéteres de teflón o poliuretano se asocian a menos BRC que los de
polivinilo o polietileno. Se recomienda, si es posible, la canalización de
la vena subclavia por el menor riesgo de infección que la yugular o
femoral [2, 17].
El mantenimiento de una actividad educativa continuada
del personal sanitario, tanto de médicos como enfermeras, sobre las
prácticas adecuadas en el mantenimiento de los CVC continúa siendo el
elemento más efectivo y de menor coste para reducir la SC [18]. Una vez
colocado el catéter debe protegerse con gasa estéril (cambio cada dos
días) o apósito estéril semipermeable, que se debe cambiar como mínimo
cada semana. No se recomienda el uso de pomadas de antisépticos o acetona
en el punto de inserción del catéter. Si necesitamos cambiar un catéter,
se puede realizar con una guía únicamente cuando no haya sospecha o
evidencia de infección. El cambio rutinario de CVC o arterial no ha
demostrado reducción en las tasas de infección, por lo que no es necesario
si el catéter funciona correctamente y no hay signos de infección [19].
Los catéteres recubiertos de antibióticos o
antisépticos (sulfadiazina argéntica, clorhexidina o minociclina/rifampicina) han
demostrado reducción en las tasas de BRC especialmente en pacientes de
riesgo, aunque no se conoce su impacto a largo plazo en cuanto a
modificación de la flora cutánea o resistencias. Un nuevo modelo de
conexión con solución antiséptica [20], al igual que un tipo de apósito con clorhexidina parece también que podrían ser eficaces para reducir las BRC.
La utilización de estas nuevas tecnologías en la prevención de BRC, deberá
tenerse en cuenta en el uso de catéteres de más de cinco días de duración,
si tras maximizar las medidas iniciales en la prevención de la infección,
las tasas de BRC siguen siendo elevadas.
Además de todos estos factores, el nivel de presión
asistencial sobre las enfermeras, valorado como ratio número de
enfermeras/número de pacientes también ha demostrado su papel en la
prevalencia de infección nosocomial en UCI [15].
En base a los mecanismos fisiopatológicos, el
tratamiento de la SC se ha de plantear desde dos vertientes; el que ha de
realizarse sobre el catéter, y la antibioticoterapia a administrar tanto
empírica como dirigida.
5.1. Tratamiento
local del CVC
Ante la sospecha de BRC, el recambio del CVC es una
práctica habitual en las UCIs sin que exista un rendimiento efectivo, ya
que el 96% de los catéteres retirados pueden no estar relacionados con IRC
[21].
Parece claro que en aquellos pacientes con inestabilidad hemodinámica, neutropénicos, con signos claros de infección en la zona de punción, o
metástasis sépticas, la retirada del CVC es obligatoria. No obstante la
duda es qué hacer cuando estamos frente a un paciente febril, sin
repercusión sistémica y con sospecha de que el CVC es el origen del cuadro
infeccioso. Las recomendaciones realizadas hasta el momento indican que en
esta situación el CVC no debe ser retirado [14]. Sin embargo dicha
afirmación no se sustentaba en estudios adecuados, por lo que algunos
autores más cautos recomiendan el recambio del catéter bajo guía y si
posteriormente se comprueba que el CVC está colonizado, retirar el nuevo
catéter y recolocar otro en una zona de acceso diferente [22].
Recientemente Rijnders y col. han realizado un estudio prospectivo en el
que aleatorizan dos grupos de pacientes, al grupo control se les retira el
CVC mientras que al grupo de estudio se les mantiene con control estricto
durante 5 días, pudiendo retirarse si aparece shock séptico o
bacteriemia [23]. Al final del tiempo de control el CVC se mantiene o se
retira si persiste el cuadro séptico sin otro foco que lo explique.
Únicamente se detectaron 2 BRC en el grupo control frente a 3 del grupo de
estudio (p <0,2), sin embargo de este último grupo solo se retiraron los
catéteres en el 30% de los pacientes frente al 100% del grupo control (p
< 0,01). No existieron diferencias respecto a la mortalidad, fallo
multiorgánico o uso de antibióticos. Parece pues razonable el
mantenimiento del CVC en aquellos pacientes estables. Esta política
conservadora evitaría los cambios de CVC bajo guía, ya que éste es un
procedimiento que incluso puede aumentar la tasa de BRC [19]. En la figura
1 se expone la actitud recomendada a tomar frente a una sospecha de IRC:
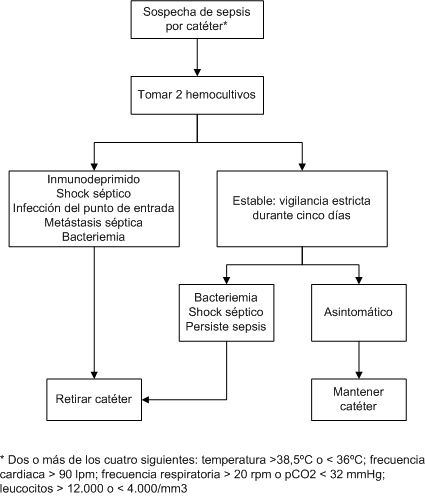
5 .2 Tratamiento
antibiótico empírico
Es evidente que en los pacientes con sepsis grave o
shock séptico es obligado iniciar de forma inmediata una cobertura
antibiótica adecuada. El tratamiento antibiótico inadecuado o tardío en la
sepsis, independientemente del origen, conlleva un incremento en la
mortalidad [24]. La elección antibiótica estará básicamente condicionada
por dos elementos; por un lado la epidemiología de nuestra UCI y por el
otro el nivel de resistencias antibióticas de los microorganismos. No obstante,
parece adecuado hacer una cobertura amplia que cubra tanto cocos Gram
positivos (CGP) como bacilos Gram negativos (BGN).
Para cubrir el espectro de los CGP, y dado que en nuestro entorno los CGP
resistentes a la vancomicina todavía no tienen trascendencia clínica, se
han mostrado efectivos tanto los glicopeptidos (vancomicina 1 g iv /12 horas o
teicoplanina 400 mg iv / 24 horas) como quinopristina/dalfopristina (Q/D) (7,5 mg /kg / 8 horas)
o linezolid (600 mg iv / 12 horas) [1]. Por la extensa experiencia acumulada en su
uso y el menor coste, los glicopéptidos se consideran de primera elección.
La diferencia entre ellos viene dada por la relación entre eficacia y
toxicidad; así, mientras que vancomicina tiene una mayor toxicidad sobre
todo cuando se asocia a aminoglicósidos, teicoplanina presenta un mayor
fracaso en el tratamiento de endocarditis o bacteriemia no
relacionada con catéter.
La elección antibiótica mas compleja es la cobertura
de BGN, ya que de la elección dependerá la cobertura o no de P.
aeruginosa,
Acinetobacter spp., o enterobacterias con betalactamasas de espectro
extendido. En la tabla V se exponen los posibles antibióticos a usar y su
dosificación endovenosa. Su manejo viene dado por el uso racional de los
mismos [25].
|
Tabla V: Antibióticos activos
frente a bacilos gram negativos
|
| |
|
| Antibiótico |
Dosis (iv) |
| Cefotaxima |
1 g/8 horas a 2 g/6 horas |
| Ceftriaxona |
1-2 g/12 horas |
| Cefepima |
2 g/8-12 horas |
| Ceftazidima |
2 g/8 horas |
| Aztreonam |
1-2 g/8 horas |
| Imipenem |
500 mg/6 horas a 1 g/8
horas |
| Meropenem |
1g/8 horas |
| Piperacilina-tazobactam |
4-0,5 g/6 horas |
| Gentamicina |
7 mg/kg/día |
| Tobramicina |
7 mg/kg/día |
| Amikacina |
20 mg/kg/día |
| Levofloxacino |
750 mg/24 horas |
| Ciprofloxacino |
400 mg/8 horas |
|
|
En aquellos pacientes con ingreso prolongado, sometidos
a cirugía, con nutrición parenteral o con colonización en múltiples focos
sería recomendable ampliar la cobertura para cubrir hongos, en especial
Candida spp. [26]. Nolla y col. observaron que el retraso en el tratamiento
más allá de 48 horas se acompaña de una disminución en la supervivencia
del 60% al 22% a los 25 días del evento [27]. Este dato ha sido refrendado
por estudios más recientes, representando el retraso en el inicio del
tratamiento antifúngico un factor independiente de mal pronóstico [28, 29],
que incrementa hasta 29 veces el riesgo de mortalidad en los pacientes con
pancreatitis [30]. Ante esta situación es evidente que el tratamiento de la candidemia ha de iniciarse ante la sospecha de infección sin esperar al
resultado microbiológico completo. La administración de fluconazol a 10 mg / kg /
día
cubre bien incluso aquellas especies de Candida con resistencias dosis
dependientes, como es el caso de C. glabrata. No obstante, ante la presencia
cada vez más frecuente de especies de Candida no-albicans, los pacientes que
presenten signos de sepsis o shock séptico deberían tratarse con
anfotericina B. El uso previo de azoles es un condicionante para la
aparición de estas especies por lo que su uso previo obliga también a
iniciar el tratamiento con antifungicos diferentes a fluconazol. El uso de
combinaciones lipídicas o nuevos antifúngicos como caspofungina o
voriconazol estará condicionado por la urgencia en conseguir dosis
terapéuticas adecuadas y por la disminución de efectos indeseables.
5 .3 Tratamiento
antibiótico específico
5.3.1 SC
por S. epidermidis o SCN
Siendo los gérmenes mas prevalentes, es dudosa la
necesidad de tratamiento antibiótico dada su teóricamente escasa
mortalidad, y su alta adherencia al catéter, por lo que parece que una vez
retirado éste la administración antibiótica puede obviarse si el enfermo
permanece estable y desaparece el cuadro infeccioso. No obstante en el
estudio de Vallés y col. sobre bacteriemia nosocomial la mortalidad se
situaba en el 17% [31]. Probablemente deben tratarse además de a los
pacientes que presentan signos de sepsis grave o shock séptico, a aquéllos
con factores de riesgo (inmunodeprimidos, prótesis valvulares o
endovasculares) o con complicaciones sépticas (endocarditis, metástasis,
tromboflebitis). Cualquiera de los antibióticos descritos en el apartado
anterior para el tratamiento empírico de los CGP es efectivo para este
grupo de gérmenes. La duración del tratamiento varía de 1 a 4 semanas,
según se trate de un paciente estable o con complicaciones sépticas [1].
5 .3.2 SC
por S. aureus
Independientemente de su
nivel de resistencia, el S. aureus es un microorganismo con una elevada capacidad
para metastatizar y producir complicaciones sépticas, por lo cual la
retirada del catéter es obligada. En el caso de S. aureus sensible
a meticilina (SASM) el antibiótico de
elección es cloxacilina. Tanto glicopéptidos como Q/D o linezolid se han
mostrado igualmente eficaces en el tratamiento de las bacteriemias por
SAEM.
El tratamiento ha de ser prolongado desde dos semanas
en los casos no complicados a seis en aquéllos en que se han observado
metástasis sépticas graves como osteomielitis, o endocarditis [32].
5 .3.3 SC
por bacilos gram negativos
La retirada del catéter junto a un tratamiento
antibiótico adecuado (tabla V) durante 7-10 días asegura casi el 100% de
curación de los pacientes.
5 .3.4 SC
por Candida sp.
Se recomienda la retirada del catéter y mantener el
tratamiento antifúngico hasta 15 días después del último hemocultivo
negativo [33]. C. albicans y C. parapsilosis suponen el 90% de
las BRC, y responden de forma adecuada a fluconazol a dosis de 400-800 mg / día.
Por el contrario, C. glabrata y C. krusei son intrínsecamente resistentes a
fluconazol, por lo que es obligatorio su tratamiento con otros antifúngicos
(anfotericina B, caspofungina o voriconazol).
-
Ariza J, Leon
C, Rodriguez Noriega A, Fernandez-Mondejar E. Conclusiones de la
conferencia de consenso en infecciones por catéter.
Med Intensiva 2003; 27: 615-620.
-
O'Grady NP, Alexander M, Dellinger EP, Gerberding JL,
Heard SO, Maki DG et al. Guidelines for the Prevention of Intravascular
Catheter–Related Infections. Clin Infect Dis 2002; 35:
1281-1307.
-
National Nosocomial Infections Surveillance (NNIS)
System Report, data summary from January 1992 through June 2003, issued
August 2003. Am J Infect Control 2003; 31:
481-498.
-
Brun-Buisson C. Suspected central venous
catheter-associated infection: can the catheter be safely retained?
Intensive Care Med 2004; 30: 1005-1007.
-
Charalambous C, Swoboda SM, Dick J, Perl T, Lipsett
PA. Risk factors and clinical impact of central line infections in the
surgical intensive care unit. Arch Surg 1998; 133:
1241-1246.
-
Valles J, Leon C, Alvarez-Lerma F. Nosocomial
bacteremia in critically ill patients: a multicenter study evaluating
epidemiology and prognosis. Spanish Collaborative Group for Infections
in Intensive Care Units of Sociedad Espanola de Medicina Intensiva y
Unidades Coronarias (SEMIUC). Clin Infect Dis 1997; 24:
387-395.
-
Vaque J.,
Rosselló J. Evaluación de la prevalencia de las infecciónes nosocomiales
en los hospitales españoles. EPINE 1990-1999. MADRID: Sociedad Española
de Medicina Preventiva, Salud Pública e Higiene, 2001.
-
Alvarez-Lerma
F, Palomar M, Olaechea P, Insausti I, Berrmejo B, Cerdá E et al. Estudio
nacional de vigilancia de infección nosocomial en unidades de cuidados
intensivos. Informe del año 2001. Med intensiva 2003; 27: 13-23.
-
Rello J,
Ochagavia A, Sabanes E, Roque M, Mariscal D, Reynaga E et al.
Evaluation of outcome of intravenous catheter-related
infections in critically ill patients. Am J Respir Crit Care Med 2000;
162: 1027-1030.
-
Crowe M, Ispahani P, Humphreys H, Kelley T, Winter R.
Bacteraemia in the adult intensive care unit of a teaching hospital in
Nottingham, UK, 1985-1996. Eur J Clin Microbiol Infect Dis 1998; 17:
377-384.
-
Siegman-Igra Y, Golan H, Schwartz D, Cahaner Y, De
Mayo G, Orni-Wasserlauf R. Epidemiology of vascular catheter-related
bloodstream infections in a large university hospital in Israel. Scand J
Infect Dis 2000; 32: 411-415.
-
Pelletier SJ, Crabtree TD, Gleason TG, Pruett TL,
Sawyer RG. Bacteremia associated with central venous catheter infection
is not an independent predictor of outcomes. J Am Coll Surg 2000;
190: 671-680.
-
Olaechea P,
Alvarez-Lerma F, Palomar M, Insausti JM, Cerda E, ENVIN-UCI. Impacto de
la bacteriemia primaria y relacionada a cateter con la estancia y
mortalidad de pacientes ingresados en UCI. Med
Intensiva 2004; 28
[S1]: 14.
-
Mermel LA, Farr BM, Sherertz RJ, Raad II, O'Grady N,
Harris JS et al. Guidelines for the management of intravascular
catheter-related infections. Clin Infect Dis 2001; 32:
1249-1272.
-
Safdar N, Maki DG. The pathogenesis of
catheter-related bloodstream infection with noncuffed short-term central
venous catheters. Intensive Care Med 2004; 30:
62-67.
-
Lane RK, Matthay MA. Central line infections. Curr
Opin Crit Care 2002; 8: 441-448.
-
Lorente L, Villegas J, Martin MM, Jimenez A, Mora ML.
Catheter-related infection in critically ill patients.
Intensive Care Med
2004; 30: 1681-1684
-
Warren D, Zack J, Cox M, Cohen M, Fraser VJ.
An educational
intervention to prevent catheter-associated bloodstream infections in a
nonteaching, community medical center. Crit
Care Med 2004; 31: 1959-1963.
-
Cobb DK, High KP, Sawyer RG, Sable CA, Adams RB,
Lindley DA et al. A controlled trial of scheduled replacement of central
venous and pulmonary-artery catheters. N Engl J Med 1992; 327:
1062-1068.
-
Leon C,
Alvarez-Lerma F, Ruiz-Santana S, Gonzalez V, de la Torre MV, Sierra R et
al. Antiseptic chamber-containing hub reduces central
venous catheter-related infection: a prospective, randomized study. Crit
Care Med 2003; 31: 1318-1324.
-
Widmer AF, Nettleman M, Flint K, Wenzel RP. The
clinical impact of culturing central venous catheters. A prospective
study. Arch Intern Med 1992; 152: 1299-1302.
-
McGee DC, Gould MK. Preventing Complications of
Central Venous Catheterization. N Engl J Med 2003; 348:
1123-1133.
-
Rijnders BJ, Peetermans WE, Verwaest C, Wilmer A, Van
Wijngaerden E. Watchful waiting versus immediate catheter removal in ICU
patients with suspected catheter-related infection: a randomized trial.
Intensive Care Med 2004; 30: 1073-1080.
-
Garnacho-Montero J, Garcia-Garmendia JL,
Barrero-Almodovar A, Jimenez-Jimenez FJ, Perez-Paredes C, Ortiz-Leyba C.
Impact of adequate empirical antibiotic therapy on the outcome of
patients admitted to the intensive care unit with sepsis. Crit
Care Med 2003; 31: 2742-2751.
-
Alvarez Lerma
F, Palomar Martinez M. Decálogo de normas para la utilización de
antibióticos en pacientes críticos. Med intensiva 2000; 24: 69-77.
-
Jordà Marcos
R. Factores pronósticos de la colonización e infección por hongos. In:
Alvarez Lerma F, editor. Infecciones fúngicas en pacientes críticos.
Madrid: ERGON, 2002: 185-198.
-
Nolla-Salas
J, Sitges-Serra A, Leon-Gil C, Martinez-Gonzalez J, Leon-Regidor MA,
Ibanez-Lucia P et al. Candidemia in non-neutropenic
critically ill patients: analysis of prognostic factors and assessment
of systemic antifungal therapy. Study Group of Fungal Infection in the
ICU. Intensive Care Med 1997; 23: 23-30.
-
Ibrahim EH, Sherman G, Ward S, Fraser VJ, Kollef MH.
The influence of inadequate antimicrobial treatment of bloodstream
infections on patient outcomes in the ICU setting. Chest 2000;
118: 146-155.
-
Gomez J,
Banos V, Simarro E, Ruiz J, Requena L, Perez J et al.
Nosocomial fungemias in a general hospital. Epidemiology and prognostic
factors. Prospective study 1993-1998. Enferm Infecc Microbiol Clin 2001;
19: 304-307.
-
Hoerauf A, Hammer S, Muller-Myhsok B, Rupprecht H.
Intra-abdominal Candida infection during acute necrotizing pancreatitis
has a high prevalence and is associated with increased mortality. Crit
Care Med 1998; 26: 2010-2015.
-
Vallés J, León C, Alvarez-Lerma F. Nosocomial
bacteremia in critically ill patients: a multicenter study evaluating
epidemiology and prognosis. Spanish Collaborative Group for Infections
in Intensive Care Units of Sociedad Espanola de Medicina Intensiva y
Unidades Coronarias (SEMIUC) . Clin Infect Dis 1997; 24:
387-395.
-
Paiva JA, Pereira JM. Treatment of the afebrile
patient after catheter withdrawal: drugs and duration. Clin Microbiol
Infect 2002; 8: 290-294.
-
Rex JH, Walsh TJ, Sobel JD,
Filler SG, Pappas PG, Dismukes WE et al. Practice guidelines for the
treatment of candidiasis. Infectious Diseases Society of America.
Clin Infect Dis 2000; 30: 662-678.
Ricard Jordà Marcos*, Jose Ignacio Ayestarán Rota ‡
*Clínica Rotger, ‡Hospital
Son Dureta, Palma de Mallorca
©REMI,
http://remi.uninet.edu. Noviembre 2004.
Palabras clave:
Catéter venoso central, Sepsis por catéter, Bacteriemia relacionada con
catéter, Tratamiento antibiótico.
Busque en REMI con Google:
Envía tu comentario para su
publicación |
|
|
|