3. INFECCION EN EL PACIENTE TRASPLANTADO
Continúan siendo una causa importante de morbilidad y mortalidad en el paciente trasplantado. De los trasplantes de órgano sólido, el hepático es el que se asocia con una mayor tasa de infecciones lo cual se debe a diversos factores tales como mayor complejidad y duración del acto quirúrgico, actuación sobre una cavidad contaminada (abdomen) y mala situación previa de la mayoría de los pacientes.
Las infecciones en el paciente trasplantado son producidas por distintos gérmenes según el tiempo de evolución lo cual es de indudable interés pues nos orienta a un diagnóstico etiológico.
3. 1. INFECCIONES PRECOCES (< 30 días)
Las infecciones precoces (propias del primer mes) tienen los mismos orígenes que en otros pacientes críticos postquirúrgicos: catéteres, herida quirúrgica, pulmón, infección intraabdominal (trasplante hepático), mediastinitis (trasplante cardiaco), tracto urinario (muy frecuente en el trasplante renal) o sepsis sin un origen definido. Quizás hay que añadir la posibilidad de afectación del sistema nervioso central, especialmente meningitis, que se da en estos pacientes y no en otros enfermos postquirúrgicos. Hay que destacar la posibilidad de infecciones de la herida quirúrgica con escasos signos inflamatorios locales.
Las infecciones precoces relacionadas con la cirugía (urinaria, por catéter, de herida quirúrgica) están causadas principalmente por bacterias tanto gram positivas (Staphilococcus y Enterococcus) como gran negativas (Enterobacterias, Pseudomonas, Acinetobacter) seguidas de hongos (Candida, Mucor, Aspergillus)25.
Son propias de los primeros días de postoperatorio y la mayoría de los episodios se asocian a un foco primario (los ya descritos) que a veces no es posible identificar implicándose en estos casos la translocación bacteriana de microorganismos entéricos. Los gérmenes no difieren de los antes indicados pero resaltar la frecuencia de la candidemia diseminada tras el trasplante hepático26. La sospecha de sepsis hace mandatorio el inicio precoz de antibioterapia de amplio espectro para cubrir gram positivos y gram negativos así como la búsqueda exhaustiva del origen.
Si no se obtiene respuesta y se deteriora la situación clínica se añadirá Anfotericina B, especialmente en el caso del trasplante hepático.
Es una complicación muy grave por su alta mortalidad que puede llegar al 60%. La presentación clínica no difiere de la de otros enfermos aunque a veces la sintomatología es escasa. Como ocurre en los enfermos críticos, es preciso realizar el diagnóstico diferencial con otras causas que justifiquen la aparición de un nuevo infiltrado radiológico con o sin fiebre.
Los gérmenes implicados siguen siendo bacterias nosocomiales. No obstante, también tiene una presencia importante Nocardia, Legionella pneumophila y Legionella micdadei, que si bien suelen aparecer tras el primer mes, también pueden ocurrir más precozmente27. Hay que resaltar que en el caso de los pacientes inmundeprimidos especialmente si reciben corticoides la presentación radiológica de la legionelosis puede ser atípica con infiltrados nodulares que incluso de cavitan28.
En cuanto a los gérmenes no bacterias hay que destacar el Pneumocystis carinii y hongos. En el primer caso aparece una hipoxemia grave con un infiltrado radiológico difuso intersticial o alveolar mientras que los hongos producen generalmente una neumonía parcheada con frecuente cavitación siendo muy característico la hemoptisis.
El manejo de estos pacientes pasa por la realización de técnicas invasivas para el diagnóstico etiológico y el inicio precoz de antibioterapia empírica en la que se recomienda incluir Eritromicina y cotrimoxazol amén de cubrir las bacterias nosocomiales.
3. 1. 3. Infecciones intra-abdominales
Son un problema propio del trasplante hepático: fístulas biliares, colangitis o abscesos intra-abdominales. La presencia de una fístula biliar o de un absceso hepático debe hacernos sospechar trombosis de la arteria hepática siendo en este caso muy común el deterioro de la función hepática y las bacteriemias recurrentes. La colangitis suele asociarse a una estenosis en la vía biliar26, 29.
Otra posibilidad es la perforación de víscera hueca con el desarrollo de un abdomen agudo. Las causas más habitules son la perforación de ulcus inducido por el empleo de esteroides o por diverticulitis previa27.
Los métodos diagnósticos son los habituales en este tipo de patología (ecografía y TAC). El tratamiento pasa cuando existe una colección por el drenaje percutáneo o quirúrgico de la misma. La antibioterapia precoz es mandatoria para cubrir anaerobios, enterobacterias y enterococos. El aislamiento de Candida u otros hongos en el material infectado obliga al tratamiento con antinfúngicos30.
El cultivo de bilis extraido del drenaje de Kehr es indicativo del gérmen implicado en la colangitis aunque diversos microorganismos, es especial Staphilococcus colagulasa negativo, pueden colonizar dicho fluido y el sistema31.
3. 1. 4. Mediastinitis
El 2,5% de los pacientes tras un trasplante cardiaco presentan una mediastinitis pero se acompaña de alta mortalidad. Los factores de riesgo son: esternotomía previa, hemorragia post-trasplante, rechazo agudo y soporte mecánico previo a la intervención32.
Los gérmenes más frecuentemente implicados son S. aureus y S. epidermidis con menor incidencia de bacterias gram negativas y hongos. Si los cultivos son repetidamente negativos debemos sospechar infección por Mycoplasma hominis lo cual no es muy común pero si es un causante descrito que que se asocia a una alta mortalidad si no se trata adecuadamente 31, 33.
Se presenta como un cuadro infección con drenaje a través de la herida quirúrgica y dehiscencia esternal.
La clínica y signos locales son suficientes para el diagnóstico pero a veces es útil realizar un TAC de tórax.
El tratamiento quirúgico precoz y la antibioterapia adecuada son obligados. En el caso de infección por M. hominis se recomienda tratmiento con doxiciclina y clindamicina. Las nuevas quinolonas, es especial la ofloxacina son también útiles34.
3. 1. 5. Infecciones del sistema nervioso central
La meningitis es el cuadro más frecuente y suele estar implicado la Listeria monocytogenes que puede cursar con bacteriemia. Los bacilos gram negativos nosocomiales y el S. aureus son igualmente comunes en estas infecciones35.
Otros patógenos que pueden estar implicados sobre todo tardíamente son hongos, especialmente Criptococcus neoformans, que es causa de meningitis y Toxoplasma gondii que puede causar meningoencefalitis difusa o abscesos cerebrales31.
La sintomatología puede no ser muy florida y faltan a menudo los característicos signos meníngeos sobre todo en el caso de meningitis por Listeria. Por ello, ante cualquier síntoma neurológico no explicado (cefalea persistente, disminución del nivel de conciencia, etc) se debe sospechar y realizar la punción lumbar.
Hay que hacer el diagnóstico diferencial con la meningitis aséptica que ocurre en los pacientes que reciben OKT3 y que suele ser autolimitada. Aparece en los primeros días de tratamiento y se debe a la liberación de citocinas tras la administración de este anticuerpo monoclonal36.
El tratamiento antibiótico dependerá de los gérmenes aislados pero empíricamente debemos cubrir la Listeria con Ampicilina (12 g/día).
Aparecen a partir del primer mes del trasplante quizás a excepción del Herpes simplex que ocurre en el postrasplante inmediato. Se debe generalmente a una reactivación en un sujeto previamente seropositivo27.
Se manifesta como lesiones vesiculosas y dolorosas en piel y orofaringe. No obstante puede ser causa de cuadros graves diseminados e incluso hepatitis.
El tratamiento es aciclovir a 5 mg/kg/8 horas durante 7 días. La mayoría de los grupos utilizan aciclovir de forma rutinaria como profilaxis con lo que reduce la incidencia de esta infección de forma eficaz37.
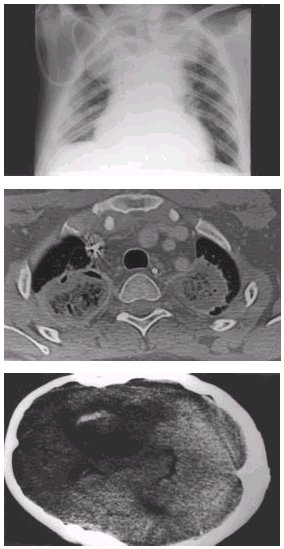
Figura 1
3. 1. 7. Infecciones fúngicas
Tienen una alta mortalidad y afectan especialmente a los receptores de un trasplante hepático26. Los altos requerimientos de transfusión durante el acto quirúrgico y la infección bacteriana asociada son factores de riesgo reconocidos para el desarrollo de una infección fúngica38.
Candida y Aspergillus son los causantes de más del 80% de los episodios. El primero suele producir infección de herida quirúrgica o candidemia a veces de origen en catéter venoso sobre todo en el primer mes. Raramente es causa de neumonía39.
Para la candidemia el tratmiento de elección es la anfotericina B a dosis de 0,7 mg/kg/día aunque el fluconazol se ha mostrado igualmente eficaz 13, 40. Hay que recordar que el fluconazol inhibe la actividad de citocromo p450 lo que hace que aumenten los niveles de ciclosporina A y FK 506 37, 41.
Sin embargo, las infecciones por Aspergillus y en menor medida Mucor aparecen a partir del primer mes post-trasplante y son causa grave de neumonía y enfermedad diseminada27.
En estos casos, la neumonía se acompaña con frecuencia de hemoptisis, que puede ser mortal, por la tendencia a invasión vascular de estos hongos. En la RX de tórax y sobre todo en el TAC se observan condensaciones generalmente periféricas que se cavitan. La enfermedad suele ser invasiva y se extiende a diversos órganos, en especial el sistema nervioso central causando abscesos cerebrales que se visualizan en el TAC (Figura 1). En este caso aparece coma, focalidad neurológica, convulsiones y datos de hipertensión endocraneal30.
La mortalidad asociada es muy elevada por lo que es fundamental el inicio precoz del tratamiento con anfotericina B a dosis de 1-1,5 mg/kg/día en el caso de Mucor y Aspergillus.
3. 2. INFECCIONES TARDIAS (> 30 días)
3. 2. 1. 1. Citomegalovirus
Es la infección vírica más común es causada en el paciente trasplantado y afecta con mayor frecuencia a los receptores de un trasplante hepático26. La infección por CMV que puede ser: primaria si el receptor es sero-negativo y la enfermedad es transmitida por injerto seropositivo o por hemoderivados; reactivación si el receptor es seropositivo y recibe un órgano seronegativo pero el virus latente se replica por la inmunosupresión o superinfección cuando paciente y donante son seropositivos42.
La infección primaria es la de mayor gravedad, siendo ésta superior cuando la infección se trasmite por el órgano trasplantado a cuando está relacionada con hemoderivados. Se acompaña de una alta letalidad y pérdida del injerto42.
La manifestación clínica más frecuente es el síndrome mononucleósido: fiebre, malestar general, mialgias y leucopenia siendo inconstante la presencia de linfocitos atípicos. Ocasionalmente puede existir rash cutáneo, alteración de la función hepática y trombocitopenia.
Más grave es la neumonía intersticial que no muestra ningún signo patognomónico. Hay que pensar en ella en todo paciente trasplantado que desarrolle neumonía especialmente si los cultivos son negativos. Además, puede ser causa de hepatitis, ulceraciones múltiples del tracto gastro-intestinal que suelen manifestarse por hemorragia digestiva o perforación de víscera hueca (especialmente en colon), pancreatiits y retinitis 27, 43.
El diagnóstico se realiza mediante cultivo de sangre que por técnica de shell vial puede obtenerse por tinción de inmunofluorescencia en 24-48 horas. El aislamiento de virus en orina o saliva no es indicativo de infección puesto que durante meses e incluso años puede permanecer positivo42. También se dispone de la detección de antigenemia del CMV. Se realiza mediante anticuerpos monoclonales que detectan el antígeno pp65 que es un antígeno tardío presente en los neutrófilos y monocitos infectados 44. Más recientemente se ha introducido la detección mediante PCR del DNA viral con una sensibilidad y especificidad similar a la antigenemia45, 46.
No tienen utilidad en estos casos los tests serológicos dado el tiempo que se requiere para la seroconversión y que la producción de anticuerpos precoces (IgM) puede estar bloqueada por la inmunosupresión.
Para la neumonía recurriremos también a la toma de muestra para cultivo mediante lavado broncoalveolar o incluso biopsia pulmonar43.
El tratamiento de elección es el ganciclovir a dosis de 10 mg/kg/día en dos dosis durante 10-14 días44. Como alternativa ante la no mejoría o efectos adversos no deseados (especialmente neutropenia) será el foscarnet a 60 mg/kg, 3 dosis al día. El efecto indeseable más frecuente del foscarnet es el fracaso renal aunque también es causa de convulsiones, neuropatía periférica o disfunción hepática43.
Para el caso de neumonía por CMV se debe añadir gammaglobulina hiperinmune contra CMV (CytotecR) en días alternos a 2 ml/kg lo cual se demostró eficaz en dos estudios realizado en trasplante de médula ósea 47,48. Su empleo en otros enfermos es discutido aunque se mostró beneficioso en un estudio realizado en trasplante hepático49.
3. 2. 1. 2. Virus de Epstein-Barr
La infección por el VEB ocurre a partir del primer mes de postoperatorio hasta en dos tercios de los receptores seronegativos (infección primaria) y en un tercio de los seropositivos (reinfección)50. Es causa de diversos cuadros linfoproliferativos que van desde una mononucleosis no complicacda que suele cursar sin amigdalitis ni adenopatías hasta la enfermedad linfoproliferativa post-trasplante (ELPT) que puede ser focalizada o generalizada afectando a ganglios linfáticos y órganos. La ELPT suele ser fatal y ocurre más comunmente en los casos de infección primaria, aumentando el riesgo de la misma con el empleo de OKT3 o en caso infección concomitante por CMV. Asímismo, el VEB es causa de hepatitis27.
La profilaxis para el VEB se realiza
con aciclovir o ganciclovir que igualmente se emplean para tratar estos
cuadros graves pero con dudosa efectividad51.
3. 2. 2. Infecciones por parásitos
3. 2. 2. 1. Toxoplasma gondii
Es una infección que afecta a los trasplantes cardiacos debido a posibilidad de trasmisión de quistes de Toxoplasma en el injerto lo cual no suele ocurrir con otros órganos.
Aparece a las 4-6 semanas en receptores seronegativos que reciben un órgano de un donante seropositivo aunque existen reactivaciones coincidiendo con la inmunusupresión en pacientes previamente seropositivos52.
Aunque en la persona inmunocompetente, la toxoplasmosis suele cursar como un síndrome mononucleósido, en el trasplantado se presenta como un cuadro grave, especialmente en los casos de pacientes seronegativos, con deterioro del estado general: fiebre, afectación neurológica (encefalitis principalmente) y puede confundirse con un rechazo.
El diagnóstico serológico consiste en la aparición de anticuerpos IgM en el caso de receptores seronegativos o al aumentar los títulos de IgG cuatro veces en las reactivaciones. El diagnóstico de certeza se realizar mediante biopsia endomiocárdica donde se observan los quistes de T. gondii acompañado de infiltración linfocítica e incluso necrosis de miocitos33.
En aquellos casos en que el receptor sea seronegativo y el donante seropositivo para T. gondii se debe realizar profilaxis con pirimetamina más ácido folínico o trimetropin-sulfametoxazol (TMP/SMX)53.
El tratamiento en la infección aguda es pirimetamina (100-200 mg el primer día como dosis de carga y después 25-50 mg día) más sulfadiazina (dosis inicial de 75 mg/Kg hasta 4 g y después 1 g/6 horas) con ácido folínico (5-10 mg/ día por vía oral) para evitar los efectos mielosupresores de la pirimetamina. Este régimen debe mantenerse durante 4-6 semanas. Como alternativa existe la combinación clindamicina más sulfadiazina54.
En aquellos casos de pacientes seronegativos que realicen seroconversión tras el trasplante cardiaco aunque no desarrollen enfermedad se recomienda igualmente tratamiento con pirimetamina más sulfadiazina con ácido folínico durante 4-6 semanas. Si bien existen casos comunicados de toxoplasmosis tras otros trasplantes de órgano sólido, la incidencia es tan baja que no se recomienda profilaxis rutinaria37.
